菌株YS(r)—19分离鉴定及对三七根腐病菌的抑菌活性
常征++王蓉+李洪潮+张铁++刘伟+沈清清+李付惠
摘要:以三七根腐病菌腐皮镰刀菌(Fusarium solani)为指示菌,采用含毒介质法和平板对峙法,从三七根际和根围土壤中分离筛选三七根腐病菌拮抗菌。结果表明,得到17株对三七根腐病菌具有较好拮抗效果的菌株,它们对指示菌菌丝生长的抑制率均大于50.00%,其中编号为YS(r)-19的菌株抑菌效果最明显,抑菌率为86.40%;选取6种三七根腐病菌测定其抑菌谱,结果显示YS(r)-19对三七根腐病菌具有广谱抗菌性,对选取的6种病原真菌抑菌率在 35.33%~86.40% 之间。通过形态特征、培养特征、生理生化特征和16S rDNA序列分析鉴定,确定该菌株为甲基营养型芽孢杆菌(Bacillus methylotrophicus)。
关键词:三七根腐病;生物防治;拮抗菌;分离筛选;抑菌活性
中图分类号: S432.4+4;S435.672文献标志码: A文章编号:1002-1302(2017)06-0092-04
三七[Panax notoginseng(Burk.)F. H. Chen],别称金不换、田七等,为五加科(Araliaceae)人参属(Panax Linn.)植物,其干燥根和根茎,是我国特有的名贵中药材,在我国明代张四维的《医门秘旨》、异远真人的《跌损妙方》中均有关于三七药用价值的正式文字记载,提到三七具有散瘀止血、消肿定痛之功效[1]。三七主要成分包括皂苷,非皂苷成分中的氨基酸与蛋白质、多糖、黄酮、炔、醇、挥发油、微量元素等[2]。药理作用主要体现在对血液系统、心脑血管系统、神经系统、代谢、免疫调节等方面的影响[3-4]。目前三七被广泛应用于跌打损伤、高血压、脑血管后遗症、冠心病、心绞痛等疾病的治疗中[5-6]。
近年来,由于三七无可替代的药用价值,使其用量和种植面积不断增加,三七特殊的生境及耕作方式造成其土壤环境微生态失衡[7]。以根腐病为主的土传病害是导致三七连作障碍的重要因素之一,长期以来阻碍着三七种植业的发展,至今仍未得到有效的解决[8]。
三七根腐病病状表现为地上部黄萎或青枯,三七根部腐烂,呈湿腐和干腐2型,发病地块病株率为5%~20%,严重时达70%,损失占各种三七病害的70%~85%[9]。三七根腐病致病机制目前还不清晰,报道的病原菌包括真菌、细菌和线虫,具有多样性,但以真菌为主,主要包括藨草镰刀菌(Fusarium scirpi)[10]、腐皮镰刀菌(Fusarium solani)[11-12]、人参链格孢菌(Alternaria panax)[13]、尖孢镰刀菌(Fusarium oxysporum)[14]、串珠镰孢中间变种(Fusarium moniliforme var. intermedium)[14]、双孢柱孢(Cylindrocarpon didynum)[15]、恶疫霉(Phytophthora cactorum)[15]、草茎点霉(Phoma herbarum)[15]等。
目前,三七根腐病以化学防治为主,其生物防治处于研究探索阶段。化学防治病原菌易产生抗药性,药剂残留会导致环境污染和农产品安全等问题。生物防治符合环境保护和农业可持续发展的要求,是未来农业生产中的重要植保措施。众多研究表明,使用生防菌剂可有效防治植物病害,而分离筛选高效生防菌株是开发生防菌剂的基础。据相关文献报道,从云南省文山市三七基地土壤中分离的3株芽孢杆菌(Bacillus sp.)对三七根腐病病原菌坏损(毁灭)柱孢(Cylindrocarpon destructans)具有明显的抑制作用[16]。从三七根际土壤中分离到棘孢木霉(Trichoderma asperellum)对三七黑斑病菌(Alternaria panax)、炭疽菌(Colletotrichum gloeosporioides)和根腐病菌均有较强的抑菌活性[17];三七内生真菌中存在对三七根腐病主要病原真菌具有良好抑制作用的菌种[18]。本研究以三七根腐病菌为指示菌,从种植三七的土壤中分离筛选出对三七根腐病菌有较好拮抗作用的菌株,并对其抑菌活性和抗菌谱进行研究,以期为三七根腐病生防制剂的开发提供菌种资源并形成理论支持。
1材料与方法
1.1材料
1.1.1土壤样品2014年7月13日从云南省文山州文山市砚山县分别选取1个三七园,采集园内病区和健康地块三七植株根际和根围土壤,共计4个样点,样品为5点混合样,采集后置于无菌封口袋内封口,于冰盒中保存,带回实验室分离。
1.1.2供试植物病原真菌病原菌:尖孢镰刀菌、藨草镰孢菌、人参链格孢菌、坏损(毁灭)柱孢菌、腐皮镰刀菌、双孢柱孢菌。
培养基:LB培养基、高氏1号培养基、马丁培养基、马铃薯葡萄糖琼脂培养基。
1.2方法
1.2.1菌株分离采用稀釋平板法分离菌株[19]。分别称取各土壤样品10 g,加入盛有100 mL无菌水的500 mL三角瓶中,摇床振荡10 min,制成土壤悬液,逐级吸取1 mL样品悬液加到9 mL无菌水中。依次按照10倍法稀释,制成10-1、10-2、10-3、10-4、10-5、10-6稀释度土壤悬液,涡旋振荡 1 min,分别吸取不同稀释度的土壤悬液100 μL,涂布于含 50 mg/L 重铬酸钾和50 mg/L制霉菌素的高氏1号培养基、马丁培养基以及LB培养基平板上,每个处理重复3次。将涂布好的高氏1号和马丁平板置于28 ℃恒温箱内培养72 h、LB平板置于37 ℃恒温箱内培养48 h,挑取培养特征相异的单菌落,经培养纯化后作为供试菌。分离得到的菌株经多次划线纯化并镜检后,转接到斜面上,4 ℃保存,每隔2个月活化1次。
1.2.2拮抗菌株筛选采用含毒介质法[20]筛选三七根腐病菌拮抗菌。将PDA培养基加热融化冷却至45 ℃左右,加入适量腐皮镰刀菌孢子悬液,混匀,调整孢子浓度至 106 CFU/mL,制板备用。将供试细菌在37 ℃下活化培养 24 h,真菌在28 ℃下活化72 h后点接于病原菌平板上,28 ℃培养 48 h,观察并测量抑菌圈,挑选抑菌效果较好的菌株进行复筛。
1.2.3抑菌谱测定采用平板对峙法[21]测定拮抗菌对供试6种三七根腐病菌的抑菌效果及抑菌谱。在PDA平板中间接1个直径为5 mm的供试三七根腐病菌菌饼,将初筛得到的拮抗菌株对称点接在平板边缘距指示菌菌饼25 mm处,每皿接4点,每个处理重复3次,以只接种病原菌的平板为对照,28 ℃ 培养。待对照平板长满菌丝后测量抑菌带宽度。
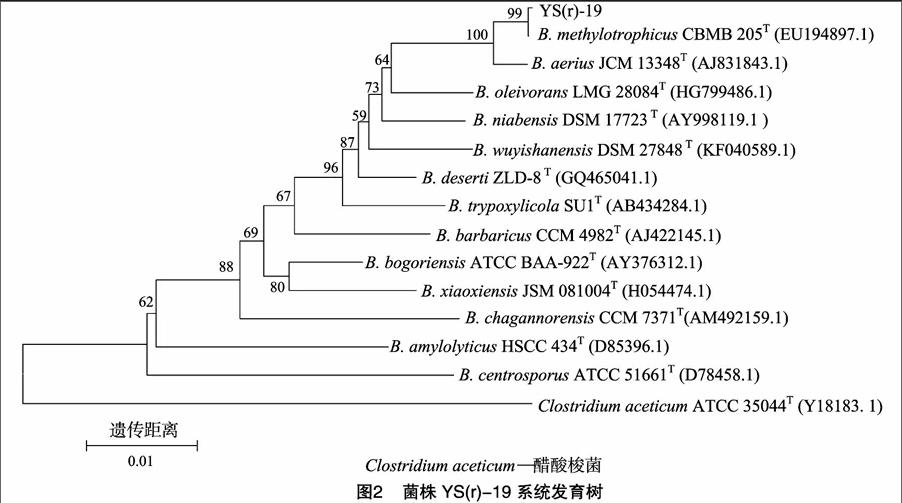
1.2.4菌株分类鉴定参照《伯杰细菌鉴定手册》[22]《常见细菌系统鉴定手册》[23]对待鉴定菌株形态和培养特征、生理生化特性进行测定。菌株16S rDNA序列测定及比对分析选用细菌16S rDNA通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′对菌株进行PCR扩增。PCR反应程序:94 ℃ 3 min;94 ℃ 45 s,54 ℃ 45 s,72 ℃ 1.5 min,35个循环;72 ℃ 10 min,4 ℃保存。PCR反应体系见表1。经1.0%琼脂糖凝胶电泳对扩增产物进行检测后送北京六合华大基因科技股份有限公司测序。双向测通拼接后,进行BLAST相似序列检索,选取相似性较高菌株的模式菌株为参比对象,采用MEGA 5.0软件邻接(Neighboue-Joining,简称NJ)法构建系统发育树并分析。
1.3数据分析
采用SAS 9.1和Excel 2010统计软件进行数据分析处理,用单因素方差分析各处理平均值的差异,用Duncans新复极差法比较各处理间的差异显著性。
2结果与分析
2.1拮抗菌株分离及筛选
从采集的土壤样品中,经平板涂布分离并划线纯化,共得到332株菌株,其中227株分离自根际土壤,105株分离自根围土壤,分别占总菌株数的68.37%、31.63%。通过镜检,结合菌落形态特征发现,分离到的菌株中,309株为细菌、23株为真菌。采用含毒介质法进行初筛,平板对峙法进行复筛,最终得到17株对三七根腐病菌拮抗活性较好的细菌,对三七根腐病菌抑菌率均大于50%,其中13株分离自根际土壤,4株分离自根围土壤,分别占76.47%、23.53%。其中,砚山病区土壤中的菌株YS(r)-19抑菌效果最显著,抑菌率为8640%,并且传代培养稳定性好(表2)。
2.2菌株YS(r)-19抑菌谱测定
菌株YS(r)-19对供试6种三七根腐病菌均有不同程度的抑制作用,其中对腐皮镰刀菌作用最强,抑菌率达到了8640%,对其余5种供试三七根腐病病原菌也有很強的抑菌效果,抑菌率在35.33%~72.13%之间,由此表明,菌株YS(r)-19对三七根腐病菌具有广谱抑菌活性(表3)。
2.3菌株YS(r)-19的鉴定
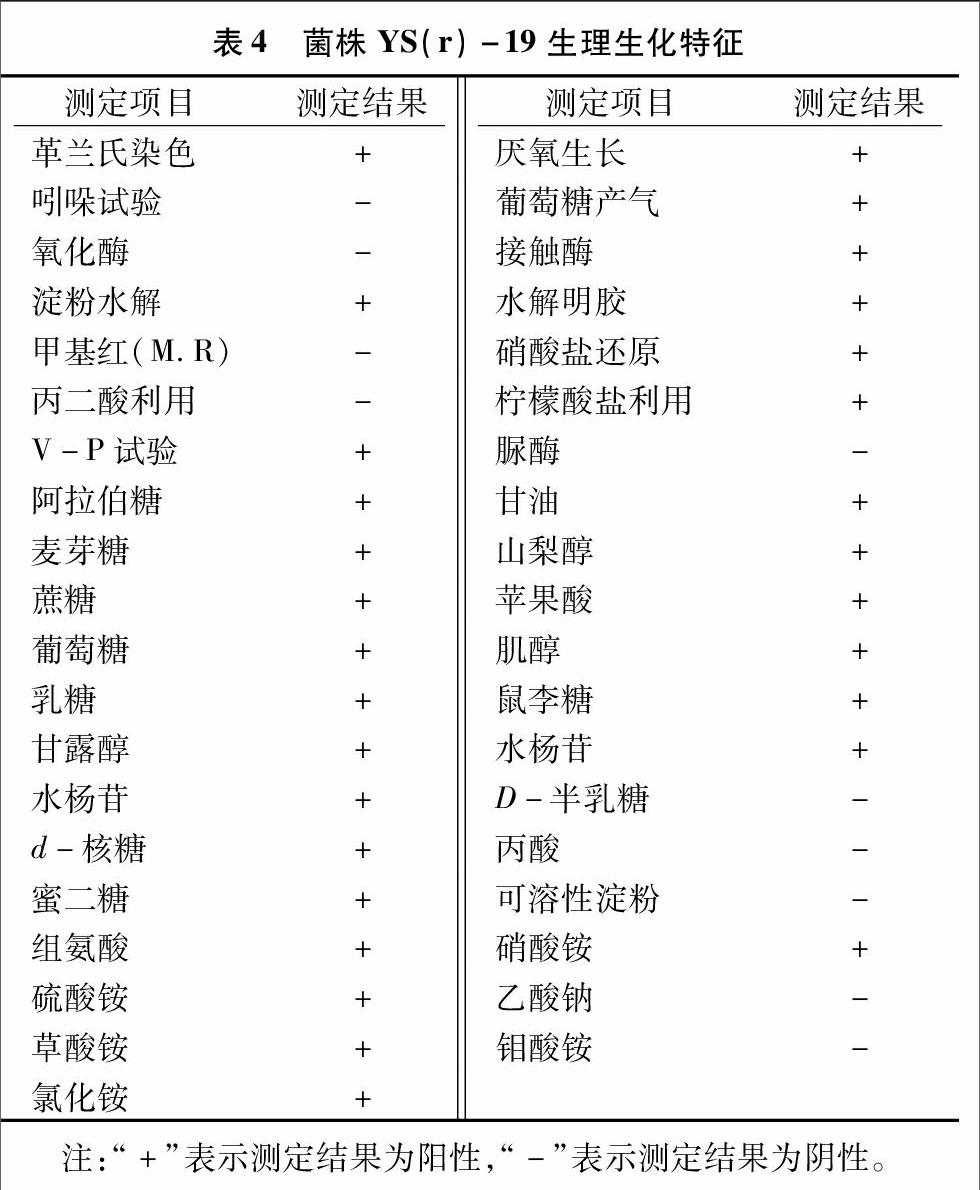
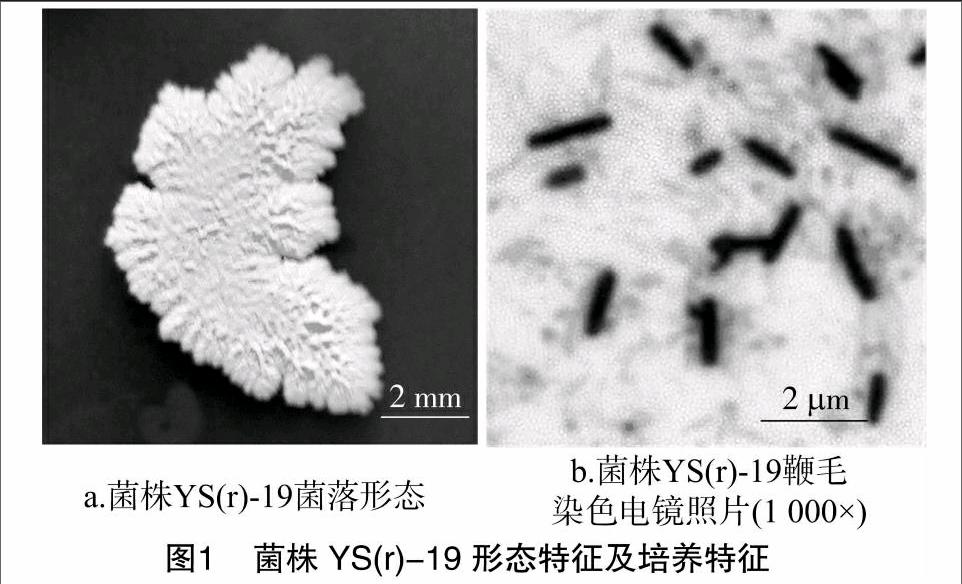
2.3.1形态特征、培养特征及生理生化特征在LB固体培养基上,菌株YS(r)-19生长良好,菌落呈乳白色,菌落表面褶皱粗糙,边缘呈锯齿状,菌落形态不规则。1 000倍电镜下,菌株YS(r)-19呈杆状,单个细胞大小为(0.5~0.6)μm×(2.0~2.5)μm,周生鞭毛,椭圆芽孢中生(图1)。结合该菌株生理形态特征及生化特征(表4),初步将菌株YS(r)-19归为芽孢杆菌属。
菌株YS(r)-19经16S rDNA测序,获得片段长度为 1 459 bp 的部分基因序列, 在NCBI数据库上的比对结果表明,该菌株与甲基营养型芽孢杆菌(Bacillus methylotrophicus)的相似性达99%以上,结合菌株的形态特征、生理生化特性,推测该菌株为甲基营养型芽孢杆菌。选择序列相关性较高的58个16S rDNA序列,用Cluxtal X序列软件分析该菌株相应序列与YS(r)-19的序列同源可靠性,选择13个可信度较
高的序列,用MEGA 5.0软件通过N-J法构建系统发育树,该菌株与甲基营养型芽孢杆菌模式菌株位于同一分支,且相似度达到99.9%(图2),确定YS(r)-19的进化地位,鉴定该菌株为甲基营养型芽孢杆菌。
3结论与讨论
本研究从三七植株根际土壤和根围土壤中分离三七根腐病菌拮抗菌。根际土是作物根系周围受根系分泌物影响的土壤,与根围土相比,由于根系分泌物的影响,根际的微环境中存在大量活性很高的微生物种群[24]。通过分离筛选,得到17株对三七根腐病菌具有较好拮抗活性的细菌,自然存在于根际环境中的很多微生物对病原菌的生存或侵染都有影响[25],筛选出来的活性菌株中,76.47%的菌株来自三七根际土壤,表明三七根际微生态中存在大量可开发的资源。
最终鉴定菌株YS(r)-19为甲基营养型芽孢杆菌。生防菌在根部定殖能力的强弱决定着生防的成功与失败,芽孢杆菌对环境有很强的适应性,在植物和土壤微生物群落中具有很大的优势,作为植物病害生防细菌开发具有很大潜力,其中部分性状优良的拮抗菌株已成功地运用于植物病害生物防治[26]。菌株YS(r)-19分离自三七根际土壤,它在三七根际土壤内应具有较好的定殖能力。首次分离到甲基营养型芽孢杆菌是在2009年,由Madhaiyan等从田间水稻根际土壤中分离出[27],随后陆续有研究发现,该菌株对水稻白叶枯病菌(Xanthomonasoryzaepv oryzae)[28]、细菌条斑病菌(Xanthomonas oryzae)[28]、稻瘟病菌(Pyricularia oryzae)[29]、烟草黑胫病菌(Phytophthora parasitica var. nicotianae)[30]、灰霉病菌(Botrytis cinerea nicoti-anae)[31]、番茄灰霉病菌(Botrytis cirerea)[29]、香蕉枯萎病菌(Fusarium oxysporum f. sp. cubense)[32]、黄瓜炭疽病(Colletotrichum orbiculare)[33]等均有很好的抑制效果,它对三七根腐病防治的研究未见报道。
目前三七根腐病的生物防治还处于起步阶段,本研究筛选出的菌株YS(r)-19用于开发三七根腐病生防菌剂潜力巨大,但如何让该菌株在三七根际有效定殖,在微生态中形成优势种群并发挥抗病作用及其培养和发酵条件等还有待深入研究。
参考文献:
[1]国家药典委员会. 中华人民共和国药典[M]. 北京:中国医药科技出版社,2015:11-12.
[2]夏鹏国,张顺仓,梁宗锁,等. 三七化学成分的研究历程和概况[J]. 中草药,2014,45(17):2564-2570.
[3]冯陆冰,潘西芬,孙泽玲. 三七的药理作用研究进展[J]. 中国药师,2008,11(10):1185-1187.
[4]王楠,万建波,李铭源,等. 三七治疗动脉粥样硬化的研究进展[J]. 中草药,2008,39(5):787-789.
[5]居乃香,孙静. 三七药理作用的研究进展[J]. 北方药学,2014,11(11):90-91.
[6]高艳芳. 三七总苷治疗冠心病临床疗效分析[J]. 医学信息,2009,22(6):1008.
[7]苗翠苹. 三七根际土壤微生物的群落特征[D]. 昆明:云南大学,2015.
[8]孙雪婷,李磊,龙光强,等. 三七连作障碍研究进展[J]. 生态学杂志,2015,34(3):885-893.
[9]董弗兆,刘祖武,乐丽涛. 云南三七[M]. 昆明:云南科技出版社,1988:103-114.
[10]浙江省卫生局. 浙江省栽培药用植物病虫害防治[M]. 杭州:浙江省卫生局,1952.
[11]曹福祥,戚佩坤. 田七根腐病的病原菌鉴定[J]. 植物病理学报,1991,21(2):89-93.
[12]阮兴业,罗文富. 云南省镰刀菌属(Fusarium)种类鉴定[J]. 云南农业大学学报,1986,1(1):1-13.
[13]王淑琴,于洪军. 三七根腐病的初步研究[J]. 特产研究,1989(2):7-10.
[14]王拱辰,陈鸿逵,骆平西. 三七根腐病病原菌分离、接种和药剂试验[J]. 植物病理学报,1991,21(2):144.
[15]缪作清,李世东,刘杏忠,等. 三七根腐病病原研究[J]. 中国农业科学,2006,39(7):1371-1378.
[16]刘立志,王启方,张克勤,等. 三七根腐病拮抗菌的筛选及活性产物的初步分离[J]. 云南大学学报(自然科学版),2004,26(4):357-359.
[17]叶云峰,付岗,胡凤云,等. 三七主要病害生防真菌F2的抑菌作用测定及其鉴定[J]. 西南农业学报,2015,28(5):2112-2115.
[18]张玉洁,李洪超. 三七内生菌分离及抗根腐病病原真菌筛选[J]. 北方园艺,2011(23):130-132.
[19]錢存柔,黄义秀. 微生物学实验教程[M]. 北京:北京大学出版社,1999.
[20]中国科学院土壤研究所微生物室. 土壤微生物研究方法[M]. 北京:科学出版社,1985:40-59.
[21]幕立义. 植物化学保护研究方法[M]. 北京:中国农业出版社,1991,76-79.
[22]布坎南,吉本斯. 伯杰细菌鉴定手册[M]. 北京:科学出版社,1984:797-822.
[23]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:353-390.
[24]Berg G,Kurze S,Buchner A,et al. Successful strategy for the selection of new strawberry-associated rhizobacteria antagonistic to Verticillium wilt[J]. Canadian Journal of Microbiology,2000,46(12):1128-1137.
[25]Pantelides I S,Tjamos S E,Striglis I A,et al. Mode of action of a non-pathogenic Fusarium oxysporum strain against Verticillium dahliae using real time QPCR analysis and biomarker transformation[J]. Biological Control,2009,50(1):30-36.
[26]陈中义,张杰,黄大昉. 植物病害生防芽孢杆菌抗菌机制与遗传改良研究[J]. 植物病理学报,2003,33(2):97-103.
[27]Madhaiyan M,Poonguzhali S,Kwon S W,et al. Bacillus methylotrophicus sp. nov.,a methanol-utilizing,plant-growth-promoting bacterium isolated from rice rhizosphere soil[J]. International Journal of Systematic and Evolutionary Microbiology,2010,60(10):2490-2495.
[28]陈新春,张喜喜,汪钱龙,等. 蔬菜根际细菌R2-2的鉴定及其抑菌活性[J]. 湖南农业大学学报(自然科学版),2012,38(2):177-180.
[29]陈太春. 秦岭森林土壤芽孢杆菌的分离筛选、鉴定及抑菌作用研究[D]. 陕西:西北农林科技大学,2011.
[30]冯云利,奚家勤,马莉,等. 烤烟品种NC297内生细菌中拮抗烟草黑胫病的生防菌筛选及种群组成分析[J]. 云南大学学报(自然科学版),2011,33(4):488-496.
[31]单宏英. 陈化烟叶表面有益微生物的分离筛选、鉴定及应用研究[D]. 陕西:西北农林科技大学,2012.
[32]黄霄,陈波,周登博,等. 菌株BM-24的分离鉴定及对香蕉枯萎病菌的抑菌活性[J]. 植物保护学报,2013,40(2):121-127.
[33]谢学文,董瑞利,石延霞,等. 黄瓜炭疽病拮抗细菌的筛选及其抑制效果[J]. 中国生物防治学报,2016,32(2):215-220.任锡毅,刘永翔,黄永会,等. 试管捕捉实时荧光RT-PCR法同时检测烟草花叶病毒病和马铃薯Y病毒病[J]. 江苏农业科学,2017,45(6):96-100.
doi:10.15889/j.issn.1002-1302.2017.06.024

