我国仿制药一致性评价品种探析
丁锦希+刘莹芳+郑翠微+姚雪芳+吴逸飞
摘 要 仿制药一致性评价作为提升仿制药质量重要举措,对促进医药产业升级、推进国家供给侧改革、提高公众健康福利有着重要意义。本文通过分析我国和日本评价品种范围及分阶段评价情况,并结合我国一致性评价实际推进情况,着重剖析我国一致性评价初期面临的品种问题,在此基础上,为我国一致性评价品种相关政策的完善提供建议。
关键词 仿制药一致性评价 评价品种 品种分类 分阶段评价
中图分类号:R954 文献标识码:C 文章编号:1006-1533(2017)07-0054-06
Analysis of the varieties of generics for quality consistency evaluation in China
DING Jinxi*, LIU Yingfang, ZHENG Cuiwei, YAO Xuefang, WU Yifei
(School of International Pharmaceutical Business, China Pharmaceutical University, Nanjing 211198, China)
ABSTRACT Quality consistency evaluation of generics is an important initiative to improve drug quality in China and also plays a significant role in promoting the upgrading of the pharmaceutical industry, the national supply-side structural reform and the public health and welfare. The variety problems which will be faced in the initial stage of generics quality consistency evaluation were focused on by analysis of the variety scope and the phased evaluation status in China and Japan based on the actual advancement of consistency evaluation so as to to provide academic reference for perfecting policies related to generics quality consistency evaluation.
KEY WORDS generics quality consistency evaluation; evaluation object; drug classification; phased evaluation
我国仿制药同剂型、同规格的药品品种甚多,数十家甚者上百家企业在同一品种的狭小领域进行激烈的价格竞争。相关数据显示,我国共有药品生产企业5 029 家,此次仿制药一致性评价工作几乎牵涉到了68%以上的药品生产企业[1]。目前,我国一致性评价仍处于起步阶段,政策已初步明确划定评价品种范围,并给出了首批评价名单及评价时限。本文将基于我国一致性评价品种政策规定和实践推进进度,理清我国一致性评价面临的问题,并借鉴域外一致性评价经验,从政策制定和企业实施层面为我国一致性评价的推进提供合理建议。
1 评价品种的内涵与意义
评价品种指的是仿制药质量一致性评价所针对的评价对象。具体涉及两方面内容:一方面,评价品种范围问题,需确定已上市仿制药需要开展一致性评价的品种类型及时间分界点;另一方面,一致性评价的品种选择问题。具体选择过程中存在两对矛盾。
其一,品种与资源间的矛盾。我国仿制药数量大、质量参差不齐,理应全数进行一致性评价,从而保证与原研药间的可替代性。但无论从企业、还是审核机构的角度来看,时间及资金均属有限,无法同时负担所有品种的评价工作。因此,需要考虑评价品种的开展次序问题。
其二,成本与效益间的矛盾。对于企业而言,一致性评价意味着高额的评价成本以及多方面的风险成本,但与之相对的效益优势尚未完全体现。在这样的情况下,政府如何界定评价品种、以怎样的标准进行品种分批,都将直接影响企业的品种选择决策,继而影响仿制药产业的变革。
综上,在一致性评价过程中厘清评价品种的问题至关重要。
2 日本品质再评价品种分析
日本在上世纪70年代曾批准大量仿制药,以致市场上出现仿制药品目繁多、质量参差不齐等现象。为了规制药品市场,日本先后进行过3次仿制药再评价。第3次再评价工程旨在通过溶出度评价手段提升仿制药质量,同时建立每一品种的参比制剂多条特征溶出曲线以确保仿制药质量在未来始终能处于较高水准,并能确保每批样品质量均一稳定。本文选取与我国的仿制药一致性评价工作最为类似的第3次药品品质再评价工程为例,对其评价品种范围进行说明。
2.1 评价品种范围
日本于1998年7月启动《药品品质再评价工程》,确定采用溶出度试验手段对已上市的口服固体制剂进行再评价。固體口服制剂之所以成为日本再评价工程的考察目标,是因为口服固体制剂给药之后,药物从制剂中的溶出、释放直接影响着制剂的吸收[2],与进入体内无需崩解的口服液体制剂或注射液相比,其体外溶出度对疗效具有较大影响。
日本再评价工程的评价品种范围是1997年前获批的处方药,具体剂型包括片剂(糖衣片、薄膜衣片、素片)、肠溶片剂、缓控释片剂、胶囊剂(包括硬胶囊与软胶囊)、肠溶胶囊剂、缓控释胶囊剂、细粒剂、散剂、肠溶散剂、颗粒剂、干混悬剂。例外情形包含:《日本药典》中已收载溶出试验项的品种、已规定溶出度试验的品种(1995年后申报的仿制药皆要求进行全面溶出比对研究)、非通过吸收发挥药效的品种、无必要采取溶出度评价[3]。
2.2 分阶段评价模式
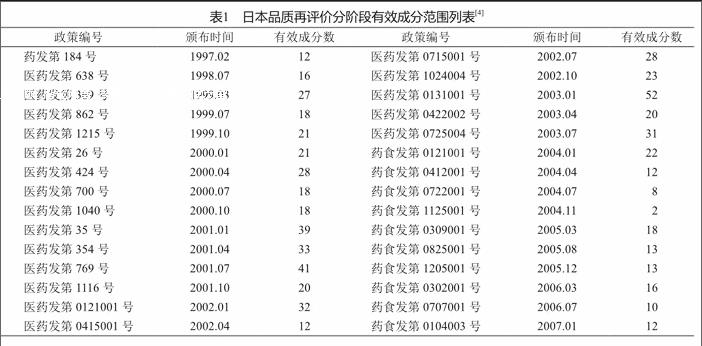
由于口服固体制剂类别药品众多,开展评价难度较大,因此,厚生省选取“有效成分”作为分阶段指标,自1997年2月起,每隔约3个月发布一份《再评价药品有效成分范围资料要求》(《医療用医薬品再評価に関し資料提出を必要とする有効成分等の範囲》)。《要求》中将明确列出该次纳入再评价的有效成分清单,含有该有效成分的药品均需开展再评价。具体信息如表1:
截至2012年1月,工作接近尾声,并已取得显著成效。根据上表内容,日本药品品质再评价以有效成分为指标,共完成30次有效成分范围确定,计636种有效成分。同时,厚生省发布36次再评价结果通知,共705种有效成分,1 361个制剂规格,共通过4 133个文号[5]。
综上,日本一致性评价分阶段推进的分批标准可归纳为“有效成分+剂型”。日本将同类有效成分同批审评并分批次推进,有利于评价工作的连贯性,同时也提高了再评价工作效率。
3 我国一致性评价品种现状分析
3.1 评价品种范围
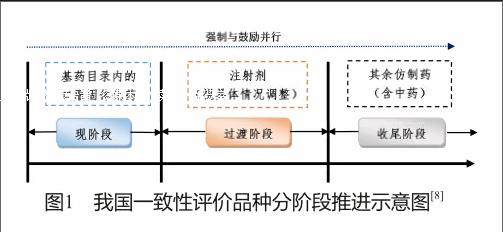
我国自2012年首次提出“仿制药质量一致性评价”这一概念以来,政府对于评价品种范围的界定也在不断发展,从模糊到明确。根据《国家食品药品监督管理局关于开展仿制药质量一致性评价工作的通知》(国食药监注[2013]34号)(以下简称“34号文”),我国一致性评价品种范围为:首先开展口服固体制剂的评价;其次开展注射剂的评价;最后开展其他剂型的评价。
我国首批仿制药一致性评价工作的具体品种范围为:2018年底前,国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂完成一致性评价。具体品种来源包括:国产仿制药、进口仿制药和原研药品地产化品种[6]。
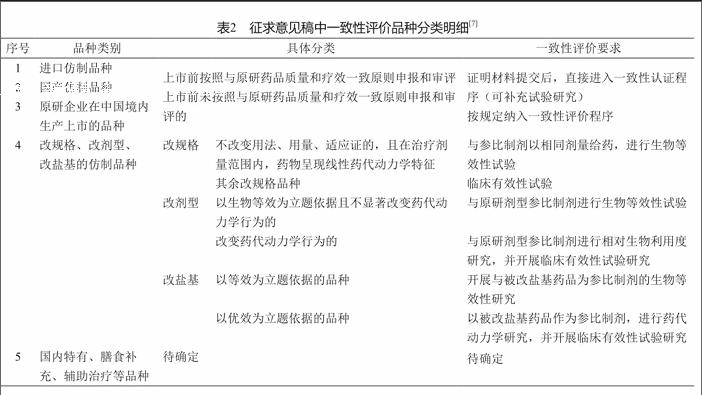
为进一步细化评价品种,CFDA于2016年11月29日组织起草了《仿制药质量和疗效一致性评价品种分类的指导意见(征求意见稿)》,列出五大类需要进行评价的药品品种(表2)。
此外,我国相关政策对已达到国际水平的仿制药予以“视同通过一致性评价”规定,即在评价品种范围中将其剔除,包括:国内药品生产企业已在欧盟、美国或日本获准上市的仿制药;在中国境内用同一条生产线生产上市并在欧盟、美国或日本获准上市的药品。此类“国际化”品种,经一致性评价办公室审核批准视同通过一致性评价。
3.2 评价品种进度安排
我国作为仿制药大国,拥有的仿制药批准文号数量极多,由此可见,开展仿制药一致性评价所涉及的范围极广,难度极大,为保证评价工作的有序进行,分阶段推进具有重要意义。根据34号文要求,我国仿制药一致性评价“分阶段实施”基本思路如图1所示。
现阶段,总局于2016年5月,发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2016年第106号)(以下简称“106号文”)中正式提出首批纳入评价的药品品种及评价时限,“(二)凡2007年10月1日前批准上市的列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂,原则上应在2018年底前完成一致性评价”。
据统计,首批一致性评价药品品种名单,共289种。该目录的统计日期是截至2016年3月5日为止,统计范围为2007年10月1日前批准的、且在有效期内的国产和进口口服固体基本药物化学药品。此次国家规定的首批评价品种所涉及的批准文号就有17 740个(包括17 636个国产批准文号和104个进口药品注册证),药品涉及1 817家国内企业和42家进口企业[9]。
对于非“289目录”口服固体制剂、注射劑和其他品种的一致性评价,目前尚未做出具体评价规定。但随着评价工作的推进,对其余剂型及品种的一致性评价工作也将逐步开展。以中药为例,现阶段其品种同样存在低水平仿制的现象[10],理应及早建立质量一致性评价体系,提高中药品种总体质量标准。
综上所述,我国分阶段评价细分标准可归纳为“基本药物+剂型”。从剂型角度讲,口服固体制剂具有使用量大面广的特点;从公众利益角度讲,我国从基药入手可以直接把握住对普遍大众影响最大的一部分药品类别,即可首先保障基础用量最大、供应量最具有保障的一部分药品的可替代性,有利于提高公众健康福利。
3.3 评价品种推进情况
参比制剂作为仿制药一致性评价的关键要素,为了保障目录品种能够按时完成评价工作,CFDA启动参比制剂备案与推荐程序。由于我国一致性评价仍处于起步阶段,尚未有企业完成相关品种的评价,因此,本文将从参比制剂备案中的品种和企业情况,间接呈现评价工作推进情况。
3.3.1 备案品种数目
目前,根据中检院对外公布的企业参比制剂备案最新信息,截至11月4日(国家最新发布日期),中检院已经接到企业申报的仿制药一致性评价备案共3 502件,其中属于“289目录”的品种有1 913件,非“289目录”1 589件。289个基药品种已备案227个[1]。
“289目录”品种按照通用名计备案率已达79%,绝大多数要求品种已经得到企业回应,将在未来开展相关一致性评价工作。但是仍有约21%的基药品种尚未有企业提出任何备案,可能是因为参比制剂查找困难,亦或该品种市场份额不大,企业还处于踌躇之中。与此同时,非“289目录”品种备案件数占总备案件数约45%。该结果表明,企业非常看重非“289目录”品种的长远市场,积极布局,可能是因为非“289目录”产品在市场中占据更大份额或更多利润。
3.3.2 备案企业
目前,中检院11月份公布的备案数据显示,已有461家企业备案或申报(少数厂家名称前后不一)。备案最多的企业是山东新华制药股份有限公司,其次为石药集团欧意药业有限公司。根据政策规定,一致性评价办公室在60个工作日内未提出异议的,企业即可开展相关工作研究。截至2017年2月,预计大部分企业在完成备案任务以后,已逐步开始实施仿制药一致性评价的工作。
4 我国一致性评价品种面临的问题
通过上述我国评价品种现状分析,与日本相比,可以看出,我国一致性评价实践进度与政策要求时限并不匹配,“289目录”品种能否在2018年前全部完成一致性评价尚无十足把握。这一显著的差异可能源于评价品种数量多,要求时限短,品种间差异大等多重因素。下文将基于评价品种从三方面对我国仿制药一致性评价面临的问题进行剖析。
4.1 品种数量多,时限短
我国首批一致性评价共289个品种,所涉及的批准文号17 740个。根据总局2016年8月发布的《关于2018年底前须仿制药质量和疗效完成一致性评价品种批准文号信息》[12],本文统计了不同品种所涉及批准文号数量(图2),其中仅涉及1个批准文号的药品为23个。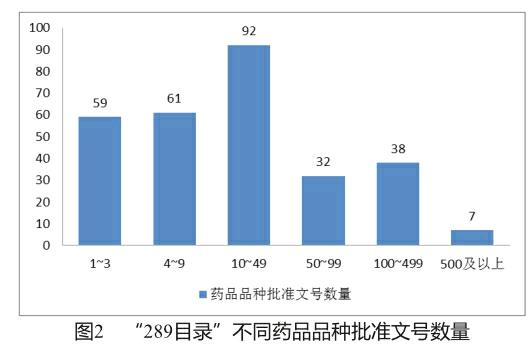
基于以上分析,“289目录”中大部分品种所涉批准文号较多,其市场竞争也相应激烈。由此可见,首批开展仿制药一致性评价所涉及的企业的范围之广,对一致性评价的开展造成了一定的难度。因此,品种数量多且时限短是我国仿制药一致性评价工作的显著问题。
此外,一些非“289目录”品种,由于存在采购政策优惠情况,例如,同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种[13]。很多非“289目录”品种由于和“289目录”品种是替代产品,或者品种利润较大,企业为抢占先机,也在积极备案、开展。
综上,我国目前的分批标准和市场引导政策,使众多企业、众多品种均在首批评价期限内集中在一起评价,而时间有限,导致一致性评价通道拥挤。因此,使得短时间内资源和品种的矛盾加剧。
4.2 品种间差异大,推进情况不一
本文通过分析“289目录”品种录备案情况发现,部分药品单品种待评价品种数量较多,也有一些品种备案数目较为冷清,目前,竞争最激烈的品种为阿莫西林胶囊、辛伐他汀片等,以阿莫西林胶囊为例,目前共有96条备案信息。然而,还有一些品种无人问津。截至2016年11月4日,仍有72个品种尚未完成备案,其中49个品种药品尚不存在可替代品种,占未备案品种数的68%。究其原因,部分品种未备案可能归因于以下几种情况:
其一,企业在面临高昂成本及紧迫时间的双重压力下,企业趋于选择回报高的热门品种;而小品种药则由于患者需求及购买量较小,生产成本相对较高等特点被忽略,因此,部分企业考虑放弃边缘药品[14],保障自己收益与成本达到平衡。此外,企业基于“成本-效益”考量,一些非“289目录”品种,已被纳入一致性评价目标,争先备案。
其二,部分品种一致性评价在实际操作中存在困难,例如麻醉药品和精神药品。此类产品属于严格管制的药品,从市场上购买参比制剂很难。此外,出于伦理考虑,该类药品无法做生物等效性试验,如含有吗啡的制剂,选择健康人作为受试者去服用吗啡不符合国内相关要求。
其三,还有一部分品种是我国自研自创的药品,包括有些复方制剂,以及含有中药成分的产品。此类品种的参比制剂难以获取,可能另需其他评价方法保障其药品质量,如自研自创基药品种可采取小规模的临床有效性试验,对其安全性与有效性进行再评价。
由此可见,我国仿制药品种间差异较大,其推进情况亦大相径庭,部分品种过度竞争,未备案品种如果被彻底放弃,2018年底大限到来后,将会从市场竞争中消失,其对应病种患者将失去用药保障。同时,也会造成短时间内一致性评价通道过度拥挤,资源不足,而企业积极推进的这些品种是否符合临床需求、医保政策要求也需进一步确定。
4.3 分階段评价的划分标准尚待完善
基于以上分析,我国仿制药一致性评价分批标准可以归纳为“基本药物+剂型”,日本则以“有效成分+剂型”为分批划分标准。本文将对这两者间的差异进行利弊比较分析(表3)。
根据上表,我国一致性评价目前的分阶段划分标准在药品可及性方面,具有明显优势,但基本药物仅为我国众多仿制药中极少的一部分,以此作为分批标准将面临以下问题:
首先,基药大部分利润空间较小,但一致性评价投入却极大,其收益与风险存在巨大反差,这可能造成企业放弃品种备案,不利于政策推进;其次,“基本药物”是一种铺开面较广的指标,但往往会忽略我国现存的一些特殊但突出的问题,比如对严重疾病药品质量的保障、对与原研药间的质量或价格存在巨大差异的仿制药可替代性保障,均考虑较少,不利于全面提高我国药品可及性。由此可见,我国具体分批标准的制定仍面临诸多影响因素,有待商榷。
5 我国一致性评价品种完善建议
根据前文分析,我国仿制药一致性评价具体实施过程中难度较大,因此,本文从评价品种角度,分别从政策制定层面和企业实施层面,为我国仿制药一致性评价进一步推进提出建议:
5.1 政策制定层面
5.1.1 对已公布评价品种进行再分类
基于我国仿制药品种现状,首批一致性评价面临品种数量多,且品种间差异大,而导致推进情况不一的问题。因此,本文建议我国对已公布品种进行再分类,如对于医保费用较高和市场容量比较大的品种,可从政策上鼓励并从市场上引导企业尽快完成一致性评价。对于一些特殊类型的品种,如国内自研自创品种、麻醉药品和精神药品等,可采取其他评价方式对其进行评估。也可借鉴日本经验,考虑是否可将“有效成分”作为评价品种的再分类标准。
5.1.2 结合国情,合理设置完成期限
根据前文研究,一致性评价面临的期限压力较大,一方面是短时间内完成的品种数量太多;另一方面是未通过一致性评价的品种在集中招标采购中可能不再被选用。若2018年前预定的一致性评价目标无法完成,优质药品将出现临床供应短缺的局面。因此,本文建议,在细分评价品种的同时,可根据实际操作难度,对不同品种给予合理的评价期限,制定分阶段、分批评价品种推进方案。
5.2 企业实施层面
5.2.1 对自有品种开展一致性评价的成本-效益分析
企业作为仿制药一致性评价主体,仿制药一致性评价工作的开展将直接对企业的经营产生影响。企业在一致性评价品种选择时,应对自有品种开展一致性评价的成本和市场效益进行科学测算,通过一致性评价开展成本-效益分析,就目标品种的立项可行性做出合理选择。
5.2.2 充分了解市场,避免集中申报
一致性评价为企业带来机遇的同时,也存在一定的风险,在一致性评价浪潮中,部分企业可能面临经营方式重组。企业在品种选择时,除了分析其成本和效益外,还应充分考虑一致性评价品种竞争风险,如目前阿莫西林胶囊已有96条备案信息,而政策规定,未来集中招标采购中,通过一致性评价的品种超过3家时,将不选用其余品种。因此,企业在品种选择时应综合考量风险范围,充分了解市场,避免集中申报。
参考文献
[1] 胡林峰, 虞忠. 仿制药一致性评价的产业影响研究[J]. 中国医药工业杂志, 2016, 47(8): 1097-1101.
[2] 郑洁, 陈玉文. 日本药品品质再评价工程对我国仿制药一致性评价的借鉴[J]. 中国药业, 2014, 23(18): 6-7.
[3] 谢沐风. 谢沐风解读《日本药品品质再评价工程》官方报告[EB/OL]. (2016-07-26)[2017-03-13]. http://www. tongxieyi.com/xieyihui/?act=view&vID=1209.
[4] 再评价资料集. 再评价审查通知[EB/OL]. [2017-03-13]. http://www.fpmaj-saihyoka.com/quality/index.html.
[5] 四方田千佳子. ジェネリック医薬品の品質と生物学的同等性試験ガイドラインにおける最近の動き[J]. Bull Natl Inst Health Sci, 2012(130): 1-12.
[6] 国家食品药品监督管理总局. 关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2016年第106号)[EB/OL]. (2016-05-26)[2017-02-27]. http://www.sda.gov.cn/WS01/CL0087/154042.html.
[7] 国家食品药品监督管理总局. 总局办公厅公开征求仿制药质量和疗效一致性评价品种分类的指导意见的意见[EB/OL]. (2016-11-29) [2017-03-05]. http://www.sda.gov.cn/ WS01/CL1757/166836.html.
[8] 国家食品药品监督管理总局. 关于开展仿制药质量一致性评价工作的通知(国食药监注[2013]34号)[EB/OL].(2013-02-16)[2017-02-27]. http://www.sda.gov.cn/WS01/ CL0844/78516.html.
[9] 许琳. 中国-东盟共谋药品合作发展新愿景[N]. 中国医药报, 2016-12-13(001).
[10] 徐亚静. 中药也应进行质量一致性评价[N]. 中国医药报, 2013-03-07(001).
[11] 中国食品药品检定研究院. 企业参比制剂备案情况的信息公开[EB/OL]. (2017-01-13) [2017-03-05]. http://www.nifdc. org.cn/fzy/CL0741/8953.html.
[12] 国家食品药品监督管理总局. 关于2018年底前须仿制药质量和疗效完成一致性评價品种批准文号信息[EB/OL].(2017-08-17)[2017-03-06]. http://www.sda.gov.cn/WS01/ CL1757/163161.html.
[13] 国务院办公厅. 国务院办公厅关于开展仿制药质量和疗效一致性评价的意见(国办发〔2016〕8号)[EB/OL].(2016-02-06)[2017-03-13]. http://www.gov.cn/zhengce/ content/2016-03/05/content_5049364.htm.
[14] 张敏. 仿制药一致性评价掀起行业供给侧改革:50%药品批文陷入“生死劫”[N]. 证券日报, 2016-05-30(C02).

