丹参酮Ⅰ、二甲双胍和阿司匹林联合用药对黑素瘤模型小鼠的抑瘤作用
赵亚宁,薛冰华,秦亚茹,吴祖泽,,段海峰
(1.天津大学制药工程系,天津 300350;2.北京放射与辐射医学研究所,北京 100850)
黑素瘤是迄今为止恶性程度最高且高度耐药的皮肤性肿瘤之一,起源于神经母细胞,产生黑色素,常见于皮肤、眼、黏膜上皮细胞、大脑和脊髓的脑脊膜[1]。近年来,肿瘤的免疫疗法成为研究热点之一[2],特别是靶向肿瘤微环境的肿瘤免疫疗法目前备受关注,研制出针对肿瘤微环境的肿瘤靶点抑制剂,如程序性死亡受体1(programmed death receptor-1,PD-1)抗体、细胞毒T淋巴细胞相关抗原4抗体[3]和抗血管生成药物[4]等。Zelenay等[5]联合使用阿司匹林(aspirin,Asp)和PD-1抗体治疗人黑素瘤取得了良好的疗效。
丹参酮Ⅰ(tanshinone Ⅰ,Tan Ⅰ)是从丹参中提取的具有抑菌作用的脂溶性菲醌化合物[6]。据报道,Tan Ⅰ可治疗多种肿瘤,在体外可通过诱导细胞凋亡抑制白血病[7]、肺癌[8]和乳腺癌[6]细胞生长。盐酸二甲双胍(metformin hydrochloride,Met)主要应用于治疗2型糖尿病。最近研究表明,Met具有抗肿瘤作用[9-11],单用能有效抑制成胶质细胞瘤的肿瘤干细胞[12]、乳腺癌细胞[13]和卵巢癌细胞[14],与其他化疗药物联用能增强化疗药物的抗肿瘤效果[13]。Asp是一种非甾体解热镇痛和抗炎药。已有研究表明,Asp对肺癌[15]、结直肠癌[16]和乳腺癌[17]等具有辅助抗肿瘤作用。但上述3种药物对黑素瘤的作用尚未见报道。因此,本研究采用Tan Ⅰ,Met和Asp联合用药的方案,探究3药联用对黑素瘤的抑瘤作用,并初步探讨其可能的作用机制。
1 材料与方法
1.1 实验动物、细胞、试剂和主要仪器
SPF级C57BL/6小鼠80只,雌性,6~8周龄,体质量18~20 g,购于军事医学科学院实验动物中心,生产许可证:SCXK(军)2012-0004,饲养于军事医学科学院实验动物中心动物房,室温21~25℃,相对湿度45%~65%。所有动物实验设计与操作均符合动物福利伦理委员会要求。B16F10细胞购自中国医学科学院基础医学研究所(北京协和细胞库),使用含10%胎牛血清的DMEM培养基,在5%CO2,37℃和饱和湿度的培养箱中培养。Tan Ⅰ(S90059)和Me(tD9351)均购自北京索莱宝科技有限公司;Asp(A6810)购自美国Sigma公司;吐温-80购自国药集团化学试剂有限公司;生理盐水购自石家庄四药有限公司;胎牛血清购自杭州四季青生物有限公司;DMEM购自美国Gibco公司;胰蛋白酶购自美国Invitrogen公司;FITC-抗小鼠CD3(-561798)、PE-抗小鼠CD4-(557308)、APC-抗 小鼠 CD25-(561048)和APC-抗小鼠CD8-(561093)抗体均购自美国BD公司;白细胞介素1β(interleukin-1β,IL-1β,EMC001b)、肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α,EMC102a)和IL-6(EMC004)ELISA试剂盒均购自欣博盛生物科技有限公司;肿瘤浸润组织淋巴细胞分离试剂盒(LTS1092Z)购自天津灏洋生物科技有限公司。数显游标卡尺购自桂林精密量具量仪有限责任公司;流式细胞仪购自美国BD公司;Varioskan Flash酶标仪和低温离心机购自美国Thermo公司。
1.2 黑素瘤模型小鼠的制备
将培养的B16F10细胞用0.05%胰蛋白酶-EDTA消化,生理盐水洗3次,锥虫蓝染色,计数细胞,细胞存活率>95%,用生理盐水重悬细胞至2.8×109L-1,小鼠右前腋下sc接种,每只0.1 mL。
1.3 动物分组和给药
小鼠sc接种B16F10细胞后根据体质量分为8组。模型组,每天ip给予Tan Ⅰ溶剂〔吐温-80∶生理盐水=1.25∶8.75(V/V),Tan Ⅰ用吐温-80 混匀,加入生理盐水稀释〕10 mL·kg-1;Tan Ⅰ组,每天ip给予 Tan Ⅰ20mg·kg-1[18];Asp组,给予Asp210mg·kg-1,37℃饮用水溶解后饮用(600 mg·L-1,7 mL·d-1),隔天更换含Asp的饮用水,临用前现配[5];Met组,给予Met 70 mg·kg-1,饮用水溶解后饮用(200 mg·L-1,7 mL·d-1),隔天更换含 Met的饮用水,临用前现配[19];Asp+Met组、Tan Ⅰ+Asp组、Tan Ⅰ+Met组和Tan Ⅰ+Asp+Met组分别按相同剂量相同途径给药,连续18 d。
1.4 小鼠体质量和肿瘤体积测量
从造模时起,小鼠隔天称重。肿瘤长出后,每天用游标卡尺测量肿瘤的长度和宽度,肿瘤体积=长度×宽度2/2。造模第19天,处死小鼠,立即解剖,称量小鼠体质量和瘤质量,计算肿瘤生长抑制率。肿瘤生长抑制率(%)=(1-药物治疗组瘤质量均值/模型组瘤质量均值)×100%。
同时取小鼠肝和脾,4%多聚甲醛固定,HE染色,观察组织病理改变。
1.5 流式细胞术检测肿瘤组织淋巴细胞百分比
剖取肿瘤,剪取1 cm×1 cm×1 cm的肿瘤组织,用10 mL注射器塞研磨并过400目筛网,细胞悬液390×g离心5 min,去上清,按照肿瘤浸润组织淋巴细胞分离试剂盒方法分离肿瘤组织淋巴细胞。
将分离得到的2×106个肿瘤组织淋巴细胞用PBS洗2次,转入流式管中,根据CD8+T,CD4+T和Treg细胞表面抗原特征分别加入2 μL FITC-抗小鼠CD3单克隆抗体(1∶50)、5 μL PE-抗小鼠CD4单抗(1∶20)、5 μL APC-抗小鼠CD25单抗(1∶20)和5 μL APC-抗小鼠CD8抗体(1∶20),用PBS将体系调整到100 μL,室温避光孵育30 min,孵育完成后用PBS洗2次,最后用PBS 400 μL重悬,流式细胞仪检测CD8+T,CD4+T和Treg(CD4+/CD25+)淋巴细胞百分比。
1.6 ELISA法检测肿瘤组织炎症因子含量
取0.3 g黑素瘤组织,加入预冷的PBS,匀浆器充分研磨,4℃,11000 ×g离心20 min,取上清,ELISA法检测IL-1β,TNF-α和IL-6炎症因子,具体步骤按照ELISA试剂盒说明书进行。
1.7 统计学分析
实验结果数据均以±s表示,使用GraphPad Prism5.0统计软件进行单因素方差分析(One-way ANOVA)和t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 Tan Ⅰ,Asp和Met联用小鼠体质量及脾和肝组织病理变化
药物治疗过程中,小鼠一般状态较好,各组小鼠体质量(包括瘤质量)均呈上升趋势(图1)。HE染色结果显示,各组小鼠肝和脾组织均未见明显病理变化(图略)。死亡小鼠肝和脾未检测。
2.2 Tan Ⅰ,Asp和Met联用对小鼠存活数的影响
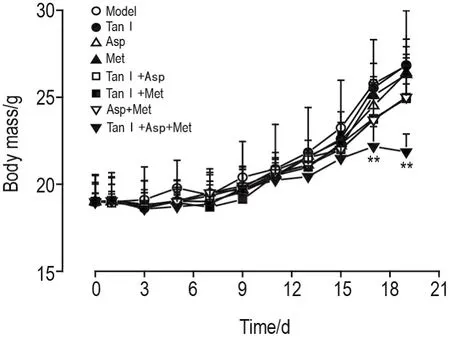
Fig.1 Effect of combination of tanshinone Ⅰ(Tan Ⅰ),aspirin(Asp)and metformin hydrochloride(Met)on body mass of mice with melanoma.C57BL/6 mice were sc given 0.1 mL B16F10 cells(2.8×109L-1)to prepare the subcutaneous transplantation tumor model.Then the mice were divided into 8 groups immediately and given Tan Ⅰ20 mg·kg-1ip once daily,Asp 210 mg·kg-1or Met 70 mg·kg-1orally in drinking water,for 18 d.±s,n=5-8.**P<0.01,compared with model group.
给药结束后,模型组小鼠存活数为8/10;Tan Ⅰ组为8/10;Asp组为7/10;Met组为7/10;Tan Ⅰ+Asp组为8/10;Tan Ⅰ+Met组为8/10;Asp+Met组为7/10;Tan Ⅰ+Asp+Met组为5/10,说明3药联用副作用较大。
2.3 Tan Ⅰ,Asp和Met联用对黑素瘤生长的抑制作用
图2和表1结果显示,荷瘤小鼠经过治疗后,与模型组比较,Tan Ⅰ,Asp和Met单用及两两联用组肿瘤体积和瘤质量无明显变化;Tan Ⅰ+Asp+Met组肿瘤体积和瘤质量较模型组明显降低(P<0.01,P<0.05),抑瘤率为46.2%,表明3药联用可有效抑制黑素瘤生长,效果优于3药单用或两两联用。
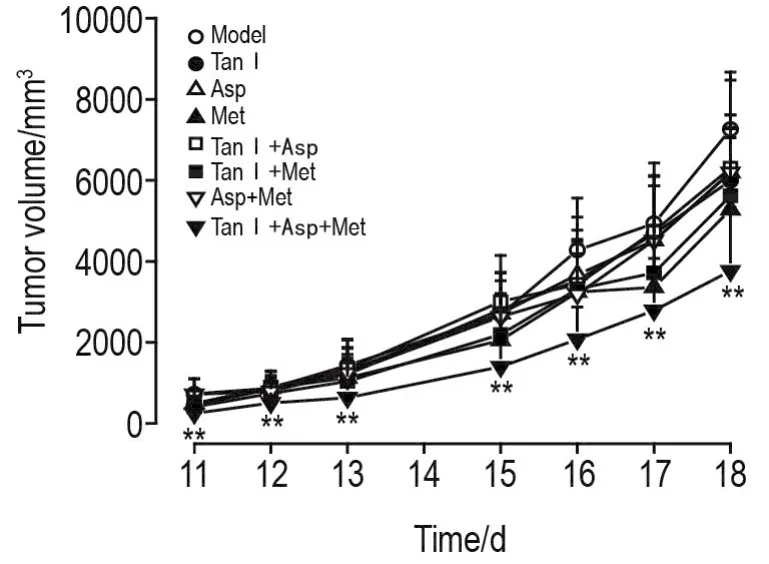
Fig.2 Effect of combination of Tan Ⅰ,Asp and Met on tumor volume of mice with melanoma.See Fig.1 for the mouse treatment.±s,n=5-8.**P<0.01,compared with model group.
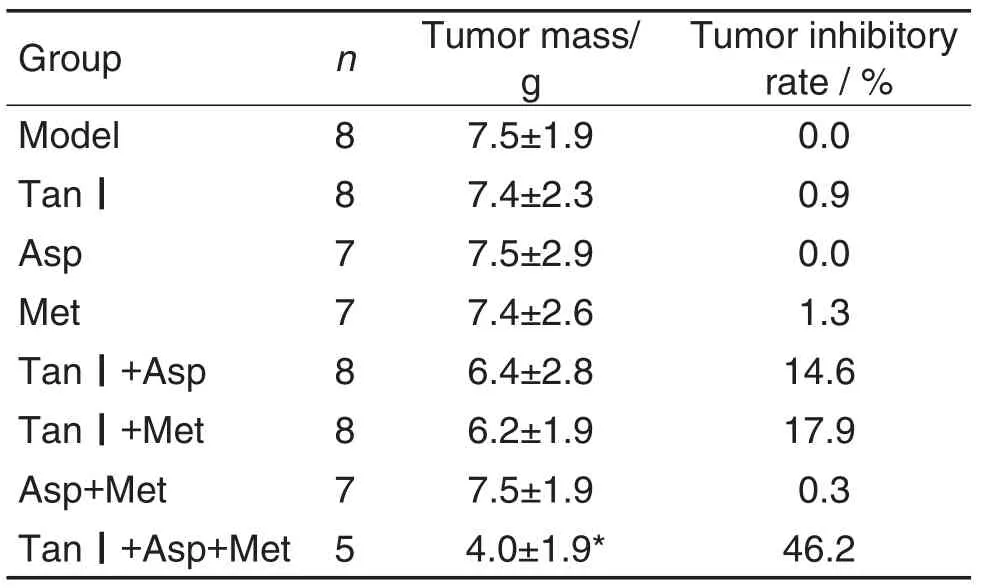
Tab.1 Inhibitory effect of combination of Tan Ⅰ,Asp and Met on tumor mass of mice with melanoma
2.4 Tan Ⅰ,Asp和Met联用对肿瘤组织淋巴细胞百分比的影响

Fig.3 Effect of combination of Tan Ⅰ,Asp and Met on tumor infiltrating lymphocytes of mice with melanoma detected by flow cytometry. See Fig.1 for the mouse treatment.
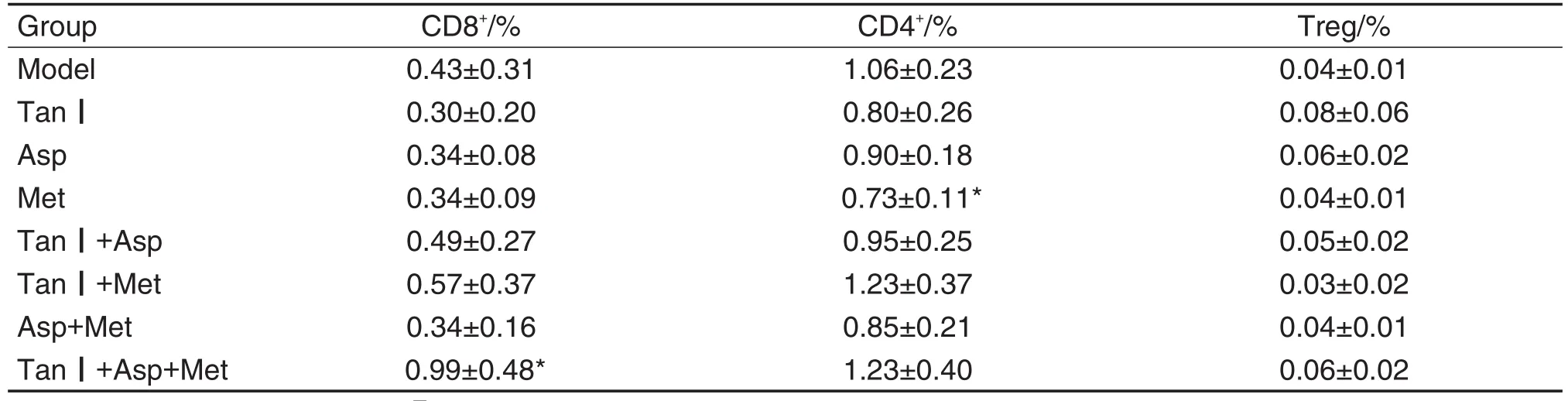
Tab.2 Effect of combination of Tan Ⅰ,Asp and Met on tumor infiltrating lymphocytes of mice with melanoma
图3和表2结果显示,与模型组比较,Tan Ⅰ,Asp和Met单用及两两联用组肿瘤组织中CD8+T和Treg淋巴细胞百分比无明显变化,Met单用组CD4+T淋巴细胞百分比减少(P<0.05)。Tan Ⅰ+Asp+Met组CD4+T和Treg淋巴细胞百分比无明显变化,CD8+T淋巴细胞百分比增加(P<0.05)。
2.5 Tan Ⅰ,Asp和Met联用对肿瘤组织中炎症因子含量的影响
由表3可以看出,Tan Ⅰ+Met组肿瘤组织中IL-6,IL-1β和TNF-α含量较模型组升高(P<0.01,P<0.05,P<0.05),Tan Ⅰ+Asp+Met组IL-1β和TNF-α含量无明显变化,IL-6含量升高(P<0.01)。
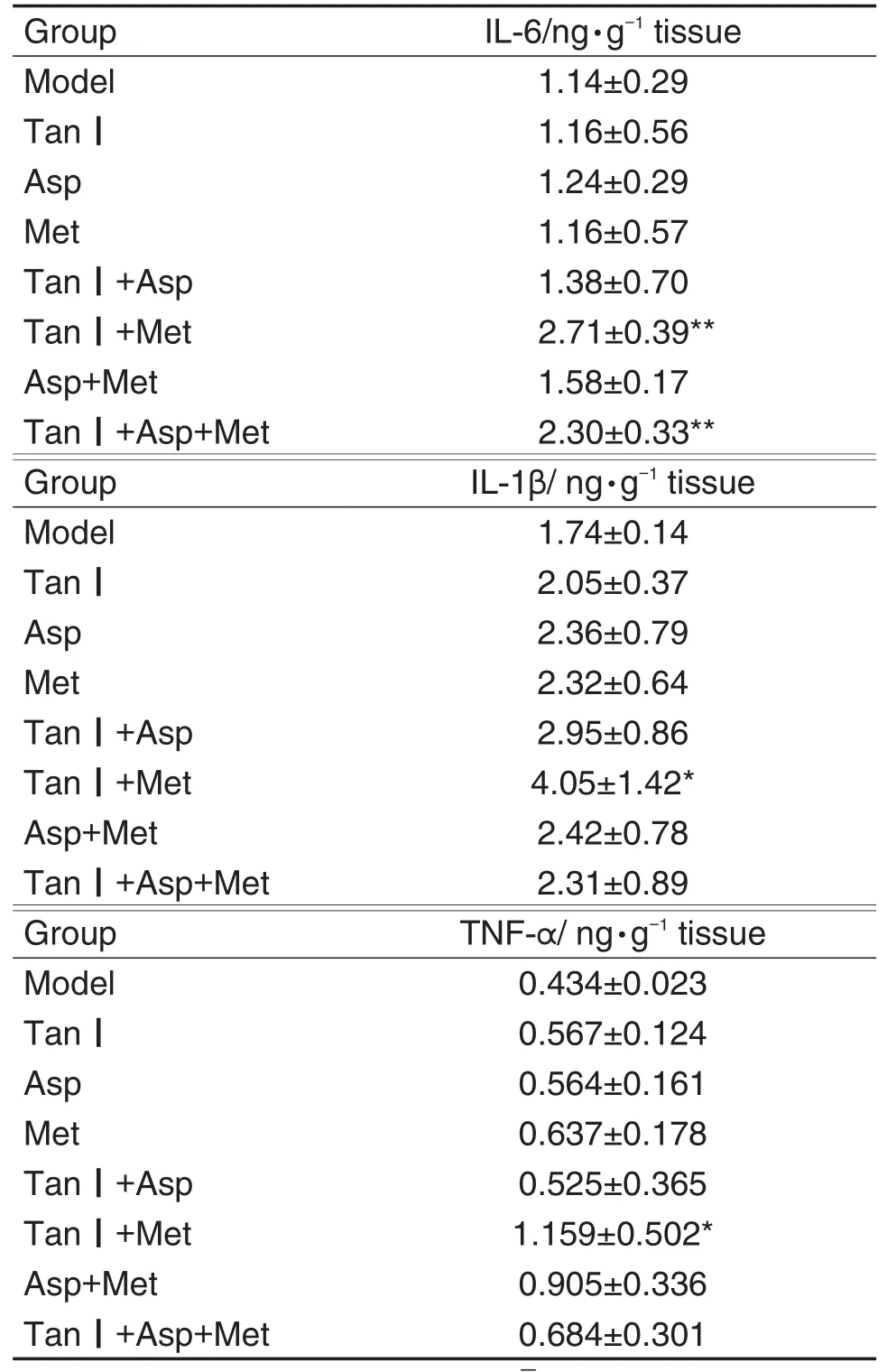
Tab.3 Effect of combination of Tan Ⅰ,Asp and Met on interleukin-6(IL-6),IL-1 β and tumor necrosis factor- α(TNF- α)content in tumor tissue of mice with melanoma detected by ELISA
3 讨论
本研究结果显示,Tan Ⅰ,Asp和Met单用及两两联用对肿瘤体积和瘤质量无明显影响,3药联用肿瘤体积和瘤质量明显降低,抑瘤率达46.2%。提示3药联用可有效抑制黑素瘤模型小鼠移植瘤生长,作用优于其单用或两两联用。另外,实验期间各组小鼠体质量(包括瘤质量)均呈上升趋势,只有3药联用组体质量增加减慢。至实验结束时,各组存活小鼠肝和脾组织均未见明显病理改变,但3药联用组小鼠存活数仅为5/10,明显少于其他各组,提示3药联用副作用较大。
近年来,在传统肿瘤治疗方法基础上,越来越多的学者探讨免疫系统的抗肿瘤作用。免疫细胞主要包括CD8+T细胞、CD4+T细胞、NK细胞和Treg细胞等,在清除肿瘤的过程中,前3种细胞发挥了较重要的作用[20]。Bronchalo-Vicente等[21]研究报道,经过李斯特菌治疗黑素瘤后,小鼠脾内的CD8+T细胞百分比显著增加。Du Four等[22]报道,经阿西替尼(axitinib)治疗后,黑素瘤荷瘤模型小鼠瘤体积显著减小,脾中CD8+T细胞百分比增加。本研究结果表明,Tan Ⅰ,Asp和Met单用及两两联用组肿瘤组织中CD8+T淋巴细胞百分比无明显变化,3药联用CD8+T淋巴细胞百分比增加。提示3药联用可有效地提高CD8+T细胞在黑素瘤组织的浸润,CD8+T细胞可能发挥了主要的抗肿瘤作用。
炎症与肿瘤的关系极其复杂,炎症可诱发细胞恶变,慢性炎症的可塑性和多样性可导致与肿瘤相关的炎症反应,且因肿瘤类型不同而不同。炎症的复杂性主要在于炎症反应中促炎和抗炎因子的含量不同。因此,调节不同炎症因子之间的平衡,在肿瘤免疫治疗过程中发挥重大作用[23]。本研究结果表明,Tan Ⅰ+Met组肿瘤组织中IL-6,IL-1β和TNF-α含量升高(抑瘤率为17.9%),3药联用组IL-6含量升高(抑瘤率为46.2%)。提示3药联用可有效抗肿瘤生长,可能与黑素瘤组织微环境中IL-6等炎症因子的变化有关,也可能与3药联用发挥抑瘤作用有关。
本研究发现,3药联用对黑素瘤模型小鼠有较好的抗肿瘤作用,未发现有明显的脾和肝组织病理变化,但小鼠死亡数达1/2。Met和Asp属于临床上常用的西药,而Tan Ⅰ是中药丹参的主要成分之一。据报道,中西药联用不当会产生毒副作用,如丹参中含有多种丹参酮类成分,与抗酸药物配伍产生络合反应而易形成螯合物,因而不宜与抗酸药物配伍使用,以免降低丹参的生物利用度,影响疗效[24-26]。陈琳[27]报道,Asp与复方甘草片联用,因Asp对胃黏膜有刺激,而复方甘草片含糖皮质激素,可使胃酸分泌增多,并减少胃液分泌,降低胃肠抵抗力。另外,傅厚道[28]报道,丹参及其制剂与Asp等抗凝血药物联用时,因具有类似药理作用,合用可表现为作用增强,但易导致出血。至于本研究中Tan Ⅰ,Asp和Met联用对小鼠是否存在急性损伤或其他副作用,导致小鼠死亡的原因是否与给药时间、给药剂量或给药途径等有关尚需深入研究。
参考文献:
[1] Ratnikov BI,Scott DA,Osterman AL,Smith JW,Ronai ZA.Metabolic rewiring in melanoma[J].Onco⁃gene,2017,36(2):147-157.
[2] Liu R,Zheng H,Li W,Guo Q,He S,Hirasaki Y,et al.Anti-tumor enhancement of Fei-Liu-Ping ointment in combination with celecoxib via cyclooxygenase-2-mediated lung metastatic inflammatory microenvironment in Lewis lung carcinoma xenograft mouse mode[lJ].J Transl Med,2015,13:366.
[3] Nakamura K,Okuyama R.Immunotherapy for advanced melanoma:current knowledge and future directions[J].J Dermatol Sci,2016,83(2):87-94.
[4] Dittz D,Figueiredo C,Lemos FO,Viana CT,Andrade SP,Souza-Fagundes EM,et al.Antiangiogenesis,loss of cell adhesion and apoptosis are involved in the antitumoral activity of proteases fromV.cundinamarcensis(C.candamarcensis)in murine melanoma B16F1[J].Int J Mol Sci,2015,16(4):7027-7044.
[5] Zelenay S, van der Veen AG,Böttcher JP,SnelgroveKJ, RogersN, ActonSE,etal.Cyclooxygenase-dependent tumor growth through evasion of immunity[J].Cell,2015,162(6):1257-1270.
[6] Nizamutdinova IT,Lee GW,Lee JS,Cho MK,Son KH,Jeon SJ,et al.Tanshinone Ⅰ suppresses growth and invasion of human breast cancer cells,MDA-MB-231,through regulation of adhesion molecules[J].Carcinogenesis,2008,29(10):1885-1892.
[7] Mosaddik MA.In vitrocytotoxicity of tanshinones isolated fromSalvia miltiorrhizaBunge against P388 lymphocytic leukemia cells[J].Phytomedi⁃cine,2003,10(8):682-685.
[8] Lee CY,Sher HF,Chen HW,Liu CC,Chen CH,Lin CS,et al.Anticancer effects of tanshinone Ⅰ in human non-small cell lung cancer[J].Mol Cancer Ther,2008,7(11):3527-3538.
[9] Bodmer M,Meier C,Krähenbühl S,Jick SS,Meier CR.Long-term metformin use is associated with decreased risk of breast cancer[J].Diabetes Care,2010,33(6):1304-1308.
[10] Libby G,Donnelly LA,Donnan PT,Alessi DR,Morris AD,Evans JM.New users of metformin are at low risk of incident cancer:a cohort study among people with type 2 diabetes[J].Diabetes Care,2009,32(9):1620-1625.
[11] Evans JM,Donnelly LA,Emslie-Smith AM,Alessi DR,Morris AD.Metformin and reduced risk of cancer in diabetic patients[J].BMJ,2005,330(7503):1304-1305.
[12] Sato A,Sunayama J,Okada M,Watanabe E,Seino S,Shibuya K,et al.Glioma-initiating cell elimination by metformin activation of FOXO3 via AMPK[J].Stem Cells Transl Med,2012,1(11):811-824.
[13] Talarico G,Orecchioni S,Dallaglio K,Reggiani F,Mancuso P,Calleri A,et al.Aspirin and atenolol enhance metformin activity against breast cancer by targeting both neoplastic and microenvironment cells[J].Sci Rep,2016,6:18673.
[14] Shank JJ,Yang K,Ghannam J,Cabrera L,Johnston CJ,Reynolds RK,et al.Metformin targets ovarian cancer stem cellsin vitroandin vivo[J].Gynecol Oncol,2012,127(2):390-397.
[15] Akhmedkhanov A,Toniolo P,Zeleniuch-Jacquotte A,Koenig KL,Shore RE.Aspirin and lung cancer in women[J].Br J Cancer,2002,87(1):49-53.
[16] Fink SP,Yamauchi M,Nishihara R,Jung S,Kuchiba A,Wu K,et al.Aspirin and the risk of colorectal cancer in relation to the expression of 15-hydroxyprostaglandin dehydrogenase(HPGD)[J].Sci Transl Med,2014,6(233):233re2.
[17] KastratiI, LitoshVA, Zhao S, AlvarezM,Thatcher GR,Frasor J.A novel aspirin prodrug inhibits NFκB activity and breast cancer stem cell properties[J].BMC Cancer,2015,15:845.
[18] Shan YF,Shen X,Xie YK,Chen JC,Shi HQ,Yu ZP,et al.Inhibitory effects of tanshinone Ⅱ-A on invasion and metastasis of human colon carcinoma cells[J].Acta Pharmacol Sin,2009,30(11):1537-1542.
[19] Hirsch HA,Iliopoulos D,Struhl K.Metformin inhibits the inflammatory response associated with cellular transformation and cancer stem cell growth[J].Proc Natl Acad Sci USA,2013,110(3):972-977.
[20] Highton AJ,Kojarunchitt T,Girardin A,Hook S,Kemp RA.Chitosan hydrogel vaccine generates protective CD8 T cell memory against mouse melanoma[J].Immunol Cell Biol,2015, 93(7):634-640.
[21] Bronchalo-Vicente L,Rodriguez-Del Rio E,Freire J,Calderon-Gonzalez R,Frande-Cabanes E,Gomez-Roman JJ,et al.A novel therapy for melanoma developed in mice:transformation of melanoma into dendritic cells withListeria monocytogenes[J].PLoS One,2015,10(3):e0117923.
[22] Du Four S,Maenhout SK,De Pierre K,Renmans D,Niclou SP,Thielemans K,et al.Axitinib increases the infiltration of immune cells and reduces the suppressive capacity of monocytic MDSCs in an intracranial mouse melanoma model[J].Oncoim⁃munology,2015,4(4):e998107.
[23] Coussens LM,Werb Z.Inflammation and cancer[J].Nature,2002,420(6917):860-867.
[24] Luo L.The review of adverse reactions caused by the combination of Chinese and Western medicine overseas[J].ACMP(中国医学报),2004,32(5):57-58.
[25] Li CH.The analysis of the improper use of Chinese and Western medicine in clinics[J].Chin Commu⁃nity Doctors(中国社区医师),2011,27(19):13.
[26] Wang XH,Huang FH.On the toxic side effects of traditional Chinese medicine and Chinese and Western medicine[J].Med Forum(基层医学论坛),2007,11(21):1016-1017.
[27] Chen L.The prescription analysis of unreasonableness of Chinese and Western medicine[J].Chin Med Mod Dist Edu China(中国中医药现代远程教育),2012,10(7):70-71.
[28] Fu HD.The application introduction of the compatibility of traditional Chinese medicine[C]//Proceedings of the 2005 Annual Academic Meeting of Chinese Herbal Medicine in Zhejiang Province(浙江省2005年中药学术年会论文集).Hangzhou:Zhejiang Association of Traditional Chinese Medicine,2005:30-31.

