上皮性卵巢肿瘤组织中PSMD10、Ki67的表达及其临床病理意义
于 歌 孙佳宁 冯晓玲
上皮性卵巢肿瘤组织中PSMD10、Ki67的表达及其临床病理意义
于 歌 孙佳宁 冯晓玲
目的 研究上皮性卵巢肿瘤组织中PSMD10和Ki67的表达及其临床病理意义。方法 通过免疫组化SP法检测21例卵巢良性肿瘤、31例卵巢交界性肿瘤、156例卵巢癌组织中PSMD10和Ki67的表达情况。结果 PSMD10和Ki67在卵巢癌组织中的阳性表达率显著高于卵巢交界性肿瘤和良性肿瘤(P<0.05)。PSMD10在卵巢癌组织中的阳性表达率与患者的年龄、病理类型无统计学意义(P>0.05),而与临床分期、病理分级和残留肿瘤直径有统计学意义(P<0.05)。卵巢癌组织中PSMD10和Ki67的表达呈正相关(P<0.01)。结论 PSMD10和Ki67在上皮性卵巢癌的发生、发展中起到了重要的协同作用,可作为判断卵巢癌恶性程度、病情进展的重要指标,联合检测用于指导临床诊断。
卵巢癌;PSMD10;Ki67;免疫组化
目前我国卵巢癌发病率逐年增加,并呈年轻化趋势[1]。卵巢癌死亡率居妇科恶性肿瘤之首[2],卵巢癌患者的治疗仍未得到有效控制[3]。因此,进一步研究卵巢癌致病因素和发生机制,明确靶向治疗方向是目前临床上控制和治疗卵巢癌的重要研究方向[2]。
细胞核增殖抗原Ki67是一种编码于10号染色体的DNA结合蛋白,定位于增殖细胞的细胞核中,在G1、S、G2和M期均有表达[4],并在肿瘤细胞有丝分裂过程中起到重要作用[5]。Ki67被认为是反映恶性肿瘤生物学行为的理想指标[6]。有研究显示增生期血管瘤内皮细胞中Ki67的表达显著高于其在退化期和正常皮肤组织内的表达[7]。PSMD10(Proteasome265 subunit,non-ATpase10),又名Gankyrin、p28或p28GANK,定位于人类Xq22.3[8]。该基因所编码的蛋白具有226个氨基酸残基,相对分子量25×103,拥有7个锚蛋白重复序列,是一个在所有哺乳动物中高度保守的癌蛋白[9]。PSMD10能够与265蛋白酶的ATP酶相互作用,通过控制Rb和CDK4的磷酸化以及增加p53的泛素化来促进肿瘤细胞的增殖[10]。有研究报道,PSMD10在原发性肝癌、食道癌、胃癌、结直肠癌中呈高表达,而在正常消化组织中呈弱阳性甚至阴性表达,说明其可能参与了肿瘤的发生、发展过程[11]。
本研究联合检测PSMD10和Ki67在卵巢上皮性肿瘤中的表达,通过免疫组化等方法分析其临床意义及病理特征。探讨彼此之间作用关系,分析其在卵巢癌发生、发展过程中发挥的作用。
1 材料与方法
1.1 标本来源
随机选取哈尔滨医科大学附属肿瘤医院2013年2月—2015年12月妇科诊断证实的原发性卵巢上皮性肿瘤组织标本208例,年龄30~70岁,平均年龄50岁,临床病例资料完整,所有病例术前均未接受放、化疗及免疫治疗。病理类型:卵巢癌156例,交界性浆液性卵巢肿瘤31例,卵巢良性肿瘤21例。病理分级:156例上皮性卵巢癌中低级别68例,高级别88例;临床分期:Ⅰ~Ⅱ期27例,Ⅲ~Ⅳ期129例;腹水:腹水<100 mL者37例,腹水≥100 mL者119例。卵巢癌的组织临床分期参照FIGO 2000年制定的标准,病理组织学分级根据WHO分级标准。
1.2 试剂
兔抗人PSMD10蛋白的单克隆抗体(Santa)、免疫组织化学超敏UltraTMSP试剂盒(Kit=9710)购自福州迈新生物技术有限公司;DAB显色剂盒(ZLT-9031)购自中杉金桥生物技术公司;兔抗人PSMD10蛋白的单克隆抗体购自美国Santa公司。
1.3 方法
采用免疫组化SP法,PSMD10抗体用PBS 1∶50稀释为工作液。10%福尔马林固定手术标本,常规石蜡包埋,4 μm厚连续切片,贴于涂有多聚赖氨酸的载玻片上。切片染色前常规脱蜡、水化,修复抗原,0.3%H2O2溶液阻断内源性的过氧化物酶,全部操作过程均按SP试剂盒说明完成。用已知的阳性切片作为阳性对照,用磷酸盐缓冲液(PBS缓冲液)代替一抗作为阴性对照。每次试验均设置阴性对照组。
1.4 结果判定
以细胞浆或细胞膜内呈棕黄色细颗粒状着色为PSMD10蛋白表达阳性。参照综合染色强度和阳性细胞数(占总细胞数的百分比)来进行半定量处理。(1)染色强度按下列评分标准评分:细胞无显色者为0分,细胞呈浅黄色者为1分,细胞呈棕黄色者2分,细胞呈棕褐色者为3分;(2)阳性细胞数评分方法:阳性细胞占总细胞的0~10%者为0分,10%~50%者为1分,51%~80%者为2分,>80%者为3分。上述两项评分(1)+(2),以4分为界,≥4分者为高表达,<4分者为低表达。
Ki67阳性染色定位于细胞核。细胞核或胞浆内有棕褐色或棕黄色着色为阳性,切片结合阳性染色癌细胞的染色程度和比例来评分:着色率≥30%为(+),<30%为(-)。
1.5 统计学方法
采用SPSS 18.0统计软件对数据进行统计学处理,采用Fishers精确检验及卡方检验分析PSMD10与临床病理因素的关系,等级相关采用Spearman等级相关分析,P<0.05认为差异有统计学意义。
2 结果
2.1 PSMD10、Ki67在卵巢肿瘤组织中的表达
PSMD10在卵巢良性、交界性和癌组织中总阳性率分别为4.8%、22.58%、55.78%。Ki67在卵巢良性、交界性和癌组织中总阳性率分别为9.52%、9.68%、60.90%。PSMD10和Ki67在卵巢癌组织中表达显著高于交界性和良性组织(图1)(P<0.05),在交界性和良性组织中低表达且无统计学意义(表1)。

表1 PSMD10和Ki67在上皮性卵巢肿瘤组织中的表达
2.2 PSMD10和Ki67在卵巢癌组织中的表达关系
卵巢癌组织中PSMD10和Ki67的表达呈正相关(P<0.01)(表2)。
2.3 PSMD10在卵巢癌组织中的表达
PSMD10在卵巢癌组织中的阳性表达率与患者的年龄、病理类型、腹水量、CA125值无关(P>0.05),而与临床分期、病理分级、残留肿瘤大小有关(P<0.05)(表3)。
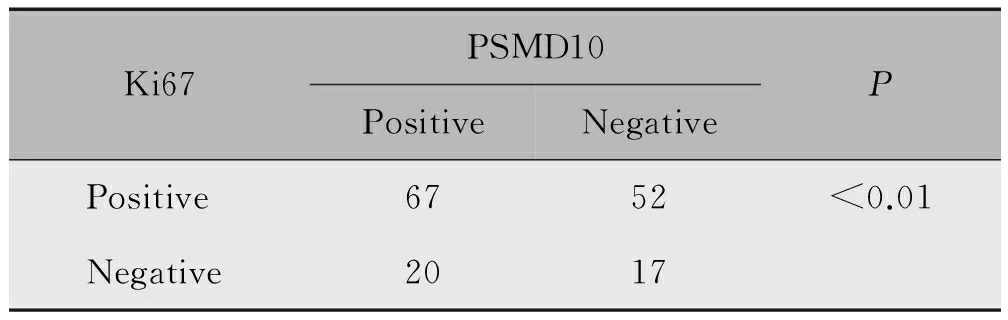
表2 PSMD10、Ki67在卵巢癌组织中的表达

表3 PSMD10表在卵巢癌组织中的表达

图1 PSMD、Ki67在卵巢肿瘤的免疫组化染色Figure 1 Immunohistochemical staining of PSMD and Ki67 in ovarian tumor tissuesNote:A-C.HABP-1 expression in benign,border and malignant tumor cells;D-F.Ki67 expression in benign,border and malignant tumor cells.
3 讨论
卵巢癌是女性常见的恶性肿瘤,发病率居妇科恶性肿瘤第三位,占全身恶性肿瘤的5%[12]。早期发现和有效的治疗方法是控制卵巢癌发生、发展的重要因素[13]。现阶段,卵巢癌以手术和化疗为主要治疗手段,但是由于盆腹腔存在广泛转移,手术的局限性以及化疗后出现耐药复发等使得卵巢癌晚期患者5年生存率仍停留在20%~25%[14],故寻求敏感的卵巢癌肿瘤标记物是目前研究的热点。
PSMD10由226个氨基酸组成,内含7个ankyrin重复序列,为26S蛋白酶复合体的调节亚基。有研究表明,PSMD10蛋白与癌症的形成和进展存在一定的相关性[11,15]。该基因在多种肿瘤组织中异常活化并高表达,其能够增加肿瘤细胞增殖速度,提高肿瘤细胞的侵袭和转移能力。Higashitisuji等发现在肝癌中,PSMD10能够通过CDK4磷酸化Rb诱导细胞发生转化,另外其还可以与MDM2结合增加p53的泛素化[16-17]。Man等[18]研究表明PSMD10可以调控RhoA/ROCK/PTEN信号通路,在RAS诱导的肿瘤形成过程中发挥重要作用。Zhang等[19]研究发现PSMD10可以激活PTEN/PI3K/AKT信号通路,在雌激素诱导的子宫内膜癌细胞增殖过程中发挥重要作用。以上研究表明PSMD10对于癌细胞的周期和进展至关重要,起到关键调节作用。Ki67在细胞增殖周期均有表达,且该标记物阳性率越高,肿瘤生长越快,组织分化越差,预后越差。因此,Ki67高表达的肿瘤细胞具有更高的侵袭和转移能力。本研究表明,PSMD10和Ki67可能存在广泛协同作用,两者都能够加快肿瘤细胞的增殖速度,缩短细胞周期,为肿瘤细胞侵袭和转移提供条件,且两者高表达均提示预后较差。
本研究主要讨论PSMD10和Ki67的高表达与上皮性卵巢肿瘤发生、发展之间的关系。我们通过分析208例卵巢肿瘤组织中PSMD10和Ki67的表达情况,发现PSMD10和Ki67在卵巢癌组织中的表达显著高于交界性和良性组织,提示PSMD10和Ki67的高表达与卵巢癌的发生有关。在PSMD10高表达的卵巢癌病例中,Ki67呈伴随性增高,且两者呈正相关。PSMD10在卵巢癌组织中的阳性表达率与患者的年龄和病理类型无关,而与病理分级、临床分期和残留肿瘤大小有关,分化程度低、临床分期晚、残留肿瘤大小超过2 cm相应PSMD10高表达。在腹水量≥100 mL、CA125值≥35 U/mL的病例中,PSMD10的阳性率增高。实验结果表明PSMD10表达越高,临床期别越晚,肿瘤恶性程度越高,肿瘤增殖和侵袭能力越强,预后越不理想。
综上所述,PSMD10和Ki67的异常表达在卵巢癌发生、发展中具有重要作用,两者间存在某种调控关系,能够彼此上调和协同,促进卵巢癌细胞增殖和侵袭。PSMD10和Ki67如何作用于肿瘤组织,与残留肿物大小关系有待于进一步研究。
1 Saini U,Naidu S,ElNaggar AC,et al.Elevated STAT3 expression in ovarian cancer ascites promotes invasion and metastasis:a potential therapeutic target[J].Oncogene,2016,197(10):1038-1047.
2 Zhang LL,Xu YL,Tang ZH,et al.Effects of alisol B 23-acetate on ovarian cancer cells:G1 phase cell cycle arrest,apoptosis,migration and invasion inhibition[J].Phytomedicine,2016,23(8):800-809.
3 Nishida N,Murakami F,Higaki K.Detection of serous precursor lesions in resected fallopian tubes from patients with benign diseases and a relatively low risk for ovarian cancer[J].Pathol Int,2016,66(6):337-342.
4 Zeggai S,Harir N,Tou A,et al.Immunohistochemistry and scoring of Ki-67 proliferative index and p53 expression in gastric B cell lymphoma from Northern African population:a pilot study[J].Gastrointest Oncol,2016,7(3):462-468.
5 Dmitrenko AP.Lateral differences in Ki-67 in breast cancer[J].Mol Clin Oncol,2016,4(6):1041-1044.
6 Alves AV,Ribeiro DR,Lima SO,et al.Expression of Ki-67 and P16 INK4a in chemically-induced perioral squamous cell carcinomas in mice[J].Rev Col Bras Cir,2016,43(2):72-79.
7 Himani B,Meera S,Abhimanyu S,et al.Ki-67 immunostaining and its correlation with microvessel density in patients with mutiple myeloma[J].Asian Pac J Cancer Prev,2016,17(5):2559-2564.
8 Soleimani M,Mirmohammad-Sadeghi H,Sadeghi-Aliabadi H,et al.Expression and purification of toxic anti-breast cancer p28-NRC chimeric protein[J].Adv Biomed Res,2016,19(5):70-88.
9 Lulla RR,Goldman S,Yamada T,et al.Phase 1 trial of p28(NSC745104),a non-HDM2-mediated peptide inhibitor of p53 ubiquitination in pediatric patients with recurrent or progressive central nervous system tumors:A Pediatric Brain Tumor Consortium Study[J].Neuro Oncol,2016,18(8):1319-1325.
10 Uddin MH,Choi MH,Kim WH,et al.Involvement of PSMD10,CDK4,and tumor suppressors in development of intrahepatic cholangiocarcinoma of syrian golden hamsters induced by clonorchis sinensis and n-nitrosodimethylamine[J].PLoS Negl Trop Dis,2015,9(8):e0004008.
11 Chen BF,Suen YK,Gu S,et al.A miR-199a/miR-214 self-regulatory network via PSMD10,TP53 and DNMT1 in testicular germ cell tumor[J].Sci Rep,2014,18(4):6413-6420.
12 Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
13 Kurman RJ,Shih M.The origin and pathogenesis of epithelial ovarian cancer:a proposed unifying theory[J].Am J Surg Pathol,2010,34(3):433-443.
14 Cooke SL,Brenton JD.Evolution of platinum resistance in high-grade serous ovarian cancer[J].Lancet Oncol,2011,12(12):1169-1174.
15 Li J,Tian F,Li D,et al.MiR-605 represses PSMD10/Gankyrin and inhibits intrahepatic cholangiocarcinoma cell progression[J].FEBS Lett,2014,588(18):3491-3500.
16 Higashitsuji H,Itoh K,Nagao T,et al.Reduced stability of retinoblastoma protein by gankyrin,an oncogenic ankyrin-repeat protein overexpressed in hepatomas[J].Nature Medicine,2000,6(1):96-99.
17 Higashitsuji H,Itoh K,Sakurai T,et al.The oncoprotein gankyrin binds to MDM2/HDM2,enhancing ubiquitylation and degradation of p53[J].Cancer Cell,2005,8(1):75-87.
18 Man JH,Liang B,Gu YX,et al.Gankyrin plays an essential role in Ras-induced tumorigenesis through regulation of the RhoA/ROCK pathway in mammalian cells[J].The Journal of Clinical Investigation,2010,120(8):2829-2841.
19 Zhang J,Yang Y,Zhang Z,et al.Gankyrin plays an essential role in estrogen-driven and GPR30-mediated endometrial carcinoma cell proliferation via the PTEN/PI3K/AKT signaling pathway[J].Cancer Letters,2013,339(2):279-287.
(收稿:2016-09-22)
Expression of PSMD10 and Ki67 in epithelial ovarian carcinoma and its clinicopathological significance
YUGe,SUNJianing,FENGXiaoling
The First Hospital Affiliated to Heilongjiang University of Chinese Medicine,Harbin 150081,China
Objective The objective of this study was to investigate the expression of PSMD10 and Ki67 in epithelial ovarian tumors and its clinicopathological significance.Methods Immunohistochemical method was used to detect the expression of PSMD10 and Ki67 in 21 cases of ovarian benign tumor,31 cases of ovarian borderline tumor and 156 cases of ovarian cancer.Results The positive expression rate of PSMD10 and Ki67 in ovarian cancer was significantly higher than those of ovarian borderline and benign tumor(P<0.05).The positive expression rate of PSMD10 in ovarian cancer tissues was not different from others groups(P>0.05).There was significant different the positive expression rate of PSMD10 from clinical stage,pathological grade and residual tumor diameter(P<0.05).There was a positive correlation between the expression of PSMD10 and Ki67 in ovarian cancer(P<0.01).Conclusion PSMD10 and Ki67 play an important synergistic role in the carcinogenesis and progression of epithelial ovarian cancer.It can be used as an important index to judge the degree of malignancy and progression of ovarian cancer.Joint testing PSMD10 and Ki67 are used to guide the clinical diagnosis.
Ovarian cancer;PSMD10;Ki67;Immunohistochemistry
黑龙江省中医药大学附属第一医院(哈尔滨 150081)
于歌,女,(1985-),博士研究生,从事妇科肿瘤的研究。
冯晓玲,E-mail:doctorfxl@163.com
R737.31
A
10.11904/j.issn.1002-3070.2017.02.004

