利奈唑胺耐药粪肠球菌感染患者临床分离株与定植株同源性分析
蒲彰雅, 余治健, 陈 重, 邓向斌, 白 冰, 李多云, 刘晓军, 韩雪莹, 林佛君, 邓启文
(广东医科大学附属深圳市南山区人民医院 深圳市内源性感染诊治研究重点实验室,广东 深圳 518052)
·论著·
利奈唑胺耐药粪肠球菌感染患者临床分离株与定植株同源性分析
蒲彰雅, 余治健, 陈 重, 邓向斌, 白 冰, 李多云, 刘晓军, 韩雪莹, 林佛君, 邓启文
(广东医科大学附属深圳市南山区人民医院 深圳市内源性感染诊治研究重点实验室,广东 深圳 518052)
目的 研究1例患者体内利奈唑胺(LZD)耐药粪肠球菌临床分离株与定植株同源性特点。方法 对1例肺部感染患者分离的10株粪肠球菌(其中2株分离自尿标本,8株分离自粪便标本)进行细菌耐药分析,并通过脉冲场凝胶电泳(PFGE)确定粪肠球菌之间的同源性。结果 患者进行LZD治疗前后,尿标本分离出的2株粪肠球菌均为LZD耐药株(MIC值分别为8 mg/mL,16 mg/mL),粪便中培养挑取的8株(治疗前6株,治疗后2株),其中LZD敏感4株,中介2株,耐药2株(MIC值波动在0.25~12 mg/mL)。通过PFGE分型检测提示10株粪肠球菌具有同源性。结论 该例患者泌尿道和肠道检出的粪肠球菌具有同源性,提示LZD耐药肠球菌可能长期定植于患者体内,并可能发生移位导致耐药细菌感染。
利奈唑胺; 粪肠球菌; 临床耐药; 定植; 同源性
[Chin J Infect Control,2017,16(4):343-345,350]
粪肠球菌(Enterococcusfaecalis,E.faecalis)广泛分布在自然界,常栖居在人、动物的肠道和女性生殖道,是常见的一种条件致病菌。近年来随着抗菌药物的广泛应用,不断有临床耐药菌株出现,尤其是耐万古霉素肠球菌(vancomycin-resistantEnterococccu, VRE)等多重耐药菌株的报道不断增多,已经成为社区获得性感染和医院感染的主要病原体之一[1]。利奈唑胺(linezolid, LZD)是第一种应用于临床的口恶唑烷酮类抗生素,由于全新的分子结构和独特的抗菌机制,使其对包括VRE在内的大多数革兰阳性菌所致的感染具有较好的治疗作用,但随着LZD在临床上的应用,其耐药问题也逐渐出现,国内外不断有关于LZD耐药肠球菌的个例甚至是医院感染暴发的报道,多发生在暴露于利奈唑胺治疗以及延长疗程的患者中[2-4]。目前鲜有关于无LZD治疗史患者检出利奈唑胺耐药菌株的报道,对于这些患者其临床分离菌株与定植于患者体内菌株的同源性和突变规律有待进一步明确。本研究从1例从未使用过LZD的肺炎患者临床尿标本中分离出LZD耐药肠球菌,继之分别从尿和粪便中分离出多株LZD不敏感粪肠球菌,并通过脉冲场凝胶电泳(PFGE)进行同源性分析,初步探讨利奈唑胺耐药粪肠球菌的临床分离株与定植株的同源性。
1 材料和方法
1.1 菌株来源 1例肺部感染患者检出的10株粪肠球菌,其中2株分离自尿标本,8株分离自粪便标本。
1.2 仪器和试剂 粪肠球菌质控株ATCC 29212购自广东省临床检验中心,利奈唑胺耐药粪肠球菌标准株DENG 1(我科分离保存,Genebank 序列号 CP004081)和沙门菌h9812(我院微生物室保存)作为对照菌株,VITEK 2 compact全自动微生物分析仪(法国生物梅里埃公司),CTCA培养基购自青岛高科园海博生物技术有限公司,LZD为美国Pfizer公司产品,LZD E-test 条为法国梅里埃公司产品,细菌DNA提取试剂盒 QIAamp DNA Mini kit 为德国QIAGEN公司产品。
1.3 菌种鉴定和药敏试验 对于分离的菌株采用法国生物梅里埃VITEK 2 compact全自动微生物分析仪及配套的鉴定卡进行菌种的鉴定,菌株LZD的药敏试验通过E-test 测定,严格按照说明书进行操作。依据2013年版美国临床实验室标准化协会(CLSI)标准进行利奈唑胺的耐药结果判定[5]。粪肠球菌ATCC 29212为质控菌株。
1.4 细菌基因组DNA提取和PFGE 患者分离的粪肠球菌Ying 0-9,其菌株的基因组DNA采用SmaI酶消化法通过PFGE确定粪肠球菌菌株之间的同源性[6]。
2 结果
2.1 细菌分离过程 共分离粪肠球菌10株(其中来源于尿2株,粪便8株)。患者为1例64岁老年女性,于2015年8月诊断为肺部感染入院治疗,入院前从未使用过利奈唑胺药物治疗。2015年9月16日在治疗肺部感染过程中取患者尿标本,从中分离出1株LZD耐药的粪肠球菌(Ying 0)。2015年10月3日患者因左侧化脓性颌下腺炎调整为利奈唑胺(600 mg 静脉注射 q12h)抗感染治疗11 d,治疗前取粪便标本采用肠球菌选择性无抗和含有2 mg/mL LZD的CTCA培养基培养,挑取敏感、中介和耐药粪肠球菌共6株(其中Ying 1-3从无抗平板挑取,Ying 4-6从含LZD平板挑取)。2015年10月21日LZD治疗结束后再次从尿中分离出1株利奈唑胺耐药粪肠球菌(Ying 7),同时取粪便按照同样方法培养,分离出粪肠球菌株Ying 8(无抗CTCA平板分离) 和Ying 9(含LZD的CTCA平板分离)。
2.2 细菌耐药及同源性分析 在使用LZD治疗前后,尿标本分离的Ying 0和Ying 7,药敏试验提示均为利奈唑胺耐药菌株,同时对环丙沙星、头孢西丁、妥布霉素、呋西地酸、庆大霉素(高浓度)、四环素、复方磺胺甲口恶唑、利福平、奎奴普丁/达福普汀等耐药,但对呋喃妥因、氨苄西林、万古霉素、替考拉宁敏感,且LZD治疗后耐药菌株的MIC值明显升高,MIC值分别为8 mg/mL和16 mg/mL。在使用LZD前粪便培养分离的Ying 1-6,其中3株敏感,2株中介,1株耐药,MIC值波动在0.25~12 mg/mL;菌株Ying 8-9,在LZD治疗结束5 d后粪便培养分离,1株敏感,1株耐药(MIC值为12 mg/mL),10株菌株通过PFGE分型检测具有高度同源性,见图1。提示该患者尿标本检出的LZD不敏感菌株可能是肠道细菌移位所致,并长期定植于体内。
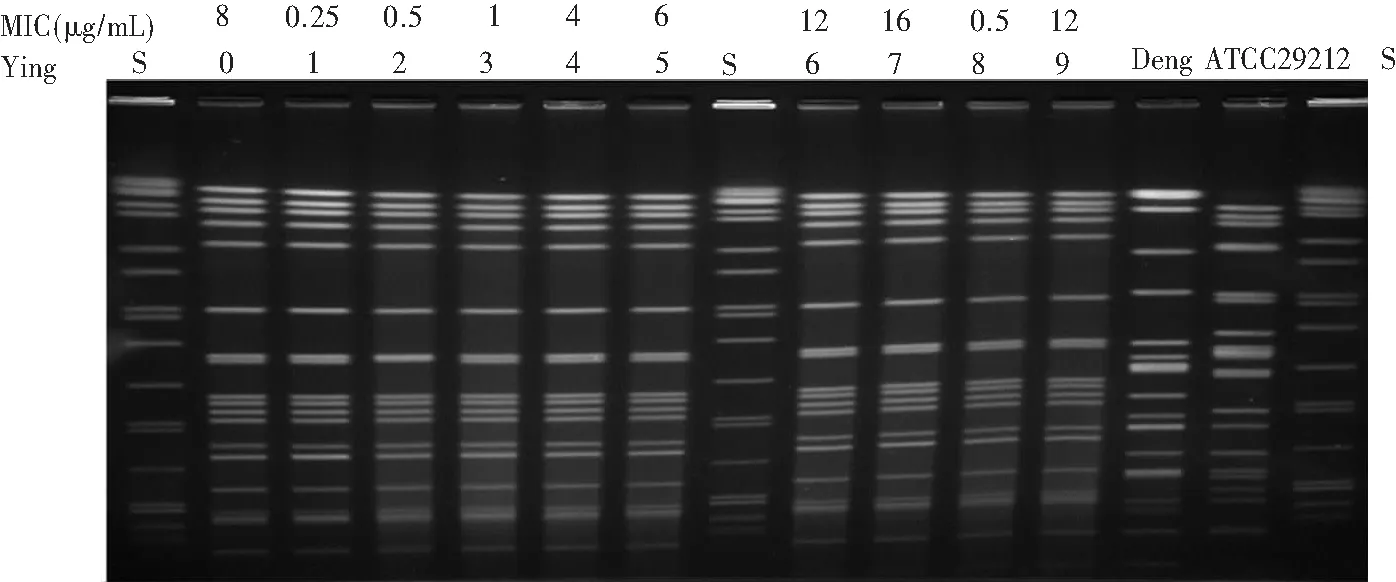
注:LZD检测MIC值结果,其中S为H9812标准株,ATCC 29212为粪肠球菌质控株,Deng 为我科分离保存利奈唑胺耐药粪肠球菌Deng 1,0-9 代表粪肠球菌株Ying 0-9
图1 患者尿和粪便标本分离的10株粪肠球菌PFGE图
Figure 1 PFGE mapping of 10 strains ofE.faecalisisolated from urine and stool specimens
3 讨论
利奈唑胺属于完全人工合成的口恶唑烷酮类抗生素,不存在利奈唑胺耐药的天然储备库,该药主要通过与细菌50S亚基23S rRNAV区结合,阻止mRNA与核糖体结合抑制细菌蛋白质的合成从而产生抗菌作用[7]。粪肠球菌有4个拷贝23S rRNA基因,屎肠球菌有6个23S rRNA拷贝基因数,曾经一度认为这种复杂的基因结构形式很难出现利奈唑胺耐药的肠球菌,但是,随着LZD在临床上应用的日益广泛,不断有LZD耐药肠球菌的报道出现,甚至是小范围内的医院感染暴发,多发生有LZD暴露史在抗菌药物选择压力下出现,尤其是患者既往有广谱抗菌药物使用史、免疫抑制、基础疾病、器官移植、侵入性置管等情况下更易造成LZD耐药菌株的出现,既往研究表明,细菌耐LZD作用机制主要由于下面几个方面:细菌23S rRNA V区基因的点突变;编码核糖体蛋白L3和L4蛋白氨基酸变异;多耐药基因Cfr基因的获得[3, 8]。
目前研究多集中于临床分离LZD耐药致病菌株的耐药机制研究,对于既往无LZD暴露史,长期定植于患者体内的耐药菌株的定植规律及耐药机制的相关报道较少。学者Marra AR等[9]曾报道1例呼吸机相关肺炎铜绿假单胞菌感染患者的中心静脉置管中分离出1株LZD耐药粪肠球菌,既往无LZD用药史,同时期无医院内多重耐药菌株的传播,考虑其为定植菌株,并未予以特殊治疗,但其耐药机制并未进一步阐明。该院也曾从1例反复发作肺炎(1年内反复发作5次)的急性白血病患者的气管分泌物中分离出LZD不敏感粪肠球菌10株,其1年前曾因革兰阳性菌感染接受LZD治疗,之后未有LZD暴露史,通过PFGE分型提示高度同源性,基因测序显示23S rRNA V区 存在G2424U、G2576U突变[10]。本例患者从未使用LZD治疗,但是从尿和粪便标本中同时分离出LZD不敏感菌株,在LZD治疗后,不敏感菌株的MIC值明显升高,PFGE分型检测提示高度同源。这些数据表明LZD不敏感菌株可长期定植于患者体内,在一定条件下发生移位导致感染发生并在药物选择性压力下出现高水平耐药可能。患者具有LZD耐药菌的定植可以使用LZD进行治疗,该患者在LZD治疗后泌尿道和肠道的LZD耐药菌负荷均显著下降,但耐药定植菌对临床结局的影响程度有待进一步研究。对于从无LZD接触史的患者体内检出定植的LZD不敏感菌株,其定植规律有待进一步阐述,以及是否存在现有耐药机制无法解释的新的耐药特点需要更多的研究资料证实。
目前肠球菌耐药现象日益严峻,一个重要的原因在于抗菌药物的不合理使用,LZD已成为治疗包括VRE在内的难治性革兰阳性菌感染和控制医院感染的理想药物,关注细菌对LZD的定植规律和耐药机制有助于延长抗菌药物的使用寿命。本研究初步揭示了既往无LZD暴露史的患者体内LZD不敏感菌株的同源性特点,提示临床工作中需要密切关注LZD不敏感菌株的定植情况和MIC值动态变化,防止不恰当的使用造成耐药菌株的选择移位及医院感染的暴发。
[1] Mendes RE, Flamm RK, Hogan PA, et al. Summary of linezolid activity and resistance mechanisms detected during the 2012 LEADER surveillance program for the United State[J]. Antimicrob Agents Chemother, 2014, 58(2): 1243-1247.
[2] O'Driscoll C, Murphy V, Doyle O, et al. First outbreak of linezolid-resistant vancomycin-resistantEnterococcusfaeciumin an Irish hospital, February to September 2014[J]. J Hosp Infect, 2015, 91(4): 367-370.
[3] Ntokou E, Stathopoulos C, Kristo I, et al. Intensive care unit dissemination of multiple clones of linezolid-resistantEnterococcusfaecalisandEnterococcusfaecium[J]. J Antimicrob Chemother, 2012, 67 (8): 1819-1823.
[4] Thilesen CM, Bjørang O, Skrede T, et al. Emergence of mutation-based linezolid-resistant invasiveEnterococcusfaecalisin a haemodialysis patient in Norway[J]. APMIS, 2014, 122(1): 83-84.
[5] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing[S]. CLSI, 2013, M100-S23.
[6] Bourgeois-Nicolaos N, Massias L, Couson B, et al. Dose dependence of emergence of resistance to linezolid inEnterococcusfaecalisin vivo[J]. J Infect Dis, 2007, 195(10): 1480-1488.
[7] Shinabarger DL, Marotti KR, Murray RW, et al. Mechanism of action of oxazolidinones: effects of linezolid and eperezolid on translation reactions[J]. Antimicrob Agents Chemother, 1997, 41(10): 2132-2136.
[8] Pogue JM, Paterson DL, Pasculle AW, et al. Determination of risk factors associated with isolation of linezolid-resistant strains of vancomycin-resistantEnterococcus[J]. Infect Control Hosp Epidemiol, 2007, 28(12): 1382-1388.
[9] Marra AR, Major Y, Edmond MB. Central venous catheter colonization by linezolid-resistant, vancomycin-susceptibleEnterococcusfaecalis[J]. J Clin Microbiol, 2006, 44(5): 1915-1916.
[10] Yu ZJ, Chen Z, Cheng H, et al. Recurrent linezolid-resistantEnterococcusfaecalisinfection in a patient with pneumonia[J]. Int J Infect Dis, 2015, 30: 49-51.
(本文编辑:陈玉华)
Homology analysis of clinically isolated and colonized linezolid-resistantEnterococcusfaecalisstrains from a patient
PUZhang-ya,YUZhi-jian,CHENZhong,DENGXiang-bin,BAIBing,LIDuo-yun,LIUXiao-jun,HANXue-ying,LINFo-jun,DENGQi-wen
(ShenzhenKeyLaboratoryforEndogenousInfection,TheAffiliatedShenzhenNanshanPeople’sHospitalofGuangdongMedicalUniversity,Shenzhen518052,China)
Objective To study the homology characteristics of clinicaly isolated and colonized linezolid(LZD)-resistantEnterococcusfaecalis(E.faecalis) strains from a patient.Methods TenE.faecalisstrains (2 were isolated from urine specimens and 8 were from stool specimens) isolated from a patient with pulmonary infection were performed antimicrobial susceptibility testing, homology ofE.faecaliswas determined by pulsed-field gel electrophoresis (PFGE).Results Before and after patients received LZD therapy, 2E.faecalisstrains isolated form urine specimens were both resistant to LZD (MICs: 8 mg/mL, 16 mg/mL, respectively), among 8 strains from stool specimens (6 were isolated before therapy, and 2 were isolated after therapy), LZD susceptible, intermediate, and resistant strains were 4, 2, and 2 respectively(MICs: 0.25-12 mg/mL). 10 strains ofE.faecaliswere homologous by PFGE typing. Conclusion In this case, the detection ofE.faecalisfrom urinary tract and intestinal tract is homologous, which suggested that LZD-resistantEnterococcusmay be colonized in vivo for a long time, and may be shift to cause bacterial infection.
linezolid;Enterococcusfaecalis; clinical resistance; colonization; homology
2016-05-24
深圳市科技创新委基础研究基金项目(JCYJ20150402152130173);深圳市南山区科技项目(2015019,2015022)
蒲彰雅(1989-),女(瑶族),湖南省怀化市人,硕士研究生,主要从事细菌耐药性研究。
邓启文 E-mail:qiwendeng@hotmail.com
10.3969/j.issn.1671-9638.2017.04.013
R378.1
A
1671-9638(2017)04-0343-04

