低硫酸化杂多糖水解单糖高效液相色谱指纹图谱研究
张 齐, 王 晶, 谭姣姣, 张全斌, 秦浩然
低硫酸化杂多糖水解单糖高效液相色谱指纹图谱研究
张 齐1, 2, 3, 王 晶1, 2, 谭姣姣1, 2, 3, 张全斌1, 2, 秦浩然4
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 青岛海洋科学与技术国家实验室, 海洋生物学与生物技术功能实验室, 山东 青岛 266071; 3. 中国科学院大学, 北京 100049; 4. 青岛市实验高级中学, 山东 青岛 266071)
低硫酸化杂多糖(UF)是从海洋褐藻中分离的一种单糖组成复杂的硫酸化杂多糖, 在细胞和动物实验中均表现出显著的神经保护活性, 对帕金森病具有显著作用。本研究采用水提-醇沉- DEAE-Sepharose Fast Flow交换层析柱制备UF, 经三氟乙酸(TFA)水解和1-苯基-3-甲基-5吡唑啉酮(1-phenyl-3-methyl-5-pyrazalone, PMP)衍生化, 通过对水解条件、衍生化试剂使用量、衍生时间的考察, 确定最佳衍生条件, 通过高效液相色谱(HPLC)法测定UF的单糖组成, 并建立UF的指纹图谱。在UF水解单糖的指纹图谱中, 共标示出8个特征共有峰, 经鉴别主要色谱峰8个, 分别是D-甘露糖、D-甘露糖醛酸、L-鼠李糖、D-葡萄糖醛酸、D-葡萄糖、D-半乳糖、D-木糖及L-岩藻糖, 其中岩藻糖含量最高, 其次是半乳糖。该方法操作简便、快速、灵敏度高、重复性好, 可作为UF检查和鉴别的方法, 建立实验室UF质量控制标准, 为临床用UF质量标准的建立奠定基础。
低硫酸化杂多糖; 岩藻多糖; 指纹图谱; 柱前衍生化; 高效液相色谱
海带是褐藻门海带目(Laminariales)海带科(Laminariaceae)海带属()的一种大型海藻, 很早就被作为中药入药。褐藻中的多糖组分被证明具有抗氧化、抗肿瘤、抗炎、抗凝血、免疫调节等生物活性[1-6]。本实验室通过对数十种海藻多糖神经保护作用筛选, 得到一种对帕金森病(Parkinson’s Disease, PD)具有显著作用的褐藻低硫酸化杂多糖(Sulfated Hetero-Polysaccharides, UF)。UF是一个单糖组成和化学成分复杂的低硫酸化杂多糖, 在PD细胞和动物实验中均表现出显著的神经保护活性, 是一个有潜力的治疗PD的海洋新药。UF能够有效对抗神经毒素MPP+致MN9D细胞损伤, 降低神经细胞的损伤率; UF 给药能够改善MPTP小鼠的行为学异常, 可以显著对抗MPTP引起的小鼠腹侧中脑和纹状体TH蛋白表达减少, 改变MPTP小鼠纹状体DA及DA代谢产物含量; UF给药能够上调抗凋亡蛋白Bcl-2的表达, 降低促凋亡蛋白Bax的表达, 对DA神经元的凋亡有显著的抑制作用; UF给药能够提高黑质抗氧化酶的含量, 降低脂质过氧化水平[7-8]。
由于多糖的单糖组成和结构的复杂性, 多糖的质量控制标准是限制其成药的重要因素。传统的多糖检测方法如经典的苯酚硫酸法、蒽酮硫酸法、凝胶过滤色谱法、光散射法等均存在一定的局限性,近年来随着指纹图谱技术的研究方法与研究思路相对成熟, 中药指纹图谱为进一步开发和利用中药资源提供了重要的科学依据, 为多糖的质量控制提供了多元的思路和方法[9-21]。因此, 本文对低硫酸化杂多糖UF的单糖组成指纹图谱进行研究, 旨在建立实验室UF的质量控制标准, 为UF的进一步质量控制方法的建立奠定基础。
1 仪器与材料
1.1 仪器
LC-20AT高效液相色谱仪, SPD20A检测器(日本岛津); 电子天平(赛多利斯科学仪器有限公司); 电热恒温水浴锅(HH-ZK4, 巩义市予华仪器有限责任公司); 台式高速冷冻离心机(CT14RDII, 上海天美科学仪器有限公司); MilliQ超纯水系统(美国Millipore公司)。
1.2 材料与试剂
原料海带: 海带科植物海带(Aresch)的干燥全藻, 采自山东荣成, 新鲜海带洗净晾干, 剪成小块, 贮藏备用, 符合《中国药典》2015年版一部昆布项下规定。
1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5- pyrazalone, PMP, 化学纯, 国药集团化学试剂有限公司); 三氟乙酸(trifluoroacetic acid, TFA, 成都市科龙化工试剂厂); 乙腈(acetonitrile, 色谱纯, 德国Merk公司); 三乙胺(triethylamine, 国药集团化学试剂有限公司); 乙酸铵(ammonium acetate, 南京化学试剂有限公司); 甲醇(methanol, 天津市嘉宇精细化工有限公司); 三氯甲烷(chloroform, 天津市广成化学试剂有限公司); 乙酸(acetic acid, 优级纯, 国药集团化学试剂北京有限公司)。
单糖对照品: D-葡萄糖(D-Glucose), D-甘露糖(D-Mannose), L-鼠李糖(L-Rhamnose), D-葡萄糖醛酸(D-Glucuronic acid), D-半乳糖(D-Galactose), D-木糖(D-Xylose), L-岩藻糖(L-Fucose), 2-脱氧-D-核糖(D- Deoxyribose)(Sigma公司, 纯度均99%以上); D-甘露糖醛酸钠(单糖)(D-Mannuronic acid sodium salt, 青岛博智汇力生物科技有限公司, 纯度98%以上); 水为MiliQ纯化水; 其他化学试剂除特殊标明外均为分析纯。
2 方法
2.1 样品制备
干燥海藻加水提取, 料液比为1︰30, 在温度100℃下搅拌提取2 h。提取液先用筛绢初筛, 滤去海带渣, 滤液继续用硅藻土过滤, 经减压浓缩, 浓缩液加氯化钙除褐藻胶, 离心后上清液经透析脱盐后浓缩, 加入乙醇至浓度为75%, 搅拌、静置过夜。收集到的沉淀再经真空干燥即得褐藻多糖硫酸酯。将褐藻多糖硫酸酯溶于水, 采用过氧化氢和抗坏血酸氧化降解, 反应液经透析(截留分子质量w=3.5 kDa)、减压浓缩, 乙醇沉淀。利用DEAE-Sepharose Fast Flow交换柱层析进行分级, 收集0.5 mol/L氯化钠洗脱组分, 经透析(截留分子质量w=3.5 kDa)、减压浓缩、乙醇沉淀, 沉淀经真空干燥得到低硫酸化杂多糖UF。
UF为棕黄色粉末, 经半胱氨酸盐酸盐法测定样品中岩藻糖含量约为11.99%, 经咔唑比色法测定样品中糖醛酸含量约为18.05%, 离子色谱法测定该样品中硫酸根的含量约为11.13%, 经GPC凝胶色谱法测定重均分子质量约为7 kDa。
2.2 色谱条件
色谱柱: YMC-Pack ODS-AQ;
流动相A: 0.4%三乙胺水溶液(含20 mmol/L 乙酸铵)︰乙腈=9︰1(pH=6.30);
流动相B: 0.4%三乙胺水溶液(含20 mmol/L 乙酸铵)︰乙腈=4︰6(pH=6.30);
梯度洗脱比例: 0.01-9.00-30.00-35.00-45 min, 流动相B: 10%-14%-64%-64%-10%;
流速: 1.0 mL/min; 柱温: 30℃; 检测波长: 254 nm; 进样体积: 20 µL。
在此条件下, 对照品混合液中所有单糖成分均可达到基线分离。
2.3 对照品溶液的制备
分别精确称取上述8种对照品20 mg, 加入蒸馏水准确定容至100 mL, 配成0.2 g/L 的混合溶液。精确取脱氧核糖20 mg, 加入蒸馏水准确定容至100 mL,配成0.2 g/L的溶液。取200 µL对照品溶液于离心管中, 加入200 µL脱氧核糖溶液, 混合均匀后, 取出100 µL置于离心管中, 依次加入100 µL 0.5 mol/L的PMP甲醇溶液和100 µL 0.3 mol/L的NaOH溶液, 混匀, 70℃水浴中反应45 min, 取出, 冷却至室温, 用100 µL 0.3 mol/L HCl中和, 加入500 µL三氯甲烷萃取, 7 000 r/min离心5 min, 弃去三氯甲烷层, 至少重复3次, 至三氯甲烷层无色, 取水层即得对照品溶液。
2.4 供试品溶液的制备
精确称取UF样品100 mg, 加入蒸馏水准确定容至10 mL, 配成10 g/L的溶液。取1 mL溶液于安瓿瓶中, 加入1 mL 4 mol/L TFA溶液, 110℃水解4 h, 放置至室温, 加入2 mol/L NaOH调节pH至中性, 即得到样品水解液。取水解液按照“2.2”项下方法制备, 即得供试品溶液。
精密吸取与样品等量的水, “2.2”项下方法进行处理, 即得溶剂空白对照。
2.5 水解条件筛选
按“2.3”项下方法实验, 水解所用TFA浓度分别考察1、2、4及6 mol/L, 精密吸取所得供试品溶液各20 µL, 按“2.1”项下色谱条件进样分析, 以所得HPLC图谱主要共有特征峰的峰面积之和作为衡量指标。
2.6 PMP衍生条件筛选
2.6.1 PMP衍生时间筛选
按“2.3”项下方法实验, 衍生时间分别考察15、30、45、60及75 min, 精密吸取所得供试品溶液各20 µL, 按“2.1”项下色谱条件进样分析, 以所得HPLC图谱主要共有特征峰的峰面积之和作为衡量指标。
2.6.2 PMP衍生化试剂使用量的筛选
按“2.3”项下方法实验, 衍生化试剂使用量分别考察80、100、120、140及160 µL, 精密吸取所得供试品溶液各20 µL, 按“2.1”项下色谱条件进样分析, 以所得HPLC图谱主要共有特征峰的峰面积之和作为衡量指标。
2.7 方法学考察
2.7.1 精密度实验
取衍生化后的同一批供试品溶液(批号S1), 在“2.1”项下色谱条件连续进样6次, 考察各主要共有特征峰的保留时间和峰面积的RSD值。
2.7.2 重复性实验
取衍生化后的同一批供试品溶液6份(批号S1—S6), 在“2.1”项下色谱条件分别进样检测, 考察各主要共有特征峰的保留时间和峰面积的RSD值。
2.7.3 稳定性实验
取衍生化后的同一批供试品溶液(批号S1), 分别于0、2、4、6、10、24 h在“2.1”项下色谱条件进样, 考察各主要共有特征峰的保留时间和峰面积的RSD值。
2.8 样品测定
按照“1.3.1”项下方法制备10批次UF样品(批号S1—S10), 按照“2.3”项下方法制备10批次样品的供试品溶液, 按照“2.1”所述色谱条件进行检测。
3 结果与分析
3.1 水解条件筛选
由图1可知, 在TFA浓度低于4 mol/L时, 随着水解所用TFA浓度的增大, 主要共有特征峰的峰面积之和逐渐升高, 当TFA浓度达到4 mol/L时, 峰面积达到最大值, 随后峰面积开始下降。因此确定水解所用TFA浓度为4 mol/L。
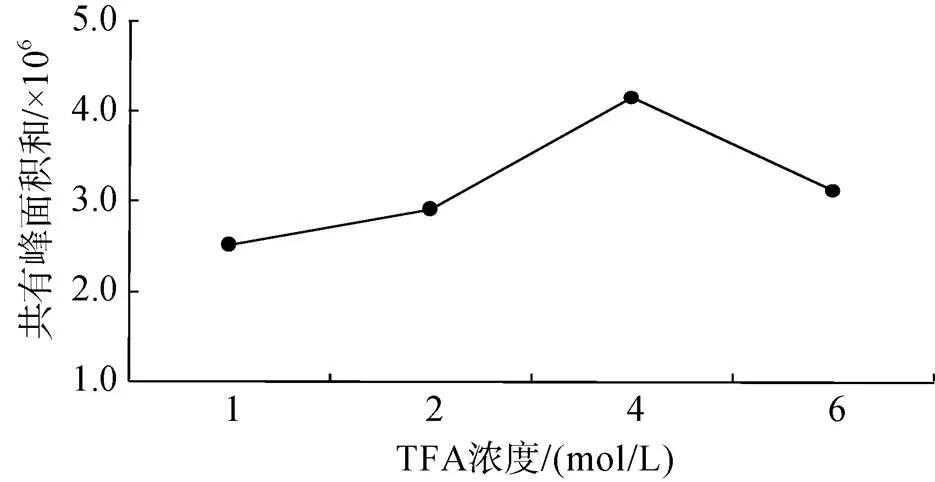
图1 不同水解TFA浓度对UF指纹图谱共有峰面积之和的影响
3.2 PMP衍生条件筛选
3.2.1 PMP衍生时间筛选
从图2可知, 随着衍生时间从15 min延长至45 min, 主要共有特征峰的峰面积之和逐渐升高, 当衍生时间达到45 min时, 峰面积达到最大值, 随后峰面积开始下降。因此确定衍生时间为45 min。
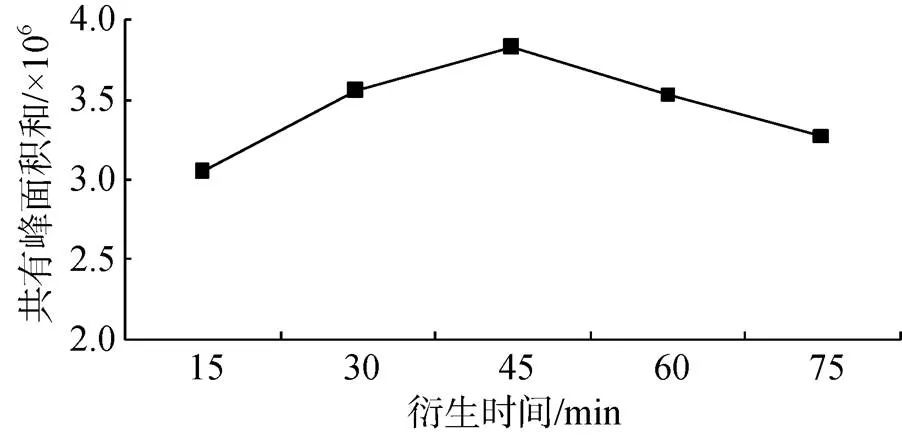
图2 不同衍生反应时间对UF指纹图谱共有峰面积之和的影响
3.2.2 PMP衍生化试剂使用量的筛选
由图3可知, 随着衍生化试剂使用量的增加, 主要共有特征峰的峰面积之和呈现先升高后降低的规律, 当衍生化试剂的使用量达到100 µL时, 峰面积达到最大值, 在该点以后峰面积开始下降。因此确定衍生化试剂的使用量为100 µL。
3.3 方法学考察
3.3.1 精密度实验
结果表明各主要色谱峰的相对保留时间RSD< 1%, 相对峰面积RSD<5%, 表明仪器的精密度良好, 符合指纹图谱的测定要求。
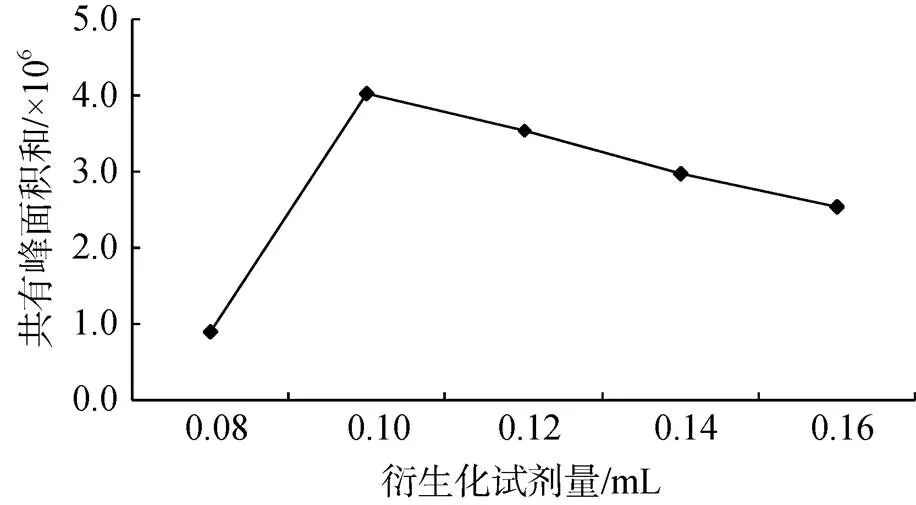
图3 不同衍生化试剂使用量对UF指纹图谱共有峰面积之和的影响
3.3.2 重复性实验
结果表明各主要色谱峰的相对保留时间RSD< 1%, 相对峰面积RSD<5%, 表明该方法的重复性良好, 符合指纹图谱的测定要求。
3.3.3 稳定性实验
结果表明各主要色谱峰的相对保留时间RSD< 1%, 相对峰面积RSD<5%, 表明供试品溶液在24 h内稳定性良好, 符合指纹图谱的测定要求。
3.4 指纹图谱的建立与分析
3.4.1 混合单糖对照品分析
精密吸取“2.2”项下混合对照品溶液, 按照“2.1”项下色谱条件进行检测, 得到色谱图(图4), 混合单糖对照品9个成分均能达到较好的分离效果。
3.4.2 共有峰的确定及参照峰的选择
按照“2.3”项下方法制备10批样品的供试品溶液, 按照“2.1”项下色谱条件进行检测, 谱图结果显示, 不同批次样品均具有基本一致的特征峰, 共标示出10个共有峰。利用对照品保留时间定位以及色谱峰紫外光谱分析, 鉴别出10个色谱峰, 通过保留时间确定供试品溶液中1号峰为甘露糖, 2号峰为甘露糖醛酸, 3号峰为鼠李糖, 4号峰为葡萄糖醛酸, 5号峰为葡萄糖, 6号峰为半乳糖, 7号峰为木糖, 8号峰为岩藻糖, 9号峰为脱氧核糖(内标)(图5)。以峰8岩藻糖为参照峰分别计算各主要色谱峰的相对保留时间和相对峰面积, 结果见表1、表2。
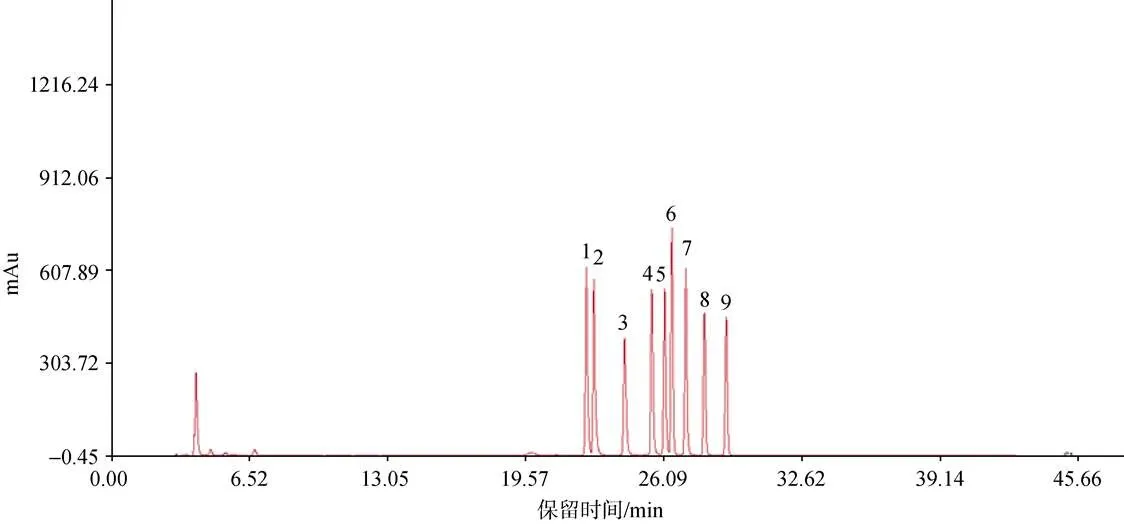
图4 9种单糖对照品的高效液相色谱图
3.4.3 相似度分析
采用计算机辅助相似度评价系统(国家药典委员会中药色谱指纹图谱评价系统软件2004 A版)比较10批UF供试品HPLC指纹图谱全谱相似度结果见表3。
4 讨论
现有的单糖分析方法一般为先对样品进行水解处理, 然后进行PMP衍生化。水解使用的TFA浓度与样品水解程度直接相关, 当TFA浓度较低时, 样品水解不够完全; 当TFA浓度高于4 mol/L时, 共有峰面积之和反而下降, 可能是因为TFA具有强氧化性, 过高浓度会导致样品发生氧化, 导致样品被破坏, 单糖含量降低。TFA浓度过高或者过低都无法准确地对样品中的单糖含量进行定量分析。因此, 本实验初步确定降解低硫酸化杂多糖使用TFA的浓度为4 mol/L。
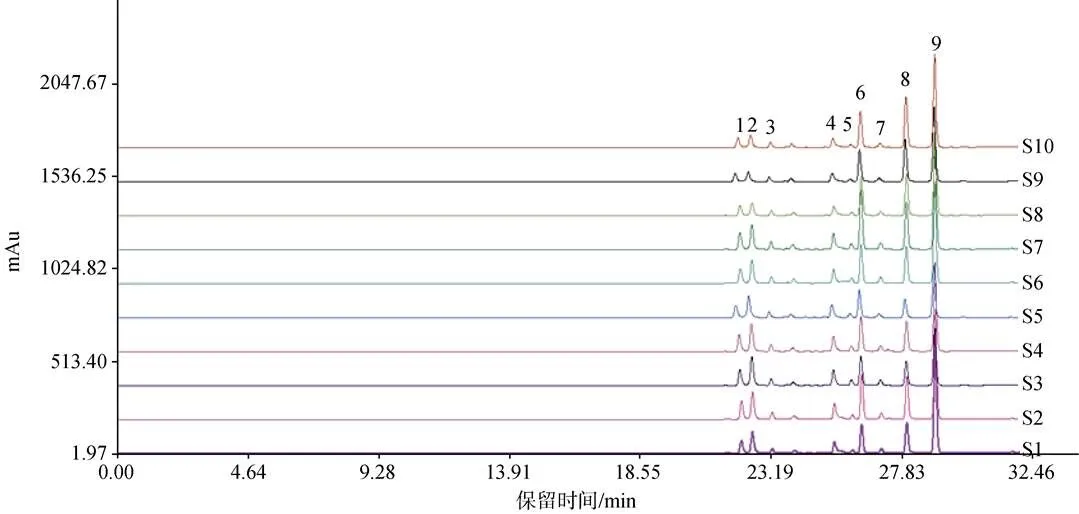
图5 10批硫酸杂聚糖水解物的高效液相色谱图
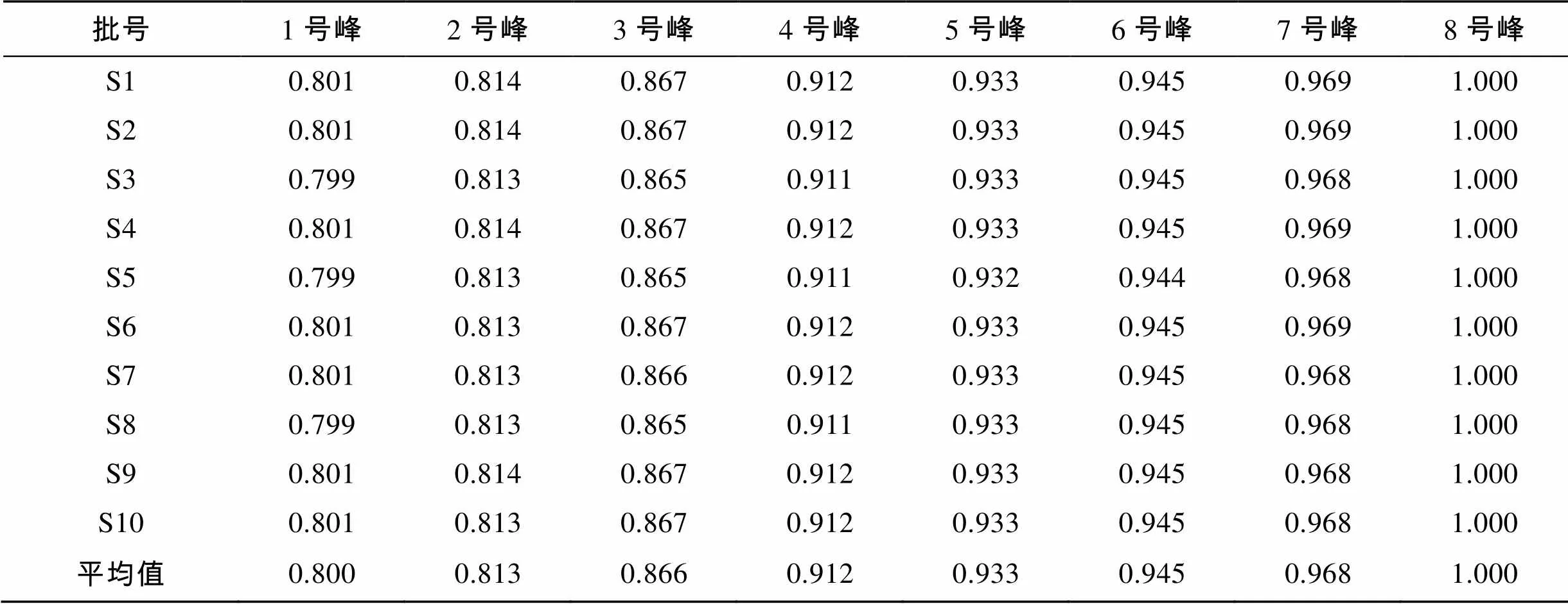
表1 10批硫酸杂聚糖水解物指纹图谱共有峰的相对保留时间
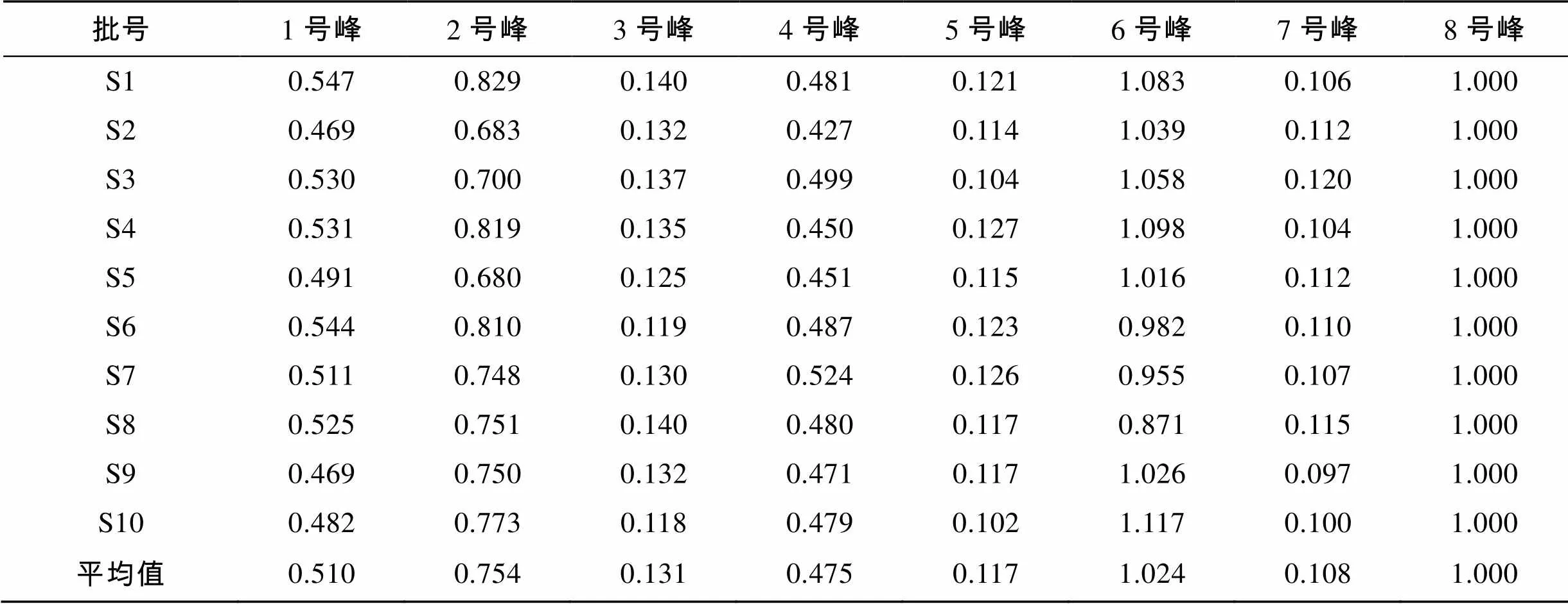
表2 10批硫酸杂聚糖水解物指纹图谱共有峰的相对峰面积
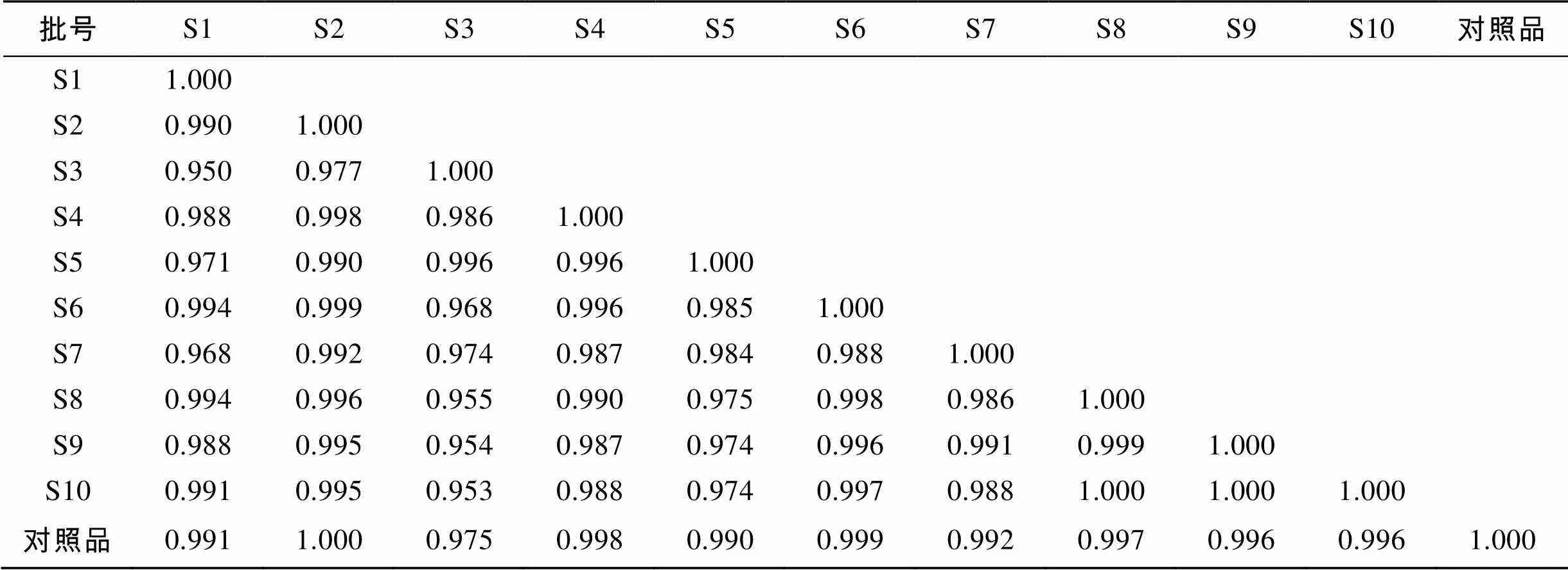
表3 10批UF样品HPLC指纹图谱相似度分析结果
在衍生化的过程中, 衍生化试剂PMP使用量、衍生反应时间都会对衍生反应的程度产生影响。当衍生反应时间达到45 min时, 共有峰面积达到最大值, 即可反应完全。当衍生化试剂的使用量高于100 µL时, 随着PMP使用量的继续增加, 峰面积反而下降。说明反应时间的延长及PMP用量的增大并不能有利于衍生反应的充分进行, 可能是由于导致了一些不明副产物的生成, 导致共有峰面积下降。因此初步确定衍生反应时间为45 min, 衍生化试剂PMP的使用量为100 µL。
利用该水解、衍生条件进行酸水解-PMP柱前衍生HPLC法对低硫酸化杂多糖UF的单糖组成进行分析, 共鉴别出UF含有的8个特征峰。从单糖组成上可以看出, UF样品中岩藻糖和半乳糖的比例最大, 其次是甘露糖醛酸、甘露糖、葡萄糖醛酸、鼠李糖、葡萄糖、木糖, 其色谱峰的峰面积相对较低。10批UF供试品均相似度>0.95, 表明PMP柱前衍生HPLC指纹图谱在对UF样品分析中具有较好的重现性和稳定性, 可作为UF质量控制和评价指标的重要参考依据之一。本文研究结果为建立实验室UF质量控制标准提供新思路, 同时也为海洋多糖类的开发和质量控制提供一定的理论参考。
[1] 吴丽娟, 赵峡, 王伟. 几种海洋类肝素多糖的制备及抗乙肝病毒活性初步研究[J]. 中国海洋药物, 2016, 6: 31-37.
Wu Lijuan, Zhao Xia, Wang Wei. Preparation and antiviral activities of several marine heparin-like polysaccharides against hepatitis B virus[J]. Chinese Journal of Marine Drugs, 2016, 6: 31-37.
[2] 谢燕丹, 张鑫, 翁佩芳, 等. 海洋寡糖对内皮细胞氧化应激调控研究进展[J]. 食品工业, 2016, 11: 206- 210.
Xie Yandan, Zhang Xin, Weng Peifang, et al. Marine Sources Oligosaccharides on the Regulation of Oxidative Stress in Endothelial Cells Induced [J]. Food Industry, 2016, 11: 206-210.
[3] 崔艳秋, 罗鼎真, 王晓民. 褐藻多糖硫酸酯的抗炎与抗氧化活性研究进展[J]. 药学学报, 2008, 12: 1186- 1189.
Cui Yanqiu, Luo Dingzhen, Wang Xiaomin. Fucoidan: advances in the study of its anti-inflammatory and anti-oxidative effects [J]. Acta Pharmaceutica Sinica, 2008, (12): 1186-1189.
[4] 李涛, 吉爱国. 褐藻多糖硫酸酯的药理活性及作用机制研究进展[J]. 中国生化药物杂志, 2008, (3): 216- 219.
Li Tao, Ji Aiguo. Research progress on pharmacological activities and mechanism of sulfated fucan [J].Chinese Journal of Biochemical Pharmaceutics, 2008, (3): 216- 219.
[5] 李波, 许时婴. 羊栖菜褐藻糖胶抗凝血活性的研究[J].天然产物研究与开发, 2004, (5): 431-434.
Li Bo, Xu Shiying. Anticoagulant activity of fucoidan from the brown seaweed sagarssum fusiform[J]. Natural Product Research and Development, 2004, 5: 431-434.
[6] 苗本春, 李静, 耿美玉, 等. 海洋硫酸多糖聚古罗糖酯(912)抗肿瘤作用机理探讨[J]. 中国海洋药物, 2003, 3: 11-15.
Mao Benchun, Li Jing, Geng Meiyu, et al. A study on antitumor mechanisms of marine sulfated polysaccharide poly-guluronic acid (912)[J]. Chinese Journal of Marine Drugs, 2003, 3: 11-15.
[7] Jing Wang, Huaide Liu, Xuan Zhang, et al. Sulfated Hetero-Polysaccharides Protect SH-SY5Y Cells from H2O2-Induced Apoptosis by Affecting the PI3K/Akt Signaling Pathway[J]. Marine Drugs, 2017, 15: 1-16.
[8] Jing Wang, Huaide Liu, Weihua Jina, et al. Structure– activity relationship of sulfated hetero/galactofucanpolysaccharides on dopaminergic neuron[J]. International Journal of Biological Macromolecules, 2016, 82: 878-883.
[9] 张婷, 郑夺, 王文彤, 等. 指纹图谱结合一测多评模式在参芎养心颗粒质量评价中的应用研究[J]. 中草药, 2015, 13: 1920-1925.
Zhang Ting, Zheng Duo, Wang Wentong, et al. Application of fingerprint combined with QAMS in quality evaluation of Shenxiong Yangxin Granule[J]. Chinese Traditional and Herbal Drugs, 2015, 13: 1920-1925.
[10] 陈东东, 周萍, 白钢钢, 等. 基于HPLC中药指纹图谱技术延胡索药材及其制剂的质量控制探讨[J]. 中国中药杂志, 2015, 12: 2470-2473.
Chen Dongdong, Zhou Ping, Bai Ganggang, et al. Discussion of HPLC fingerprint of traditional Chinese medicine of Corydalis yanhusuo and its preparation[J]. Chinese Materia Medica, 2015, 12: 2470-2473.
[11] 吴玲芳, 林琛, 袁永兵, 等. 叶下珠指纹图谱及模式识别研究[J]. 中草药, 2015, 4: 572-575.
Wu Lingfang, Lin Chen, Yuan Yongbing, et al. Fingerprint analysis and chemical pattern recognition for whole plant of Phyllanthus urinaria[J]. Chinese Traditional and Herbal Drugs, 2015, 4: 572-575.
[12] 李守信, 展金祥, 刘武占, 等. 基于指纹图谱的金银花物质组纯化工艺研究[J]. 中草药, 2015, 1: 55-60.
Li Shouxin, Zhan Jinxiang, Liu Zhanwu, et al. Purification technology of Lonicerae Japonicae Flos materiomic based on its fingerprint [J]. Chinese Traditional and Herbal Drugs, 2015, 1: 55-60.
[13] Ma T, Huang C, Meng X, et al. Fingerprint analysis of Hawk-tea by high-performance liquid chromatography[J]. Food Chemistry, 2011, 129: 551-556.
[14] Sun X, Wang H, Han X, et al. Fingerprint analysis of polysaccharides from different Ganoderma by HPLC combined with chemometrics methods[J]. Carbohydrate Polymers, 2014, 114: 432-439.
[15] Di X, Chan K, Leung H W, et al. Fingerprint profiling of acid hydrolyzates of polysaccharides extracted from the fruiting bodies and spores of Lingzhi by high-performance thin-layer chromatography[J]. Journal of Chromatography A, 2003, 1018: 85-95.
[16] Wang Y, Xian J, Xi X, et al. Multi-fingerprint and quality control analysis of tea polysaccharides[J]. Carbohydrate Polymers, 2013, 92: 583-590.
[17] Alaerts G, Van Erps J, PietersA S, et al. Similarity analyses of chromatographic fingerprints as tools for identification and quality control of green tea[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2012, 910: 61-70.
[18] 严慕贤, 廖娴, 柯汉女, 等. 参芪降糖片多糖成分的HPLC指纹图谱研究[J]. 广东药学院学报, 2014, (5): 574-577.
Yan Muxian, Liao Xian, Ke Hannv, et al. HPLC fingerprint of the polysaccharides in Shenqi Jiangtang tablet[J]. Journal of Guangdong Pharmaceutical University, 2014, (5): 574-577.
[19] Goodarzi M, Russell P J, Vander Heyden Y. Similarity analyses of chromatographic herbal fingerprints: A review[J]. Analytica Chimica Acta, 2013, 804: 16-28.
[20] Yang D Z, An T Q, Jiang X L, et al. Development of a novel method combining HPLC fingerprint and multi- ingredients quantitative analysis for quality evaluation of traditional chinese medicine preparation[J]. Talanta, 2011, 85: 885-90.
[21] Barton C J, Tailford L E, Welchman H, et al. Enzymatic fingerprinting of Arabidopsis pectic polysaccharides using polysaccharide analysis by carbohydrate gel electrophoresis (PACE)[J]. Planta, 2006, 224: 163-174.
HPLC fingerprints of monosaccharides from sulfated heteropolysaccharides by precolumn derivatization
ZHANG Qi1, 2, 3, WANG Jing1, 2, TAN Jiao-jiao1, 2, 3, ZHANG Quan-bin1, 2, QIN Hao-ran4
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4. Qingdao Experimental High School, Qingdao 266071, China)
Sulfated heteropolysaccharide (UF) is a novel marine polysaccharide extracted from, with a complex chemical composition and structure. UF showed a significant neuroprotective activity both in cell and animal studies. UF was extracted with hot distilled water and further fractionated by DEAE-Sepharose Fast Flow column chromatography. The optimal hydrolysis and PMP derivatization conditions were investigated. UF was hydrolyzed into monosaccharides by trifluoroacetic acid and derivated with 1-phenyl-3-methyl-5-pyrazolone and analyzed by HPLC to study the monosaccharide components and fingerprint of UF. Nine peaks were detected in the fingerprint, of which 8 were identified as D-mannose, D-Mannuronic acid, L-rhamnose, D-glucuronic acid, D-glucose, D-galactose, D-xylose, and L-fucose. Fucose content was the highest, followed by galactose content. The result shows that the method is convenient, sensitive, and rapid such that it can be applied for the quality control of UF.
Sulfated heteropolysaccharides; fucoidan; fingerprint; precolumn; HPLC
(本文编辑: 康亦兼)
[Fujian Science and Technology project of Shandong Province, No.2016GSF115031; Strategic biological resources network service project of Chinese Academy of Sciences, NO.ZSTH-0025; National Natural Science Foundation of China, No.41406144; Youth Innovation Promotion Association of the Chinese Academy of Sciences, NO.2016190]
Jun. 27, 2017
张齐(1993-), 女, 山东济宁人, 硕士研究生, 主要从事海藻化学与海洋药物研究, 电话: 0532-82898708, E-mail: zhangqi515@ mails.ucas.ac.cn; 张全斌,通信作者, 研究员, 博士生导师, 电话: 0532- 82898708, E-mail: qbzhang@qdio.ac.cn
R284
A
1000-3096(2017)12-0096-08
10.11759/hykx20170627001
2017-06-27;
2017-09-22
山东省重点研发计划项目(2016GSF115031); 中国科学院战略生物资源网络服务计划项目(ZSTH-0025); 国家自然科学基金(41406144); 中国科学院青年创新促进会(2016190)

