超声造影评价微波消融子宫腺肌病的疗效及应用价值
赵莹莹,李永杰,李东,李杰,洪成
1.山东大学齐鲁医院 超声科,山东 济南250012;2.山东省聊城市肿瘤防治院超声科,山东 聊城 252000
超声造影评价微波消融子宫腺肌病的疗效及应用价值
赵莹莹1,2,李永杰2,李东2,李杰1,洪成2
1.山东大学齐鲁医院 超声科,山东 济南250012;2.山东省聊城市肿瘤防治院超声科,山东 聊城 252000
目的探讨超声造影(Contrast Enhanced Ultrasound,CEUS)评价经皮穿刺微波消融(Percutaneous Microwave Ablation,PMWA)子宫腺肌病的疗效及应用价值。方法31例PMWA术前经增强MRI证实为子宫腺肌病患者,分别于PMWA术前及术后1~2 d行CEUS检查,术后复查增强MRI,分析CEUS评价消融范围的准确性。术中及术后密切观察有无并发症及近期临床治疗效果。结果31例子宫腺肌病行PMWA治疗后,CEUS显示子宫腺肌瘤消融后无造影剂灌注,消融体积为(49.4±29.8)cm3,CEUS及增强MRI测得消融区体积测值差异无统计学意义(P>0.05),PMWA治疗后痛经和贫血等症状明显缓解。结论CEUS可准确评价微波消融子宫腺肌病疗效,值得临床应用。
超声造影;声诺维;子宫腺肌病;经皮穿刺微波消融;MRI
引言
超声引导下经皮穿刺微波消融(Percutaneous Microwave Ablation,PMWA)治疗是一种微创治疗方法,已经临床应用于多部位实体肿瘤治疗,PMWA治疗子宫腺肌病经临床证明安全、已操作、省时、可使病灶有效缩小[1],其治疗成功与否的关键在于瘤体病灶病变组织被原位热凝固灭活而达到有效消融。因此判断病灶是否有效消融至关重要,超声造影(Contrast-Enhanced Ultrasonography,CEUS)作为评价组织血流灌注的影像学检查,已经作为评价肿瘤微波消融和射频消融效果的手段,表现为消融后病灶发生凝固性坏死形成的无增强区[2-3]。本研究应用超声引导下经皮微波消融技术对31例子宫腺肌病患者进行治疗,分析PMWA治疗前后病灶CEUS图像特征,对比分析PMWA治疗后CEUS和增强MRI图像所示有效消融区体积,评价PMWA治疗子宫腺肌病的临床效果及并发症,达到探讨CEUS在微波消融子宫腺肌病术后评价消融范围的准确性及安全性的目的。
1 资料与方法
1.1 一般资料
选取2013年9月~2015年11月在山东省聊城市肿瘤防治院超声诊疗中心就诊,经超声检查和增强MRI确诊为子宫腺肌病且自愿行PMWA治疗的31例患者,年龄34~51岁,平均年龄(43.7±5.2)岁,其中痛经患者31例,月经过多患者25例。纳入标准:① 育龄期妇女,无生育要求;② 有明显月经失调(主要表现为月经量过多、经期延长)、痛经及贫血等症状,无围绝经期症状;③ 术前影像学检查示子宫肌层厚度>3 cm;④ PMWA之前未接受过高强度聚焦超声(High Intensity Focused Ultrasound,HIFU)和子宫动脉栓塞等介入治疗;⑤ 无盆腔炎症;⑥ 术前均经患者书面知情同意。排除标准:① 有心脑肝等重要脏器疾病;② 有恶性肿瘤及血液疾病;③ 宫颈脱落细胞超薄涂片TCT提示宫颈早期恶性病变者;④ 有MRI检查的禁忌症。超声引导下经PMWA治疗子宫腺肌病已经本院伦理委员会同意。
1.2 仪器与方法
采用南京亿高双源微波消融治疗仪,频率2450 MHz,功率40~120 W。水冷式循环低杆温15 G微波天线,前端微波辐射部长1.1 cm。超声仪为GE Logiq E9彩色多普勒超声诊断仪,探头频率3.5~5.5 MHz,配有穿刺引导架和低机械指数造影。核磁共振采用GE 1.5T MR检查设备。
治疗操作过程:患者取平卧位,术前常规超声及CEUS检查全面扫查观察子宫腺肌病位置、边界、形态、内部回声等,测量病灶大小,彩色多普勒血流显像(Color Doppler Flow Imaging,CDFI)观察子宫腺肌病血流信号;根据超声探测结果设计腹壁最佳穿刺点和进针路线。常规消毒下腹部术区,1%利多卡因局麻穿刺点皮肤,常规消毒铺巾,1%利多卡因局麻,静脉镇痛,根据病灶大小选择消融针数量(>5 cm选择双针),超声引导下将微波消融针经皮刺入病灶,打开微波消融仪,病灶内出现气化的高回声范围并逐渐扩大。输出功率设定为60 W,根据病灶大小设定消融时间,靠近浆膜层的,当高回声达到浆膜下缘0.3 cm时停止消融[3],为确保病灶周围组织器官不受热损伤,术中密切监测热场高回声范围。术中静脉镇痛(输液管中加用舒芬太尼滴注),全程心电监护仪监测患者呼吸、血压、心电图及血氧饱和度。
1.3 研究方法
术前常规超声、CEUS及MR全面观察病灶位置、内部及周围血流情况及大小。微波消融治疗前及治疗后1~2 d分别行CEUS,生理盐水5.0 mL快速注入SonoVue造影剂瓶内,振摇,经静脉团注2.4 mL混悬液,接着快速推注生理盐水5.0 mL,测量微波消融术后无灌注区的上下径(长)、前后径(宽)及左右径(高);微波消融治疗前和治疗后1~2 d行常规MRI检查及增强扫描,常规进行T1及T2加权像横断面、矢状面及冠状面扫描,然后通过肘静脉匀速注射马根维显造影剂(剂量0.l mmol/kg),做矢状面及横轴面T1加权像增强扫描,于PMWA术后测子宫腺肌病病灶无增强区矢状面的最大长径(长)、前后径(宽)、横断面上最大横径(高)[4],根据公式体积V=4/3πR3(R=平均半径)计算CEUS和增强MRI所示无灌注区体积。
临床效果及消融后观察:比较治疗前1~2 d及治疗后3、6个月评价痛经程度。痛经评分采用问卷调查患者自我评价10分法[5]:1~2分:无明显痛经症状;3~4分:轻度痛经,可以耐受疼痛,不影响生活和睡眠;5~6分:中度痛经,不能忍受疼痛,影响睡眠;7~8分:重度痛经,必须使用止痛药,严重干扰睡眠;9~10分:痛经剧烈不能忍受,伴有呕吐,影响正常生活与工作。统计治疗后3个月及6个月血红蛋白浓度。以下为微波消融疗效评定标准[6-9]:① 完全缓解,微波消融后复查时疼痛评分0分,痛经完全消失;② 治疗效果非常显著,复查时疼痛评分下降4分及以上,虽然疼痛未完全减轻,但是明显缓解;患者非月经期血红蛋白浓度达正常水平或较微波消融前升高3 g/L以上;③ 治疗效果显著,复查时疼痛评分下降4分以下,痛经部分缓解;患者非月经期血红蛋白浓度较微波消融前升高2 g/L以上;④ 治疗有效,患者非月经期血红蛋白浓度较微波消融前升高1 g/L;⑤ 治疗无效,微波消融后复查时与消融前痛经评分无明显变化;⑥ 加重,微波消融后复查时痛经分值较治疗前升高。
观察患者PMWA术中及术后有无疼痛、皮肤灼伤、出血及盆腔积液、阴道排液、盆腔感染、子宫破裂、子宫内膜大面积热损伤等并发症。
1.4 统计学处理
采用SPSS 19.0进行统计学分析,PMWA治疗术后CEUS图像所示子宫腺肌病无灌注区的长、宽、高及增强MRI图像测量子宫腺肌病无增强区的长、宽、高数据以CEUS和增强MRI测量的有效消融灶体积比较采用原始数据的配对t检验。
2 结果
2.1 PMWA治疗子宫腺肌病前后CEUS表现及对消融效果的评价
微波消融治疗前,CEUS初期表现:25例子宫腺肌病病灶表现为病灶与子宫实质整体同步增强状态,6例子宫腺肌病病灶表现为造影剂从病灶周围向中央渐进缓缓填充;CEUS峰值表现:31例子宫腺肌病病灶表现为与宫壁分界不清,呈不均匀高增强;CEUS晚期表现:31例子宫腺肌病病灶表现为不均匀的低增强。微波消融治疗后,CEUS示子宫腺肌病有效消融区无造影剂填充,呈边缘毛糙的无增强,病灶后方边界显示不清晰。微波消融治疗子宫腺肌病前后CEUS表现,见图1。其中4例子宫腺肌病病灶消融治疗后即刻行CEUS,显示仍有部分病灶强化,测量子宫腺肌病病灶仍强化部分>0.5 cm以上,对其中2例子宫腺肌病病灶即刻补充治疗,另外2例因子宫后位,周围肠管遮挡进针路径,故未行补充治疗。微波消融治疗前增强MRI表现为子宫腺肌病病灶明显增强,微波消融治疗后病灶有效消融区未见增强。测量微波消融后CEUS与增强MRI所示有效消融区体积分别为:(49.4±29.8)cm3、(49.2±30.4)cm3,微波消融后CEUS和增强MRI所示有效消融区体积比较,差异无统计学意义(P>0.05),见表1。
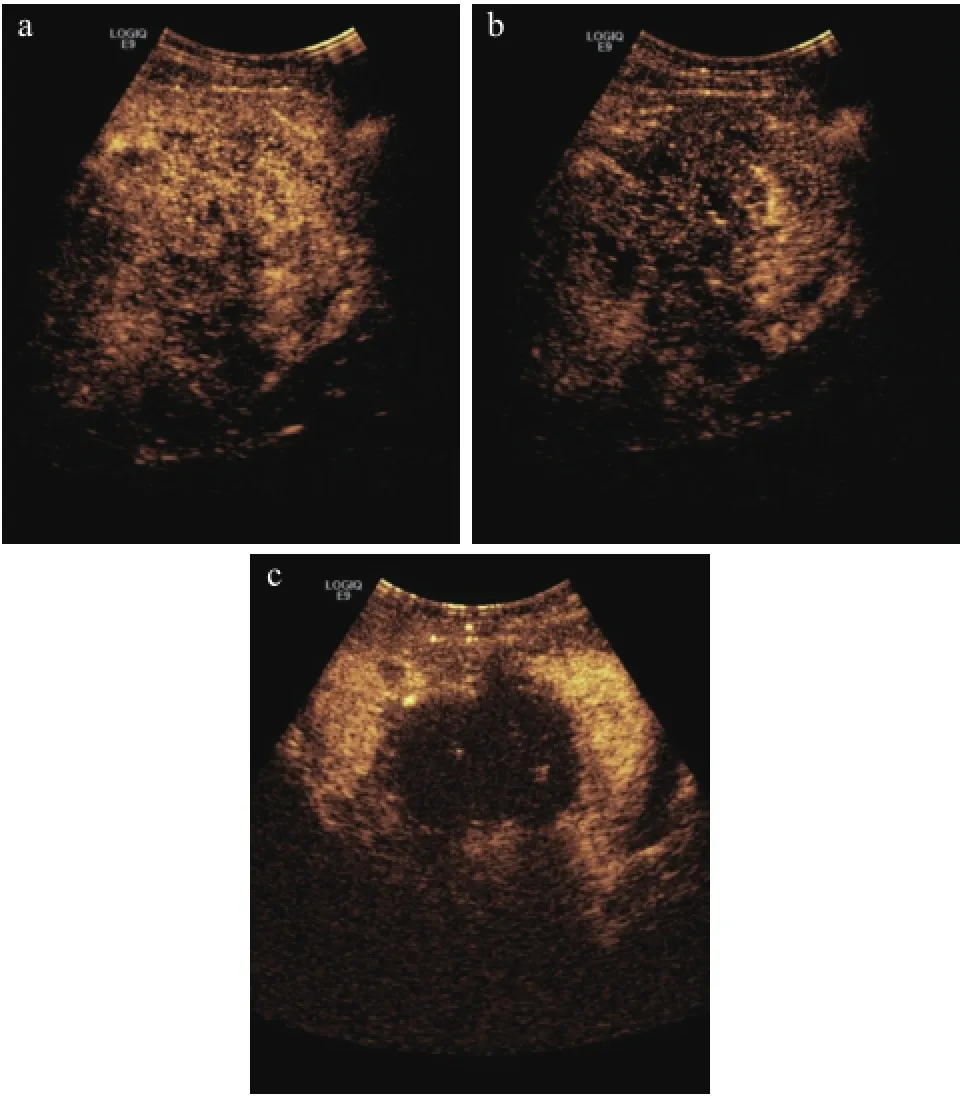
图1 子宫腺肌病PMWA术前及术后CEUS表现
表1 31例子宫腺肌病PMWA治疗术后CEUS与增强MRI图像所示病灶有效消融区范围比较

表1 31例子宫腺肌病PMWA治疗术后CEUS与增强MRI图像所示病灶有效消融区范围比较
?
2.2 PMWA治疗子宫腺肌病临床效果评价
31例患者PMWA微波消融治疗前痛经评分为(7.4± 1.3)分,微波消融治疗后3个月痛经评分下降到(3.7±1.2)分;微波消融治疗前患者非月经期血红蛋白浓度为(90.9±18.9)g/L,微波消融治疗后3个月患者非月经期血红蛋白浓度为(106.0±10.9)g/L,微波消融治疗后6个月患者非月经期血红蛋白浓度为(121.2±7.2)g/L。
2.3 并发症
31例患者PMWA术中生命体征平稳,未出现恶心、呕吐等麻醉副作用,术中严格无菌操作未发生盆腔感染,未见出血及盆腔积液,无阴道黏膜烫伤,无子宫破裂及子宫内膜大面积热损伤等严重并发症发生。其中22例患者在PMWA治疗后发生穿刺点及消融区疼痛,14例患者服用常规止疼药一次,另外8例患者可以耐受治疗后的疼痛,故未做特殊处理,8 h后22例患者疼痛症状均缓解;10例患者发生不同程度的阴道排液,其中1例为血性分泌物,2~11 d后,10例患者阴道流液现象自行消失。31例患者均未发生和造影剂相关的不良反应。
3 讨论
子宫腺肌病是育龄期女性生殖系统常见病之一,是由于子宫内膜腺体和间质异位到子宫肌层并在其中弥漫性生长,临床表现为子宫增大、月经失调(主要表现为月经量过多、经期延长)、痛经及贫血等症状[10-12]。子宫腺肌病传统治疗方法为药物治疗和手术治疗,但药物不能根治病灶,而且药物治疗的副作用使患者无法坚持用药,子宫切除可彻底清除病灶,但不适用于未生育患者,且手术创伤大,术后恢复慢。目前超声引导下PMWA等微创或无创保守治疗已成为首选治疗方法。声诺维是第二代超声微泡造影剂,其内含高密度的惰性气体六氟化硫,稳定性好,能产生较强的谐波信号,可以获取较低噪声的实时谐波图像,CEUS在肿瘤的检出和定性诊断中,以及肿瘤热疗后的效果评价中已广泛应用[13]。但是以往CEUS评价PMWA治疗子宫腺肌病的消融效果、应用价值及临床疗效,探讨CEUS在微波消融子宫腺肌病术后评价消融范围的准确性及安全性的报道较少。
本研究对31例行PMWA的子宫腺肌病病例进行分析,CEUS与增强MRI在消融后所示无强化体积差异没有统计学意义(t=0.285,P=0.778)。另外,本研究中提到的4例子宫腺肌病病灶在同一治疗中第一次消融完成后,即刻超声造影显示消融区有残存病灶,其中2例测量有效消融区体积分别为:38.0 cm3、32.3 cm3,立即补充消融,术后1~2 d CEUS示有效消融区体积分别为42.4 cm3、35.1 cm3,消融效果满意,另外2例因后位子宫,病灶前方有肠管遮挡,无进针路径,因此未行补充消融。作者认为采用CEUS评价病变消融效果及时和直观。
子宫腺肌病PMWA术中密切监测热场高回声范围,术后子宫周围膀胱、肠管等器官均发生病理形态学损害,确保安全的基础上,缓解了患者的痛经、贫血等症状。31例子宫腺肌病患者PWMA治疗术后3个月复查时痛经评分较术前下降1~6分,其中19例子宫腺肌病患者PMWA治疗后较治疗前痛经评分下降4分以上,12例子宫腺肌病患者PMWA治疗后较治疗前痛经评分下降1~4分,提示31例子宫腺肌病患者微波消融治疗有效[14]。因本研究样本量有限,仅统计PWMA术后3个月及6个月患者非月经期的血红蛋白浓度,术后3个月及6个月患者非月经期的血红蛋白与治疗前相比明显好转(P<0.05),提示贫血症状明显改善,PMWA治疗效果有效。本研究中31例子宫腺肌病行PMWA治疗术后,10例患者自述出现阴道流液现象,大多为淡粉色、咖啡色或洗肉水样液体,考虑为消融病灶液化坏死后的排出[15],其中1例患者自述为血性分泌物,考虑为微波消融术中内膜受消融刺激后的反应[15-16],对10例阴道流液患者均未做特殊处理,2~11 d后阴道流液或流血现象均消失。术中多数患者发生穿刺点及消融区疼痛,这些反应为PWMA术中常见的不良反应,与声诺维造影剂的使用无关,表明PMWA治疗子宫腺肌病术中,CEUS检查评价消融效果安全性好。
综上所述,PMWA治疗子宫腺肌病效果显著,CEUS可以安全并且准确地评价PMWA术后消融范围,值得临床应用。
[1] 张晶,韩治宇,冯蕾,等.经皮穿刺微波消融治疗弥漫性子宫腺肌病[J].中华医学杂志,2011,91(39):2749-2752.
[2] 张晶,冯蕾,张冰松,等.超声引导经皮子宫肌瘤微波消融后随访研究[J].中华医学杂志,2011,91(1):48-50.
[3] 何光彬,周晓东,李秋洋,等.超声造影评价射频治疗子宫肌瘤的疗效及其应用价值[J].中华超声影像学杂志,2008,17(9): 793-795.
[4] 翟栋材,张申杰,张博,等.超声造影与增强MRI评价聚焦超声消融治疗子宫腺肌症的对照研究[J].山东大学学报(医学版),2014,52(S1):112-113.
[5] Champaneria R,Abedin P,Daniels J,et al.Ultrasound scanand magnetic resonance imaging for the diagnosis of adenomyosis: systematic review comparing test accuracy[J].Acta Obstet Gyn Sca,2010,89(11):1374-1384.
[6] Larroy C.Comparing visual-analog and numeric scales for assessing menstrual pain[J].Behav Med,2002,27(4):179-181.
[7] Khatri A, Kalra N.A comparison of two pain scales in the assessment of dental pain in East delhi children[J].Isrn Dent,2012,2012:247-351.
[8] 王芳,张晶,韩治宇,等.超声造影在经皮微波消融子宫肌层良性病变围手术期中的作用[J/CD].中华医学超声杂志(电子版),2012,9(1):52-56.
[9] Wang F,Zhang J,Han ZY,et al.Imaging manifestation of conventional and contrast-enhanced ultrasonography in percutaneous microwave ablation for the treatment of uterine fi broids[J].Eur J Radiol,2012,81(11):2947-2952.
[10] Xia M,Jing Z,Zhi YH,et al.Feasibility study on energy prediction of microwave ablation upon uterine adenomyosis and leiomyomas by MRI[J].Brit J Radiol,2014,87(1040):20130770.
[11] Cockerham AZ.Adenomyosis: a challenge in clinical gynecology[J]. J Midwifery Wom Heal,2012,57(3):212-220.
[12] Ferenczy A.Pathophysiology of adenomyosis[J].Hum Reprod Update,1998,4(4):312-322.
[13] Bergeron C,Amant F,Ferenczy A.Pathology and physiopathology of adenomyosis[J].Best Pract Res Cl Ob,2006,20(4):511-521.
[14] Lei F,Jing Z,Bo W,et al.Uterine myomas treated with microwave ablation: The agreement between ablation volumes obtained from contrast-enhanced sonography and enhanced MRI[J].Int J Hyperther,2014,30(1):11-18.
[15] 张晶,关铮,钱林学,等.超声引导经皮微波消融治疗子宫腺肌病的临床应用方法及建议[J/CD].中华医学超声杂志(电子版),2016,13(2):96-100.
[16] Wylot B,Staszkiewicz J,Okrasa S.The expression of genes coding for opioid precursors,opioid receptors,beta-LH subunit and GnRH receptor in the anterior pituitary of cyclic gilts[J]. J Physiol Pharmacol,2008,59(4):745-758.
[17] MedenH,Fattahi-Meibodi A.CA125 in benign gynecological conditions[J].Int J Biol Markers,1998,13(4):231-237.
本文编辑 聂孝楠
Effect and Application Value of Contrast-Enhanced Ultrasound in Treatment of Percutaneous Microwave Ablation for Uterine Adenomyosis
ZHAO Ying-ying1,2, LI Yong-jie2, LI Dong2, LI Jie1, HONG Cheng21.Department of Ultrasound, Qilu Hospital of Shandong University, Jinan Shandong 250012, China; 2.Department of Ultrasound, the Tumor Hospital of Liaocheng, Liaocheng Shandong 252000, China
ObjectiveTo explore the effect and application value of Contrast Enhanced Ultrasound (CEUS) in treatment of Percutaneous Microwave Ablation (PMWA) for uterine adenomyosis.Methods31 patients who were diagnosed as uterine adenomyosis by contrast-enhanced MRI voluntarily underwent PMWA. CEUS was performed before and after PMWA 1~2 d, contrast-enhanced MRI was also performed after the treatment. Analysis the accuracy of ablation range detected by CEUS after PMWA treatment.ResultsAfter PMWA treatment of 31 cases of uterine adenomyosis, CEUS showed that there was no contrast agent perfusion after ablation of uterine fi broids, and the ablation volume was (49.4+29.8) cm3. The volumes detected by CEUS and contrast-enhance MRI showed no significant statistical differences (P>0.05), the symptoms such as dysmenorrhea and anemia were obviously relieved after PMWA treatment.ConclusionsCEUS can accurately evaluate the effect of microwave ablation uterine adenomyosis, which is worthy of clinical application.
contrast enhanced ultrasound; sono vue; uterine adenomyosis; percutaneous microwave ablation; MRI
R445.1;R711.71
A
10.3969/j.issn.1674-1633.2017.04.017
1674-1633(2017)04-0062-04
2016-12-20
2017-01-16
李杰,主任医师,教授。
通讯作者邮箱:jieli301@163.com

