绿原酸清洁提取及其体外生物活性评价
王星敏, 李 鑫, 邵承斌, 张 宇
(1.催化与功能有机分子重庆市重点实验室,重庆400067;2.重庆工商大学环境与资源学院,重庆400067)
绿原酸清洁提取及其体外生物活性评价
王星敏1,2, 李 鑫2, 邵承斌2, 张 宇2
(1.催化与功能有机分子重庆市重点实验室,重庆400067;2.重庆工商大学环境与资源学院,重庆400067)
植物纤维组织致密结构阻碍天然生物活性成分绿原酸的溶出,为减少绿原酸溶出的传质阻力,选取复配酶(纤维素酶和木质素酶)催化水解金银花叶溶浸获得绿原酸,并采用DPPH自由基清除法、铁氰化钾还原法评价提取物绿原酸的体外抗氧化性。分析酶解金银花叶后的SEM照片发现,酶能有效破坏植物纤维组织结构,有助于形成内部疏松结构,而金属离子对酶催化水解活性作用依次为Mg2+>Na+>Ca2+>K2+>Cu2+;选取纤维素酶-木质素酶酶活比为3∶2的复配酶,在水浴温度45℃、pH 4的条件下,当复配酶投加量为50 U/g时,在Mg2+诱导催化水解2 g金银花叶11 h后,绿原酸浸提率达94.68%,比超声醇提法提高了19.60%,所得绿原酸具备高抗氧化性和还原性,为资源化利用金银花叶以及绿原酸生产提供了新途径。
绿原酸;酶促反应;金银花叶;抗氧化性
绿原酸,1,3,4,5-四羟基环己烷羧酸-(3,4-二羟基肉桂酸酯),又称“植物铂金”,是由咖啡酸与奎尼酸组成的羧酚酸,具有抗病毒、降血脂、降血压等功效[1-3],常作为护肝益肾,防治心血管系统疾病、糖尿病等有显著疗效的重要药物的合成原料。绿原酸也是一种有效的酚型抗氧化剂,因其分子式中含有R—OH基[4],能形成具有抗氧化作用的氢自由基,可捕获并中和羟基自由基和超氧阴离子,生成较稳定的半醌式自由基,从而保护组织免受氧化作用的损害[5]。现代科学对绿原酸生物活性的研究已深入到医药保健、食品及日用化工等行业。目前绿原酸国际市场需求量超过8 000 t/年,国内达7 000 t/年以上,需求量逐年攀升,其价格随纯度增大而高升。
我国绿原酸提取技术主要有水提法、稀醇法、冷浸法、渗漉法、乙醇回流法等[6-10],这些技术或多或少还存在能耗大、成本高、污染重、纯度低等问题,加之工艺中高温、强光以及长时间加热等,加速绿原酸水解及其异构化。关键技术的桎梏降低了绿原酸产品品质和国际市场竞争力,高效清洁提取绿原酸越来越引起人们的关注。金银花叶中绿原酸质量分数约4%,但金银花叶纤维组织的结晶结构所形成天然屏障阻碍了绿原酸的溶出、扩散[11]。基于此,将酶促反应[12-13]应用于金银花叶中绿原酸的提取,利用生物催化剂酶的专一性和高效性,研究催化裂解植物纤维组织的酶活性,减少绿原酸扩散、迁移的传质阻力,高效获得生物活性完备的提取物绿原酸,为绿原酸的功能特性研究以及金银花叶资源化利用,提供理论依据和实践基础。
1 材料与方法
1.1 仪器与试剂
1.1.1 原料 金银花叶,取自重庆市秀山县的种植农户。
1.1.2 仪器 1260型高效液相色谱仪,美国Agilent公司制造;320-S pH计,KQ-400KDB超声波清洗机,昆山市超声仪器有限公司制造;80-2型高速离心机,上海君竺仪器制造有限公司制造。
1.1.3 试剂 绿原酸(标品),甲醇,冰乙酸(色谱纯),乙醇,柠檬酸,磷酸氢二钠,抗坏血酸VC,铁氰化钾(分析纯),国药集团化学试剂有限公司产品。纤维素酶(1 000 U/g),北京奥博星生物技术有限公司制品;木质素酶(1 400 U/g),海林万力达集团公司制品。
1.2 方法
1.2.1 绿原酸的浸提
1)酶催化辅助浸提方法:分别称取120目金银花叶2 g左右置于250 mL的锥形瓶中,投加20~200 U/g的复配酶 (纤维素酶和木质素酶的质量比为1∶1~3∶1),金银花叶与水比例为1∶10(g/mL),调节pH为4,于35℃水浴温度下摇床酶解2~14 h后,加入体积分数为62.5%的乙醇,加入量与固态原料质量比为1 g∶12 mL,经100 W超声波于30℃超声浸提30 min后过滤,分别收集滤渣和滤液,滤液即含有绿原酸[11];滤渣集中收集后待二次利用。其中,酶解温度、固液比(g/mL)、体系pH值的参数值是利用均匀设计法分析及实验验证所得 (另作报道);本文着重探讨的酶催化活性影响因素及考察范围为:复配酶质量比为1∶1~3∶1,复配酶投加量为20~200 U/g,酶解时间为2~14 h;金属离子主要考察Mg2+、Na+、Ca2+、K2+、Cu2+等的影响。
2)超声醇提方法:超声醇提法主要考察非酶催化辅助的超声作用下的绿原酸浸提能力。其中,除复配酶投加量为0 U/g、水浸泡时间为11 h外,其余参数与酶催化浸提方法中参数一致。
1.2.2 绿原酸的检测 采用高效液相色谱法[14]测定绿原酸质量浓度,检测溶浸液中主要成分。条件:色谱柱为C18(150 mm×4.6 mm,5 μm),流动相是V(甲醇)∶V(冰乙酸)∶V(超纯水)为18∶1∶81,体积流量0.8 mL/min,柱温30℃,进样量20 μL,检测波长327 nm。绘制标准曲线
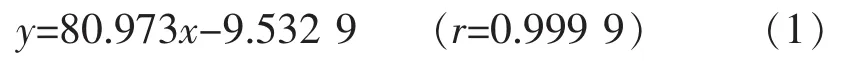
金银花叶中绿原酸溶出率

式(2)中,c为酶解后溶出的绿原酸质量浓度,取平行样均值,g/L;V为浸提液体积,mL;N为浸提液测定前稀释倍数;m为金银花叶质量,g;4.5%为当批次金银花叶中绿原酸的质量分数,即采用传统化学法[12]多次浸提直至绿原酸质量浓度检测为零时的所有量加和与金银花叶质量的比值。
1.2.3 酶解后底物SEM扫描及图像分析 制备样品固定于样品台,经离子溅射仪上真空干燥、铂喷镀后,于扫描电子显微镜下观察、拍摄取图。电镜工作电压为5 kV,放大2 000倍。
1.2.4 绿原酸清除DPPH·的活性分析 准确量取0.1 mL不同浓度的绿原酸浸提液,与 2.9 mL 0.017 mg/mL DPPH·-甲醇溶液混匀后,在暗处静置30 min,采用紫外分光光度计法,以甲醇作为参比液,于517 nm处测定待测样品加入前后DPPH·-甲醇溶液的吸光度[15],通过DPPH·吸光度的改变量,评价绿原酸的抗氧化能力,清除率
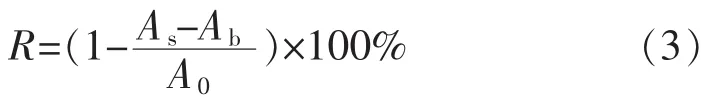
式(3)中,A0为甲醇+DPPH·-甲醇溶液的吸光度;As为样品液+DPPH·-甲醇溶液的吸光度;Ab为样品液+甲醇的吸光度。
1.2.5 绿原酸还原能力分析 采用铁氰化钾还原法[15]评价绿原酸还原能力。在不同浓度的绿原酸浸提液中加入2.5 mL 0.2 mol/L、pH 6.6的磷酸盐缓冲液,加入2.5 mL 100 g/L的三氯乙酸,离心取上清液2.5 mL,加2.5 mL H2O、0.5 mL 1 g/L的FeCl3,于700 nm波长测定吸光度,评价绿原酸还原能力。
2 结果与分析
2.1 酶催化活性对绿原酸溶浸的促进作用
2.1.1 促进绿原酸溶浸的不同配比酶活性比较金银花叶中木质素和半纤维素交联形成网状结构,将纤维素包埋其中,形成天然屏障阻碍绿原酸溶出及扩散。分析金银花叶组分及其结构,选用纤维素酶和木质素酶,探讨不同配比复配酶对绿原酸溶浸的影响。由图1可知,纤维素酶对绿原酸酶解溶浸能力虽略优于木质素酶,但纤维素酶和木质素酶协同溶浸绿原酸效果明显优于各单一组成酶,原因在于纤维素酶由C1酶、Cx酶和β葡糖苷酶组成,C1酶破坏着纤维素的结晶结构,Cx酶是分解β-1,4-糖苷键的纤维素酶,β葡糖苷酶可以将纤维二糖、纤维三糖及其他低分子纤维糊精分解为葡萄糖;纤维素酶的这种复杂酶系分步协同并保障促进了对纤维组织的水解;而木质素酶可强化对木质素的降解,从而增大纤维素酶进入并水解底物中纤维素,二者协同作用,加大催化活性中心与底物的结合几率,提高水解能效。即,当纤维素酶与木质素酶的质量比为2∶1(酶活比为3∶2)时,金银花叶中绿原酸浸提率达最大值89.8%。此外,超声醇提所得绿原酸浸提率为78.81%,明显低于任一单一酶或复配酶催化作用下的绿原酸浸提率,表明酶催化水解有助于提高绿原酸的提取率。
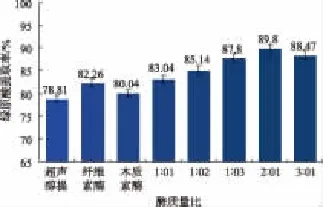
图1 不同复配酶配比对绿原酸溶浸的影响Fig.1 Effect of different mass ratio of emzyme on chlorogenic acid extraction
对比分析超声醇提处理和复配酶催化水解后的金银花叶的SEM照片(见图2)可知,超声醇提后金银花叶(见图2(a))表面虽有空隙,可见部分浊蚀,但叶体连续;经酶催化水解处理后的金银花叶(见图2(b))组织间孔隙较大,且叶体断层清晰,内部结构疏松,表面浊蚀现象明显。表明酶与底物结合,能催化裂解植物纤维组织,达到破坏植物纤维组织的结晶结构的目的,从而提高了绿原酸破壁溶出、运移、扩散的能力。
2.1.2 复配酶投加量对绿原酸溶浸的影响 酶催化活性中心与底物的结合数量,影响单位时间酶反应速度[16]。为进一步提高绿原酸溶浸能效,探讨纤维素酶和木质素酶的酶活比3∶2时复配酶不同投加量对绿原酸溶浸的影响。由图3可知,相同条件下,当复配酶投加量为50 U/g时,绿原酸溶浸效果最好,浸提率可达90.24%,表明单位时间里适当的酶投加量可增大酶与底物结合几率,从而增加被催化水解的植物组织,绿原酸浸提率得以提高。原因在于纤维素酶中水解次要地位的外切型-β-葡糖苷酶(CBH)组分的水解程度依赖于内切型-β-葡糖苷酶(EG)水解所产生的非还原糖端基;酶投加量适量时,EG组分与底物结合充分,CBH组分的水解程度随之加快,有利于水解;随着投加量的增加,水解程度相对减缓;当投加量增加至过于饱和时,底物吸附位置趋于有限,导致EG水解逐渐停止,而CBH组分占主导作用。此外,当酶投加量为0 U/g,超声醇提所得绿原酸浸提率为79.16%,明显低于任一酶催化作用下的绿原酸浸提率,表明酶催化水解有助于提高绿原酸的提取率。

图2 金银花叶SEM扫描图片Fig.2 Scanning electron micrographs ofLonicera japonica leaf
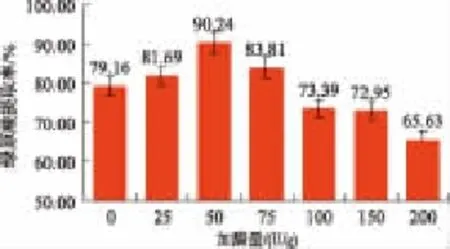
图3 不同酶投加量对绿原酸溶浸的影响Fig.3 Effectofdifferentamountofenzyme on chlorogenic acid extraction
2.1.3 复配酶催化水解活性随时间的变化 酶与底物结合形成ES构型需要一定的作用时间,酶活性及其催化水解反应过程均与酶解时间相关联,复配酶投加量为50 U/g时,探讨绿原酸浸提率随酶解时间的变化。由图4可知,随着复配酶与底物作用时间的延长,绿原酸浸提率随之增加,当酶解时间为11 h时,体系中绿原酸浸提率可达92.46%。这说明木质素和半纤维素的交联形式虽影响纤维素酶水解纤维素大分子,但木质素酶与纤维素酶协同作用,因酶的专一特性,同时强化植物纤维中纤维素和木质素的降解,但在这过程中,纤维素酶与木质素酶的协同催化既是连续进行的过程,也是分别作用的过程,故存在时间滞后现象;加之底物中其他组分伴随绿原酸的溶出而溶出,不仅引发绿原酸扩散及传质阻扰[17],其中底物含有的金属离子也会增大对酶活性的抑制作用,从而导致绿原酸浸提率降低。

图4 复配酶随时间对绿原酸溶浸的影响Fig.4 Effect of different time on extraction of chlorogenic acid
2.1.4 不同介质环境促进酶催化水解 金属离子常常在代谢酶的协同调控中发挥作用[18-19]。金属离子对酶活性作用,主要通过金属离子与酶产生底物形变,诱导底物分子内敏感键更加敏感,产生“电子张力”发生形变,从而增强或抑制酶活化能力。对比图5中各金属离子对复配酶的相对活力可知,当投加50 U/g的复配酶酶解11 h时,不同金属离子作用的酶活力差异较大,其对酶催化性能的促进作用依次为Mg2+>Na+>Ca2+>K2+>Cu2+,表明K+和Cu2+溶液体系中复配酶的酶活性相对受到抑制,而碱金属或碱土金属,如Na+、Mg2+或Ca2+则有较明显的促进作用,其中Mg2+诱导作用下,酶催化水解浸提绿原酸浸提率可达94.64%。
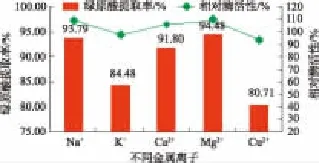
图5 不同金属离子对绿原酸溶浸及酶活力的影响Fig.5 Effect of different metal ion on extraction of chlorogenic acid
2.2 绿原酸的抗氧化性分析
2.2.1 绿原酸清除DPPH·能力评价 DPPH自由基清除法是评价抗氧化活性高低的一种目前常用的方法,其效果能体现抗氧化剂给出氢原子的能力。当有自由基清除剂存在时,DPPH自由基捕捉一个电子与游离电子配对,生成稳定的分子态DPPH2[20],如图6所示,致使深紫色溶液褪色,其褪色程度与自由基清除剂的数量和清除能力呈定量关系。对比图7中不同纯度绿原酸与抗坏血酸对DPPH·清除能力可知,绿原酸清除DPPH·能力明显强于抗坏血酸,能使自由基成为更为稳定的物质,从而终止有害自由基的链式反应;且清除DPPH·的清除速度很快,粗提物清除率达84.2%,纯度98%绿原酸清除率达86.78%。由图8可知,当反应15 min以后,清除自由基的趋势变得平缓,直至 25 min及以后,DPPH·清除率可达91%。由此可以看出,绿原酸能中断自氧化链式反应,使自由基成为更稳定的物质,在一定质量浓度范围内,纯度越高,所生成的稳定物质越快也越多。
2.2.2 绿原酸还原能力分析 还原能力的测定,可检验受试物是否为良好的电子供应者,通过体系溶液颜色改变(所供应电子使Fe3+还原为Fe2+),反映出体系中氧化还原状态的改变。对比分析纯度98%绿原酸、纯度95%绿原酸、绿原酸粗提物以及抗坏血酸加入化合物后在700 nm处的吸光度值,由图9可知,质量浓度低于0.01 mg/mL时,绿原酸的吸光度值均低于抗坏血酸,说明低质量浓度下绿原酸还原能力比较差;但随着其质量浓度及纯度的增大,纯度95%绿原酸、纯度98%绿原酸、绿原酸粗提物的吸光度值增大,并在实验范围内表现出良好量效关系,表明绿原酸可作为电子提供者与自由基反应,具有良好的还原能力,纯度越高,还原能力越强。

图6 DPPH自由基转化为DPPH2示意图Fig.6 Conversion of DPPH free radicals to DPPH2

图7 不同纯度绿原清除DPPH·随质量浓度变化Fig.7 Comparison of different purity of chlorogenic acid onDPPH·scavengingeffectwithmassconcentration
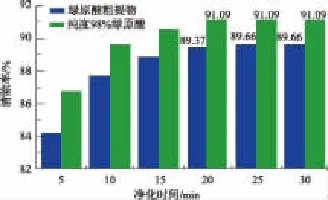
图8 绿原酸清除DPPH·的时间变化Fig.8 Comparison of chlorogenic acid on DPPH· scavenging effect with different time

图9 不同纯度绿原酸清除还原能力比较Fig.9 Comparison of reduction ability of different purity of chlorogenic acid
3 结语
应用纤维素酶和木质素酶协同催化水解金银花叶植物组织浸提绿原酸,对比分析酶解前后金银花叶SEM照片发现,酶催化水解能有效破坏金银花叶植物组织结晶结构,有助于植物内部形成疏松结构,减少绿原酸溶出阻力。分析获得不同组配的溶出绿原酸的纤维素酶和木质素酶的组配,以及不同价态金属离子对酶催化活性的影响。实验表明:在Mg2+诱导作用下,纤维素酶-木质素酶酶活比为3∶2的复配酶50 U/g,于水浴温度45℃、pH 4的条件下催化水解2 g金银花叶11 h后,绿原酸浸提率达94.68%,比超声醇提法的提高19.60%。采用DPPH自由基清除法、铁氰化钾还原法评价提取物绿原酸的体外抗氧化性,发现浸提绿原酸具备较高的抗氧化性,清除DPPH·能力明显强于抗坏血酸;也是良好的电子供应者,且随着质量浓度及纯度的增大,其还原能力增强,为资源化利用金银花叶以及绿原酸生产应用提供了新的途径。
[1]CROZIER A,JAGANATH B,CLIFFORD M N.Dietary phenolics:Chemistry,bioavailability and effects on health[J].Nat Prod Rep,2009,26:1001-1043.
[2]HENRY-VITRAC C,IBARRA A,ROLLER M,et al.Contribution of chlorogenic acids to the inhibition of human hepatic glucose-6-phosphatase activity in vitro by Svetol,a standardized decaffeinated green coffee extract[J].J Agric Food Chem,2010,58:4141-4144.
[3]LIU Ying,GUO Mingye,BAI Gengben.The research progress of chlorogenic acid[J].Journal of Chinese Medicinal Materials,2012,35(7):1180-1185.(in Chinese)
[4]ZHANG L,HUANG D,KONDO M,et al.Novel high-throughput assay for antioxidant capacity against superoxide anion[J].J Agric Food Chem,2009,57:2661-2667.
[5]LAN Xiaoyan,ZHANG Xuejun,GONG Guizhen.The progress of chlorogenic acid in encomia leaf[J].Chinese Agricultural Science Bulletin,2009,25(21):86-89.(in Chinese)
[6]LI Yarong,YANG Peilin.Progress on detection of active ingredients in honeysuckle[J].Western Journal of Traditional Chinese Medicine,2012,25(6):109-110.(in Chinese)
[7]MULLEN W,NEMZER B,OU B,et al.The antioxidant and chlorogenic acid profiles of whole coffee fruits are influenced by the extraction procedures[J].J Agric Food Chem,2011,59:3754-3762.
[8]CHEN Wenxing,PENG Zesheng,YE Shaoling,et al.Honeysuckle extract conditions on the content of chlorogenic acid[J].Guide of China Medicine,2013,11(2):429-430.(in Chinese)
[9]ZHANG B,YANG R Y,ZHAO Y,et al.Separation of chlorogenic acid from honeysuckle crude extracts by macroporous resins [J].Journal of Chromatography B,2008,867:253-258.
[10]AYAZ A M,NAJMA M,MUHAMMAD I B.Micelle-mediated extraction of chlorogenic acid from Morus laevigata W.leaves[J]. Separation and Purification Technology,2010,76(2):179-183.
[11]JAISWAL R,SOVDAT T,VIVAN F,et al.Profiling and characterization by LC-MSn of the chlorogenic acids and hydroxycin-namoylshikimate esters in mat_e(Ilex paraguariensis)[J].J Agric Food Chem,2010,58:5471-5484.
[12]WANG Xingmin,XU Longjun,YIN Zhongyi,et al.Improved extraction of solanesol from tobacco waste by enzymatic cell wall breaking[J].Chinese Journal of Biotechnology,2013,2013,29(11):1-5.(in Chinese)
[13]KIM Y,MOSIER N S,LADISCH M R.Enzymatic digestion of liquid hot water pretreated hybrid poplar[J].Biotechnol Progr,2009,25(2):340-348.
[14]HU Juwu,LI Xionghui,XIONG Wei,et al.Phase separation and extraction with n-hexane for the preparation of high purity chlorogenic acid[J].Food Science,2010,31(14):37-41.(in Chinese)
[15]乌兰.金银花中绿原酸的提取及抗氧化性的研究[D].天津:天津科技大学,2005.
[16]FANG Xu,QIN Yuqi,LI Xuezhi,et al.Progress on cellulase and enzymatic hydrolysis of lignocellulosic Biomass[J].Chin J Biotech,2010,25;26(7):864-869.(in Chinese)
[17]JAISWAL R,PATRAS M A,ERAVUCHIRA P J,et al.Profile and characterization of the chlorogenic acids in green robusta coffee beans by LC-MSn:Identification of seven new classes of compounds[J].J Agric Food Chem,2010,58:8722-8737.
[18]GUGLIUCCI A,DEBORAH H,MARKOWICZ B,et al.Caffeic and chlorogenic acids in Ilex paraguariensis extracts are the main inhibitors of AGE generation by methylglyoxal in model proteins[J].Fitoterapia,2009,80:339-344.
[19]LIN Chunmei,ZHOU Mingqian.Optimization by orthogonal array design of extraction of chlorogenic acid from burdock root peels[J].Food Science,2013,34(6):64-67.(in Chinese)
[20]LI Xuanjun,CUI Shengyun.DPPH radical scavenging mechanism of ascorbic acid[J].Food Science,2011,32(1):86-90.(in Chinese)
Eco-Friendly Extraction of Chlorogenic Acid and its Biological Activity Evaluation in Vitro
WANG Xingmin1,2, LI Xin2, SHAO Chengbin2, ZHANG Yu2
(1.Key Laboratory of Catalysis Science and Technology of Chongqing Education Commisssion,Chongqing Technology and Business Universtiy,Chongqing 400067,China;2.College of Environment and Resources,Chongqing Technology and Business Universtiy,Chongqing 400067,China)
The chlorogenic acid was a natural bioactive ingredient which was usually hindered in the dense structure of plant fibers and difficult to be extracted.An enzymatic cell wall-breaking process was thus developed using the combination of cellulase and ligninase to reduce transfer resistance during extraction and to improve the extraction efficiency of chlorogenic acid from Lonicera japonica leaves.The antioxidant activity in vitro of chlorogenic acid was evaluated by DPPH free radical scavenging method and ferricyanide reduction analysis.The product of enzymatic hydrolysis by the dual-enzyme complex was characterized by SEM.The complex was confirmed to effectively destruct the plant fiber structure and help to form the internal loose structure.The effect of various metal ions on the enzyme activity were weakened in the order of Mg2+,Na+,Ca2+,K+,and Cu2+.The optimizedextraction condition was determined using 3∶2 of cellulase to ligninase ratio (U/U)with 50 U/g of enzymes/substrate and Mg2+at 45℃and pH 4.0 for 11 h.Under the optimal condition,the extraction rate of chlorogenic acid could reach as high as 94.68%,which was 19.60%higher than that of ultrasound-assisted ethanol extraction.The anti-oxidative of reductive activities of chlorogenic acid were improved.This study provides a theoretical foundation to the comprehensive utilization of Lonicera japonica leaves and industrialization of chlorogenic acid.
chlorogenic acid,enzymatic reaction,Lonicera japonica leaf,antioxidant activity
TQ 09
A
1673—1689(2017)02—0172—07
2015-01-19
重庆市科技攻关项目(cstc2013yykfB20001)。
王星敏(1975—),女,重庆人,工学博士,教授,主要从事农业废弃物资源化利用及健康产品开发研究。
E-mail:wang_chem@tom.com
王星敏,李鑫,邵承斌,等.绿原酸清洁提取及其体外生物活性评价[J].食品与生物技术学报,2017,36(02):172-178.

