复方银杏叶颗粒对急性胰腺炎肝功能损害的保护作用
胡永梅,王海燕,秦丽静(1.运城市中心医院药学部,山西运城 044000;.运城市中心医院消化内科,山西运城 044000)
复方银杏叶颗粒对急性胰腺炎肝功能损害的保护作用
胡永梅1*,王海燕2#,秦丽静2(1.运城市中心医院药学部,山西运城 044000;2.运城市中心医院消化内科,山西运城 044000)
目的:探讨复方银杏叶颗粒对急性胰腺炎肝功能损害的保护作用。方法:选取2013年9月-2015年9月我院收治的重症急性胰腺炎(SAP)合并肝功能损害患者82例,采用随机数字表法分为对照组和观察组,各41例。对照组患者给予SAP相关常规治疗;观察组患者在对照组基础上给予复方银杏叶颗粒5 g加入温开水80 mL中溶解后经鼻饲胃管注入,tid。1周为1个疗程,共治疗2个疗程。观察两组患者腹痛缓解时间、血清淀粉酶恢复时间、住院时间及不良反应发生情况,检测两组患者治疗前后血清淀粉酶、丙氨酸转氨酶(ALT)、总胆红素(TBIL)、天冬氨酸转氨酶(AST)、γ-谷氨酰转肽酶(γ-GT)、白蛋白(ALB)、白细胞介素-6(IL-6)、肿瘤坏死因子α(TNF-α)、肉毒素浓度、丙二醛(MDA)、过氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、总抗氧化能力(TAC)、外周血中性粒细胞中核因子-κB(NF-κB)水平。结果:对照组患者脱落3例,38例完成研究;观察组患者脱落6例,35例完成研究。观察组患者腹痛缓解时间、血清淀粉酶恢复时间、住院时间明显短于对照组,差异均有统计学意义(P<0.05)。两组患者治疗前血清淀粉酶、ALT、TBIL、AST、γ-GT、ALB、IL-6、TNF-α、肉毒素浓度、MDA、SOD、GSH-Px、TAC、NF-κB水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者血清淀粉酶、ALT、TBIL、AST、γ-GT、IL-6、TNF-α、肉毒素浓度、NF-κB、MDA水平显著降低,ALB、SOD、GSH-Px、TAC水平显著升高,且观察组显著优于对照组,差异均有统计学意义(P<0.05)。两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。结论:复方银杏叶颗粒能显著降低患者血清淀粉酶水平,保护肝功能,且安全性较好;其机制可能与抑制炎症因子释放、改善氧化应激反应、降低肉毒素浓度、抑制NF-κB活化有关。
急性胰腺炎;复方银杏叶颗粒;肝功能;炎症因子;氧化应激;保护机制
急性胰腺炎(AP)属于常见的消化系统疾病,大部分为轻型,具有自限性,但约15%~20%的患者因全身多脏器持续性损伤发展成重症急性胰腺炎(SAP),病情进展较快,累及多个脏器,预后较差[1]。肝功能损害是SAP较为常见的并发症,发生率高达85%,若治疗不当,不仅会加重原发病情,还可能增加肝功能衰竭风险[2]。因此,保护SAP患者肝功能在临床治疗中尤为重要。研究表明,中性粒细胞中核因子κB(NF-κB)会参与机体炎症反应和细胞凋亡,从而诱发SAP[3]。有研究指出,中药在SAP合并肝损害保护中可发挥重要作用[4]。银杏叶提取物具有清除氧自由基、组织保护作用,但对SAP患者肝功能损害的保护作用尚不明确,临床报道较少。因此,本研究探讨了复方银杏叶颗粒对SAP合并肝功能损害的保护作用,以期为临床用药提供参考。
1 资料与方法
1.1 纳入、排除及脱落标准
纳入标准:①符合《中国急性胰腺炎诊治指南》中拟定的SAP相关诊断标准[5]者;②首次合并肝功能损害者;③无需外科手术干预治疗;④入组前未接受相关治疗。排除标准:①合并脂肪肝、病毒性肝炎等病史或影响肝功能的慢性疾病者;②急性生理与慢性健康评分(APACHE)Ⅱ>25分者;③代谢性疾病患者;④恶性肿瘤患者;⑤妊娠期或哺乳期妇女;⑥继发性感染者;⑦对本研究药物过敏者。脱落标准:①治疗期间病情加重需接受手术治疗者;②出现严重不良反应,无法继续本研究者;③主观认为药物治疗无效主动退出研究者;④未按照规定服药者。
1.2 研究对象
选取我院2013年9月-2015年9月收治的SAP合并肝功能损害患者82例,采用随机数字表分为观察组和对照组,各41例。其中,观察组患者男性27例,女性14例;年龄29~68岁,平均年龄(51.26±3.99)岁;APACHEⅡ评分(15.26±4.64)分;Balthazar CT评分(5.96±1.26)分。对照组患者男性28例,女性13例;年龄28~68岁,平均年龄(50.19±4.18)岁;APACHEⅡ评分(14.28± 3.76)分;Balthazar CT评分(4.98±1.18)分。两组患者的一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案经医院医学伦理委员会批准,患者知情同意并签署知情同意书。
1.3 治疗方法
对照组患者给予常规治疗,包括禁食、禁水、补液、纠正水电解质平衡和酸碱质失衡、吸氧、抗感染、抑酸治疗,持续胃肠减压预防呕吐、误吸,并给予营养支持。观察组在对照组基础上加用复方银杏叶颗粒(江西济民可信药业有限公司,批准文号:国药准字Z20043730,规格:每袋装5 g)5 g加入温开水80 mL中溶解后经鼻饲胃管注入,tid。1周为1个疗程,共治疗2个疗程。
1.4 观察指标
①记录两组患者腹痛症状缓解时间、血清淀粉酶恢复时间、住院时间;②观察两组患者治疗前后血清淀粉酶水平、肝功能指标[丙氨酸转氨酶(ALT)、总胆红素(TBIL)、天冬氨酸转氨酶(AST)、γ-谷氨酰转肽酶(γ-GT)、白蛋白(ALB)]水平、炎症因子[白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、NF-κB]水平及肉毒素浓度、氧化应激指标[丙二醛(MDA)、过氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、总抗氧化能力(TAC)];③记录两组患者不良反应发生情况。
1.5 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以±s表示,采用t检验;计数资料以例数或率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 研究完成情况
观察组患者脱落6例,35例完成研究;对照组患者脱落3例,38例完成研究。
2.2 两组患者症状缓解时间及住院时间比较
观察组患者腹痛缓解时间、血清淀粉酶恢复时间、住院时间明显短于对照组,差异均有统计学意义(P<0.05),详见表1。
表1 两组患者症状缓解时间及住院时间比较(±s,d)Tab 1 Comparison of symptom remission time and length of hospital stay between 2 group(s±s,d)

表1 两组患者症状缓解时间及住院时间比较(±s,d)Tab 1 Comparison of symptom remission time and length of hospital stay between 2 group(s±s,d)
组别观察组对照组n 35 38 t P腹痛缓解时间4.02±0.96 5.24±1.32 4.483<0.05血清淀粉酶恢复时间4.51±1.19 6.08±1.38 5.185<0.05住院时间9.14±2.85 11.74±3.11 3.714<0.05
2.3 两组患者治疗前后血清淀粉酶和肝功能指标比较
治疗前,两组患者血清淀粉酶、ALT、TBIL、AST、γ-GT、ALB水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者血清淀粉酶、ALT、TBIL、AST、γ-GT水平明显降低,ALB水平明显升高,且观察组明显优于对照组,差异均有统计学意义(P<0.05),详见表2。
2.4 两组患者治疗前后炎症因子及肉毒素浓度比较
治疗前,两组患者IL-6、TNF-α、肉毒素、NF-κB水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者上述指标显著降低,且观察组显著低于对照组,差异均有统计学意义(P<0.05),详见表3。
2.5 两组患者治疗前后氧化应激指标比较
治疗前,两组患者MDA、SOD、GSH-Px、TAC水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者MDA水平明显降低,SOD、GSH-Px、TAC水平明显升高,且观察组明显优于对照组,差异均有统计学意义(P<0.05),详见表4。
2.6 不良反应
两组患者均未见严重不良反应发生,观察组患者不良反应发生率为8.57%,与对照组的7.89%比较,差异无统计学意义(P>0.05),详见表5。
表2 两组患者治疗前后血清淀粉酶和肝功能指标比较(±s)Tab 2 Comparison of liver function indexes between 2 groups before and after treatment(±s)
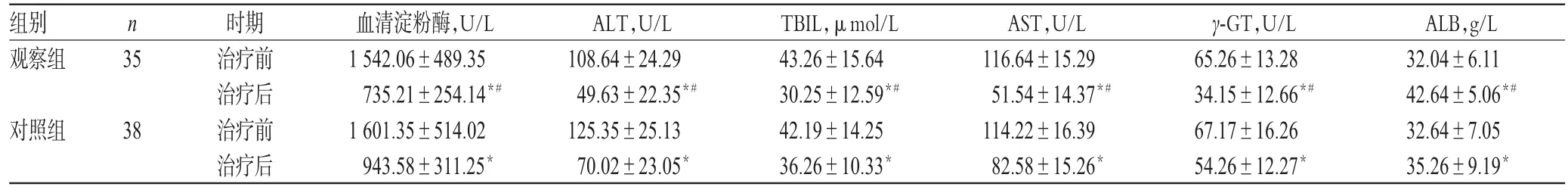
表2 两组患者治疗前后血清淀粉酶和肝功能指标比较(±s)Tab 2 Comparison of liver function indexes between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别观察组n 35对照组ALB,g/L 32.04±6.11 42.64±5.06*#32.64±7.05 35.26±9.19*38时期治疗前治疗后治疗前治疗后血清淀粉酶,U/L 1 542.06±489.35 735.21±254.14*#1 601.35±514.02 943.58±311.25*ALT,U/L 108.64±24.29 49.63±22.35*#125.35±25.13 70.02±23.05*TBIL,μmol/L 43.26±15.64 30.25±12.59*#42.19±14.25 36.26±10.33*AST,U/L 116.64±15.29 51.54±14.37*#114.22±16.39 82.58±15.26*γ-GT,U/L 65.26±13.28 34.15±12.66*#67.17±16.26 54.26±12.27*
表3 两组患者治疗前后炎症因子及肉毒素浓度比较(±s)Tab 3 Comparison of inflammation factors and creotoxin concentration between 2 groups before and after treatment(±s)
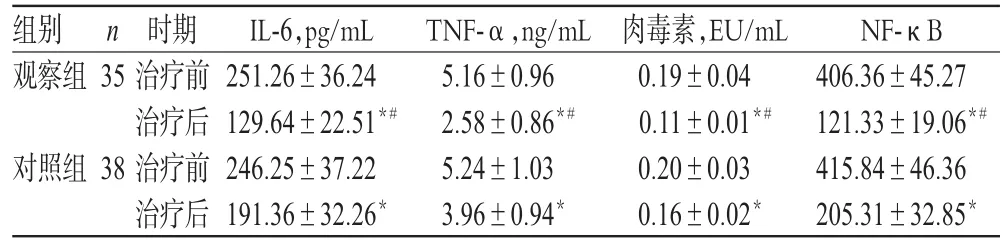
表3 两组患者治疗前后炎症因子及肉毒素浓度比较(±s)Tab 3 Comparison of inflammation factors and creotoxin concentration between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别观察组35 TNF-α,ng/mL 5.16±0.96 2.58±0.86*#5.24±1.03 3.96±0.94*n对照组38时期治疗前治疗后治疗前治疗后IL-6,pg/mL 251.26±36.24 129.64±22.51*#246.25±37.22 191.36±32.26*肉毒素,EU/mL 0.19±0.04 0.11±0.01*#0.20±0.03 0.16±0.02*NF-κB 406.36±45.27 121.33±19.06*#415.84±46.36 205.31±32.85*
表4 两组患者治疗前后氧化应激指标比较(±s)Tab 4 Comparison of oxidative stress indexes between 2 groups before and after treatment(±s)

表4 两组患者治疗前后氧化应激指标比较(±s)Tab 4 Comparison of oxidative stress indexes between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别观察组GSH-Px,μg/L 37.52±5.36 49.56±8.24*#36.02±5.48 44.26±3.69*n 35对照组38时期治疗前治疗后治疗前治疗后MDA,μmol/L 9.63±1.85 4.06±1.27*#9.86±1.96 7.26±1.38*SOD,nU/mL 75.26±12.68 101.02±15.85*#74.66±13.58 92.05±14.69*TAC,kU/L 9.16±1.58 13.26±2.69*#9.11±1.17 11.03±2.41*

表5 两组患者不良反应发生率比较(例)Tab 5 Comparison of the incidence of ADR between 2 groups(case)
3 讨论
SAP是临床常见的急重症,脏器官损害是导致SAP患者死亡的重要原因之一。肝脏具有调节物质代谢和解毒的功能,能抑制SAP患者异常胰酶激活及大量炎症介质扩散的作用,但大量炎症介质会损伤肝细胞,诱发肝功能损害。肝脏是SAP最易受损的器官,且与病情程度呈正相关。SAP既会延长病程,又增加肝衰竭发生风险[8]。因此,临床治疗SAP期间保护肝功能尤为重要。
目前,SAP合并肝功能损害的机制尚不明确,可能与以下原因有关:(1)肝脏与胰腺位置相近,胰腺血液回流会先经过肝脏,但急性期血液中胰酶、炎症介质含量明显增加,经过肝脏时,往往会损害肝细胞,诱发肝功能损害。(2)肉毒素作用。SAP患者往往会伴随肉毒素血症,加重胰腺损害。文献报道,SAP患者免疫功能下降,肠道菌群和毒素移位流入血液中,其中的肉毒素可直接损伤肝功能,还能通过激活肝巨噬细胞、分泌细胞因子损伤胰腺[6]。(3)炎症介质。炎症介质在SAP发生、发展中起重要作用。炎症介质增加,随血流进入肝脏,破坏肝细胞;而肝功能损害会降低对炎症介质、细胞因子的清除能力,造成恶性循环,不仅加重原发病情,还会累及其他重要脏器官[7]。TNF-α是常见的炎症因子,Lundberg P等[8]研究表明,SAP急性期TNF-α在肝脏中的表达会明显上升,参与肝损害。IL-6是由单核巨噬细胞释放的细胞因子,与胰腺炎程度密切相关。有研究指出,SAP患者IL-6升高先于C反应蛋白(CRP)出现,且能导致肝脏合成CRP,损伤肝细胞[9]。(4)NF-κB活化。NF-κB属于细胞核转录因子,在调节机体炎症、组织损伤修复等中发挥重要作用。(5)氧自由基。炎症介质增加,会诱导氧自由基生成,通过直接作用于肝细胞内细胞器,加速肝细胞凋亡、坏死[10]。有研究表明,机体氧化应激反应介导的脂质过氧化反应在肝损害中起重要参与作用[11]。(6)血管活性物质。SAP患者处于病理状态,血管活性物质也会明显增多,血管内皮素(ET-1)、一氧化氮(NO)是器官血流重要调节因子,一旦ET-1/NO比例失衡,血管收缩,外周血阻力增加,会引起血液循环障碍。肝血流低灌注,诱发肝功能损害。
SAP合并肝功能损害较为复杂,很难做到全面评估。本研究采用临床常见的肝功能指标评估肝功能,发现SAP患者ALT、TBIL、AST、γ-GT、ALB等存在异常,反映了不同程度的肝功能受损。复方银杏叶颗粒主要由银杏、红参、刺五加组成,具有活血祛瘀、通络的作用。银杏是我国特产的古代孑遗植物之一,主要成分为黄酮苷,且含有还原性羟基功能基团,通过氧自由基、烷自由基等终止自由基连锁反应链,改善机体氧自由基,抑制脂质过氧化反应,抑制MDA生成。萜类内酯也属于银杏叶提取物有效成分,属于血小板活化因子抑制剂,能预防肝低灌注。冀振华等[12]认为,银杏苦内酯B可降低胰腺炎大鼠血清淀粉酶,控制原发病情。Minor T等[13]研究显示,银杏苦内酯B可通过降低肉毒素水平,改善机体微循环。红参中有效成分红参皂苷,具有促进细胞合成作用,就改善微循环,促使物质代谢和蛋白合成。药理学研究表明,刺五加含有超氧化歧化酵素SOD复合物,可提高机体SOD水平,提高氧自由基清除能力,抑制脂质过氧化反应[14]。此外,刺五加还能促进血液循环,预防低灌注诱发的细胞损伤。
本研究结果显示,观察组治疗后肝功能指标改善情况优于对照组,症状改善时间及住院时间短于对照组,差异均有统计学意义(P<0.05)。观察组血清淀粉酶、炎症因子、氧化应激指标、NF-κB活化改善情况优于治疗前,差异有统计学意义(P<0.05),说明复方银杏叶颗粒可通过抗炎、抗氧化、抑制NF-κB活化发挥肝损害保护作用,有利于缩短病程。
综上所述,复方银杏叶颗粒能显著降低患者血清淀粉酶,保护肝功能,改善氧化应激反应,且安全性较好。但本研究中还存在局限性:(1)纳入病例较少,还有待扩大研究对象,进行大规程、前瞻性、多中心研究;(2)需进行随访观察,了解该药物对SAP合并肝损害患者远期预后的影响;(3)复方银杏叶颗粒对肝组织增殖细胞核抗原(PCNA)表达的影响,有待进一步分析;(4)肝功能损害评估尚无公认评估标准,未能量化肝脏损伤程度。
[1] 陈虹,王素莉,朱鲲鹏.血必净注射液辅助治疗急性重症胰腺炎的疗效观察[J].中国药房,2015,26(32):4549-4550.
[2] 颜琼,邓明明.核因子-κB在重症急性胰腺炎肝损伤中的作用[J].广东医学,2014,35(4):614-616.
[3] 周秉舵,王晓素,方盛泉,等.清下解胰方对重症胰腺炎大鼠TLR4/NF-κB信号通路的影响[J].北京中医药大学学报,2012,35(12):830-834.
[4] 易学东,罗亚文,杨建文,等.清胰Ⅱ号对老年急性胰腺炎肝损害患者的疗效[J].中国老年学杂志,2012,32(17):3640-3641.
[5] 中华医学会消化病学分会胰腺疾病学组,中华胰腺病杂志编辑委员会,中华消化杂志编辑委员会,等.中国急性胰腺炎诊治指南:2013年,上海[J].中华消化杂志,2013,33(4):217-222.
[6] 林英,朱曦,么改琦,等.重组人生长激素对肠源性内毒素血症大鼠急性肝损伤的影响[J].解放军医学杂志,2011,36(2):158-160.
[7] Jaeschke H.Reactive oxygen and mechanisms of inflammatory liver injury:present concepts[J].J Gastroenterol Hepatol,2011,26(1):173-179.
[8] Lundberg P,Yang HJ,Jung SJ,et al.Protection against TNF α-dependent liver toxicity by intraperitoneal liposome delivered DsiRNA targeting TNF-α in vivo[J].J Control Release,2012,160(2):194-199.
[9] Drucker C,Gewiese J,Malchow S,et al.Impact of interleukin-6 classic-and trans-signaling on liver damage and regeneration[J].J Autoimmun,2010,34(1):29-37.
[10] 周静,王成蹊,侯连兵,等.因宁片对甲亢性肝损害模型大鼠肝功能和氧化应激的影响[J].中药材,2011,34(2):278-281.
[11] 刘建国,高辉,于俊玲,等.双环醇对抗精神病药物所致肝损伤患者血清MDA及SOD活性的影响[J].中国实验诊断学,2014,18(9):1473-1475.
[12] 冀振华,王本茂,李少华.血小板激活因子在急性胰腺炎发病过程中作用的实验研究[J].中华外科杂志,1997,35(2):108-110.
[13] Minor T,Isselhard W,Yamaguchi T.Involvement of platelet activatingfactor in microcirculatory disturbances afterglobal hepatic is chemia[J].J Surg Res,1995,58(5):536-540
[14] 刘树民,张娜.刺五加多糖的现代研究进展[J].中医药信息,2014,31(2):116-119.
(编辑:黄 欢)
Protective Effect of Compound Ginkgo Leaf Granules on Liver Function Damage of Acute Pancreatitis
HU Yongmei1,WANG Haiyan2,QIN Lijing2(1.Dept.of Pharmacy,Yuncheng Municipal Central Hospital,Shanxi Yuncheng 044000,China;2.Dept.of Gastroenterology,Yuncheng Municipal Central Hospital,Shanxi Yuncheng 044000,China)
OBJECTIVE:To investigate the protective effect of Compound ginkgo leaf granules on liver function damage of acute pancreatitis.METHODS:Totally 82 patients with severe acute pancreatitis(SAP)complicated with liver function damage selected from our hospital during Sept.2013-Sept.2015 were randomized into control group and observation group according to random number table,with 41 cases in each group.Control group was given SAP related routine therapy.On the basis of the control group,observation group was additionally given Compound ginkgo leaf granules 5 g added into warm boiled water 80 mL via nasogastric tube,tid,one week as a treatment course,for 2 courses.The remission time of abdominal pain,serum amylase recovery time,length of hospital stay and adverse drug reactions were observed in 2 groups.The levels of serum amylase,ALT,TBIL,AST,γ-GT,ALB,IL-6,TNF-α,creotoxin concentration,MDA,SOD,GSH-Px,total antioxidant capacity(TAC)and peripheral blood PMN NF-κB levels were determined in 2 groups before and after treatment.RESULTS:In control group,3 patients withdrew from the study and 38 patients completed the study;in observation group,6 patients withdrew from the study and 35 patients completed the study.The remission time of abdominal pain,recovery time of serum amylase and the length of hospital stay in observation group were significantly shorter than control group,with statistical significance(P<0.05).Before treatment,there was no statistical significance in the levels of serum amylase,ALT,TBIL,AST,γ-GT,ALB,IL-6,TNF-α,creotoxin concentration,MDA,SOD,GSH-Px,TAC and NF-κB between 2 groups(P>0.05).After treatment,the levels of serum amylase,ALT,TBIL,AST,γ-GT,IL-6,TNF-α,creotoxin concentration,NF-κB and MDA in 2 groups were decreased significantly,while the levels of ALB,SOD,GSH-Px and TAC were increased significantly;the observation group was significantly lower or higher than the control group,with statistically significant(P<0.05).There was no statistical significance in the incidence of ADR between 2 groups(P>0.05).CONCLUSIONS:Compound ginkgo leaf granules can significantly decrease serum amylase,protect liver function,with good safety.The mechanismmay be inhibiting the release of inflammatory factors,improving oxidative stress reactions,reduce the concentration of creotoxin and inhibiting the activity of NF-κB.
Acute pancreatitis;Compound ginkgo leaf granules;Liverfunction;Inflammatory factor;Oxidative stress;Protective mechanism
R657.5+1
A
1001-0408(2017)11-1538-04
2016-04-12
2016-10-11)
*副主任药师。研究方向:临床药学。电话:0359-6397073。E-mail:hongmml@163.com
#通信作者:主任医师。研究方向:消化内科。电话:0359-6397593。E-mail:Linchuangyaoxue@163.com
DOI10.6039/j.issn.1001-0408.2017.11.29

