NaOH蚀刻玻碳电极的大肠杆菌DNA电化学生物传感器的构建及检测
许世超,温俊男,江 南,李 娇,王才富,董 凯,张忆一
(1.天津工业大学 环境与化学工程学院,天津 300387;2.天津工业大学 中空纤维膜材料与膜过程省部共建国家重点实验室,天津 300387)
实验技术
NaOH蚀刻玻碳电极的大肠杆菌DNA电化学生物传感器的构建及检测
许世超1,2*,温俊男1,江 南1,李 娇1,王才富1,董 凯1,张忆一1
(1.天津工业大学 环境与化学工程学院,天津 300387;2.天津工业大学 中空纤维膜材料与膜过程省部共建国家重点实验室,天津 300387)
以NaOH蚀刻后的玻碳电极为基底制备了高灵敏与高选择性的大肠杆菌电化学DNA传感器。经NaOH蚀刻后的玻碳电极被活化且在电极表面形成羧基层,为DNA探针的固定提供了更多位点,在偶联剂EDC/NHS的作用下,端氨修饰的探针DNA与羧基的羧氨反应使其以肽键的形式固定在电极表面,极大地提升了传感器的灵敏度。通过电化学循环伏安法(CV)和差分脉冲法(DPV)对所制备传感器的灵敏度和选择性进行表征,得到该传感器对大肠杆菌的线性检测范围为12.5~62.5 nmol/L,检出限可达1.20×10-9mol/L。
大肠杆菌;NaOH蚀刻;电化学生物传感器
大肠埃希氏菌(Escherichia coli)简称大肠杆菌(E.coli),分类于肠杆菌科、埃希氏菌属,为革氏染色阴性直杆菌[1]。部分大肠杆菌为致病性大肠杆菌,当其进入人体一些组织器官时可能会引起感染,如腹膜炎、膀胱炎、腹泻等,因此对大肠杆菌进行快速、准确的检测具有重要意义[2]。传统的大肠杆菌检测方法的特点是检测结果准确度较高,但检测时间长,操作过程繁琐,不利于大肠杆菌的快速检测[3-6]。目前采用的快速检测大肠杆菌的方法主要有滤膜法[7]、多管发酵法[8]、荧光免疫检测技术[9]、酶联免疫吸附法[10]、化学发光法[11]、电化学检测法[12-14]等。
本文采用NaOH蚀刻后的玻碳电极成功地制备出能够特异性快速检测大肠杆菌的电化学生物传感器,其原理为采用NaOH在玻碳电极表面蚀刻一层羧基基团,并以EDC/NHS作为连接剂将端氨修饰的大肠杆菌DNA与电极表面的羧基以肽键连接[3,15-16],通过电化学特性的改变达到检测大肠杆菌的目的。该方法检测时间短,具有较高的灵敏度和选择性,其检出限可达1.20×10-9mol/L。
1 实验部分
1.1 试剂与仪器
磷酸氢二钠、磷酸二氢钾(天津赢达稀贵化学试剂厂);亚甲基蓝、NHS(98%)、EDC、Tris(上海阿拉丁试剂公司)。以上试剂均为分析纯。
电化学工作站(美国阿美泰克-普林斯顿公司);甘汞电极(参比电极)、铂丝电极(辅助电极)、玻碳电极(工作电极)(天津艾达恒晟有限公司)。
1.2 电化学DNA传感器的构建及检测
(1)将玻碳电极用粒径为0.5 μm的氧化铝抛光粉进行抛光打磨处理5 min,然后将玻碳电极依次置于一定量的浓度为0.5 mol/L的HNO3溶液、无水乙醇以及超纯水中各超声1 min[17]。将处理好的玻碳电极置于铁氰化钾溶液中进行循环伏安扫描,其扫描速率为50 mV/s,扫描范围为-0.2~0.6 V。
(2)将抛光处理好的玻碳电极置于1 mol/L的NaOH溶液中进行循环伏安扫描,将电极表面充分活化后,在其表面蚀刻大量羧基基团,完成电极表面的NaOH蚀刻。进行电化学蚀刻时,扫描速率为50 mV/s,扫描范围为-0.1~1.2 V。
(3)在偶联剂NHS/EDC的作用下,单链DNA探针中修饰的氨基与电极表面的羧基形成肽键,使单链探针DNA固定在电极表面[3]。其具体操作步骤为:采用微量进样器量取5 μL单链DNA探针溶液,10 μL Tris-HCL溶液(含有20 mmol/L EDC,10 mmol/L NHS,pH 7.2)滴加至玻碳电极表面,在40 ℃下反应1 h,反应完成后用Tris-HCl缓冲液和超纯水进行冲洗,去除未组装的单链DNA,构建完成电化学DNA传感器[18],通过CV和DPV法对已构建成功的传感器进行性能表征。
(4)以亚甲基蓝(MB)[19]作为杂交指示剂,使其充分嵌入杂交DNA的双链结构中,并通过DPV法对电化学信号进行检测。其具体方法为:将杂交完成后的电极浸没在一定浓度的溶有亚甲基蓝的Tris-HCl缓冲液中进行自组装,组装完成后,依次采用Tris-HCl缓冲液和超纯水进行冲洗,除去未组装的亚甲基蓝,将处理后的电极置于Tris-HCl溶液中进行DPV信号检测。
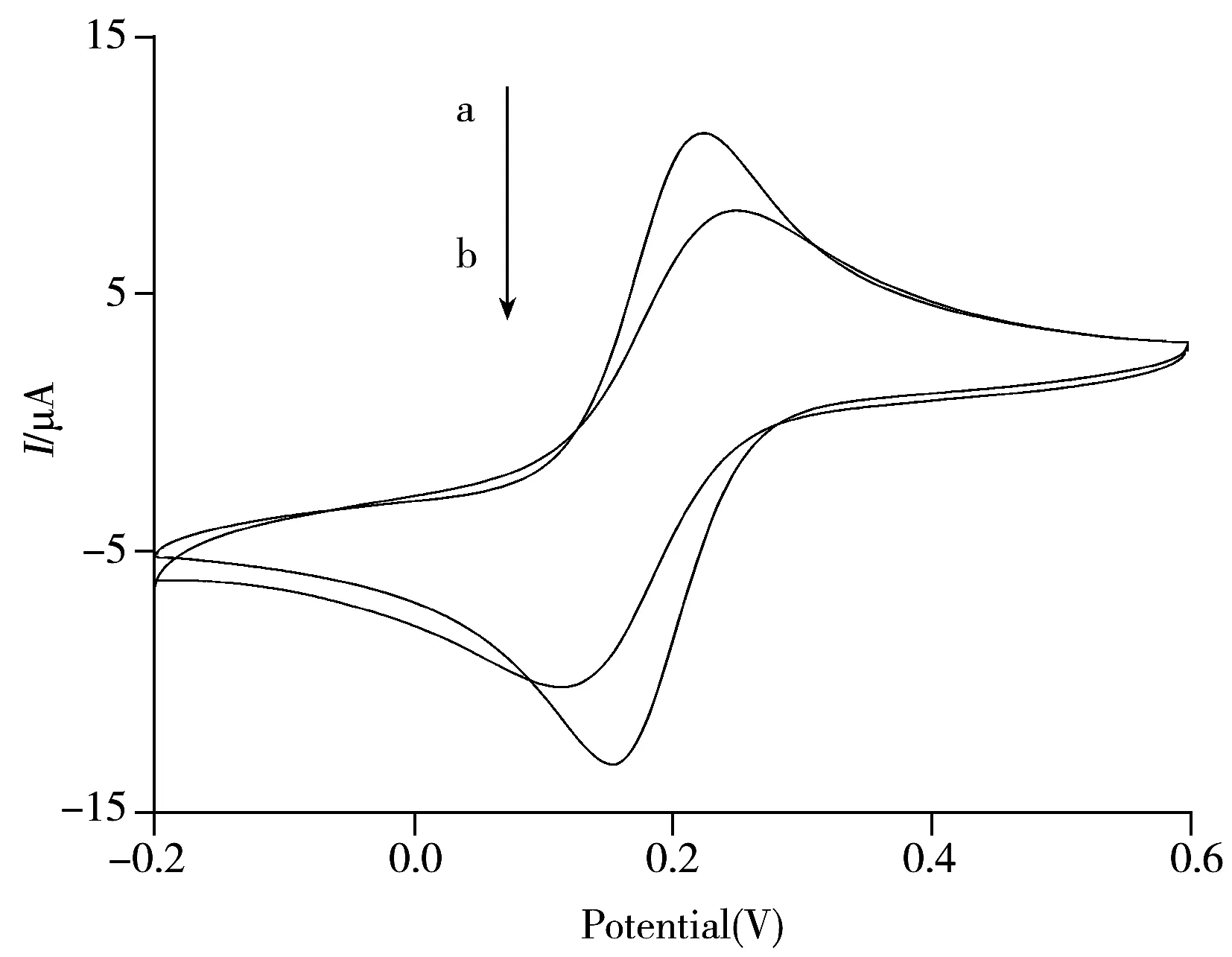
图1 裸玻碳电极(a)和蚀刻过的玻碳电极(b)的循环伏安图Fig.1 CVs of bare GCE(a) and NaOH etching GCE(b)bottom liquid:1 mmol/L K3Fe(CN)6 solution
2 结果与讨论
2.1 NaOH蚀刻玻碳电极的循环伏安曲线
分别将裸玻碳电极与经过NaOH蚀刻的玻碳电极置于铁氰化钾溶液中进行循环伏安扫描,其结果如图1所示。与裸玻碳电极相比,经过NaOH蚀刻的玻碳电极的峰电流变小,峰位差变大,表明在经过NaOH蚀刻后,玻碳电极表面形成一层羧基,由于羧基的存在增大了玻碳电极表面的电阻,降低了电子传导率,导致其峰电流变小,峰位差变大。
对玻碳电极进行NaOH蚀刻后,考察了扫描圈数对玻碳电极的影响。结果显示,在扫描圈数为1~7圈时,电流变化较大,此时,电极表面并未完全活化,羧基层正在逐步形成。继续扫描8~20圈时,扫描曲线趋于稳定,重合度较好,表明经过20圈扫描后完成了玻碳电极表面的NaOH蚀刻,在玻碳电极表面形成一层以羧基为主的官能团[3]。
2.2 扫描速率对NaOH蚀刻玻碳电极的循环伏安曲线的影响
考察了扫描速率对NaOH蚀刻后玻碳电极的循环伏安曲线的影响(图2)。结果显示,随着扫描速率的增加,玻碳电极的电化学信号产生规律性的变化。分别将氧化峰峰值电流(Ipa)与还原峰峰值电流(Ipc)进行线性拟合,结果显示,峰值电流与扫描速率呈良好的线性关系(图2插图),其中,氧化峰峰值电流拟合曲线的线性拟合方程为:Ipa=0.012 71v+1.223(r=0.997 6);还原峰峰值电流曲线线性拟合方程为:Ipc=-0.012 86v-1.651(r=0.995 5)。
由以上分析可知,NaOH蚀刻玻碳电极为典型的表面控制过程[20]。根据Laviron方程计算出电极表面官能团浓度c。计算公式如下:
Ip=nFQX/(4RT)
(1)
Q=nFAc
(2)
式中,n为电子转移数目,F为法拉第常数,Q为还原峰的积分值,X为扫描速率,R为气体摩尔常数,T为热力学温度;由上式计算出经NaOH蚀刻后的玻碳电极表面的羧基浓度约为 2.021×10-6mol/cm2。
2.3 不同组装成分的循环伏安曲线
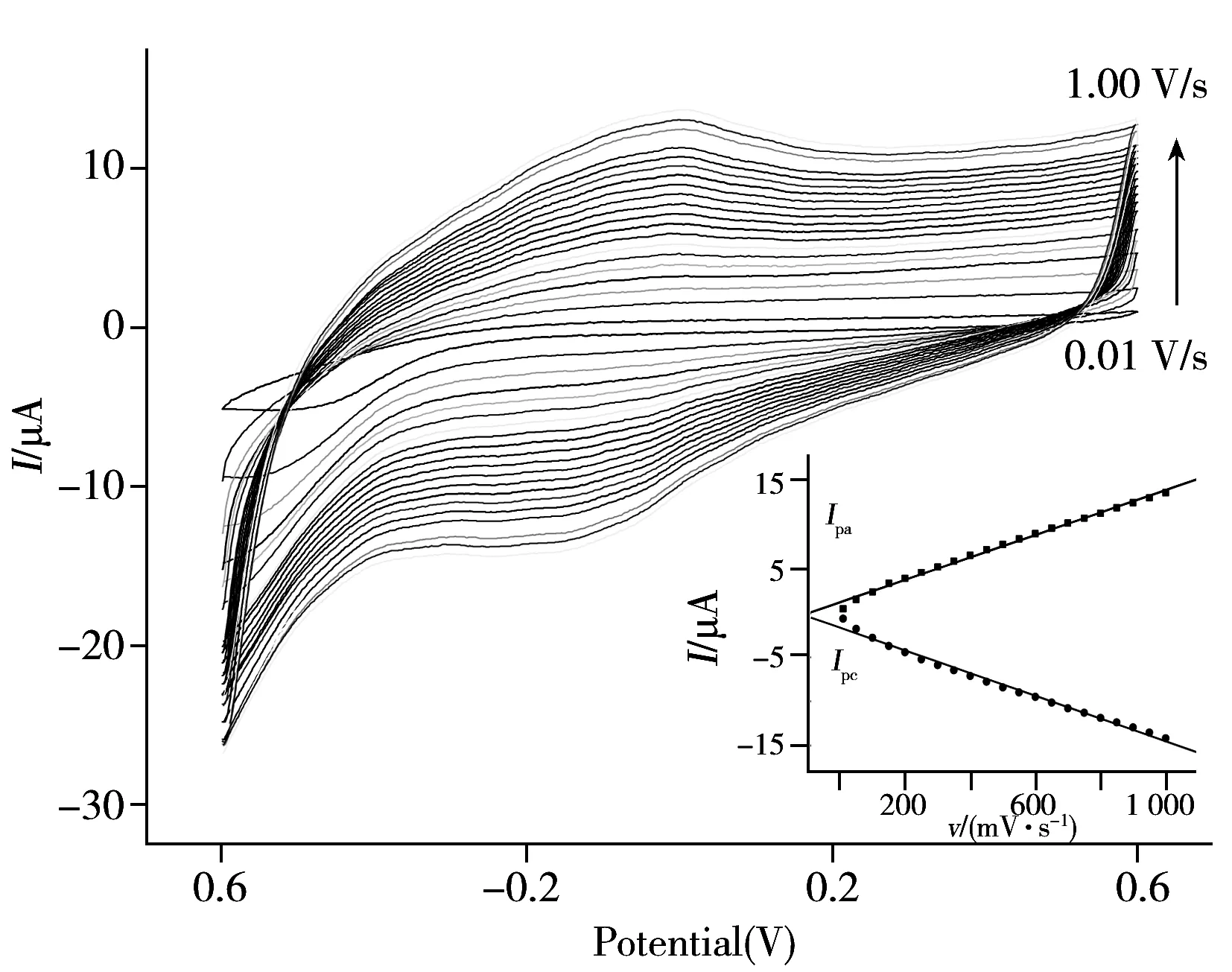
图2 电化学蚀刻后的玻碳电极在不同扫速下的循环伏安图Fig.2 CV curves of NaOH etching GCE in different scan rates bottom liquid:PBS buffer;scan range:0.01-1 V/s;inset:linear fit of electrochemical etching of glassy carbon electrode with different scan speeds of oxidation peak current(Ipa) and reduction peak current(Ipc)
考察了不同组装成分电极的循环伏安曲线(见图3)。由图3可见,对裸玻碳电极(曲线a)和组装单链DNA探针的玻碳电极(曲线b)进行循环伏安扫描时,循环伏安曲线上并无明显的氧化还原峰出现,这是因为在这两种电极表面未组装杂交指示剂MB,在杂交过后的玻碳电极表面进行MB自组装之后,在-0.249 V和-0.314 V出现了MB的氧化还原峰。以上结果表明,本实验的电化学DNA传感器成功构建,杂交指示剂MB已成功组装到杂交后的玻碳电极表面,并表现出良好的电化学氧化还原性能。
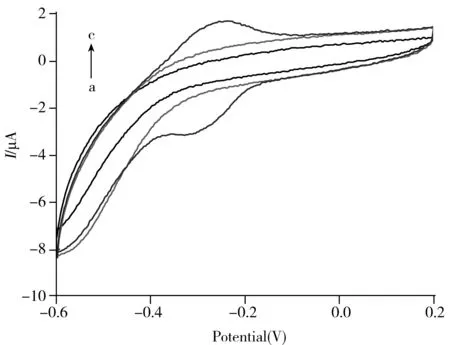
图3 电化学DNA传感器组装的循环伏安图Fig.3 CV curves of electrochemical DNA sensor scan range:-0.6-0.2 V,scan rate:50 mV/s;a.bare GCE electrode,b.bare GCE electrode with single-stranded DNA,c.bare GCE electrode with hybrid DNA

图4 电化学DNA传感器与不同DNA杂交后的差分脉冲伏安图Fig.4 DPV curves of hybridization between electrochemical DNA sensor and different DNAa.bare GCE electrode;b.bare GCE electrode with probe DNA;c.multi-base mismatch target DNA;d.two base mismatched target DNA;e.single base mismatch target DNA;f.fully complementary target DNA;bottom liquid:Tris-HCl buffer(50 nmol/L,pH=7.2);DNA hybridization solution concentration:50 nmol/L,hybridization temperature:37 ℃,hybridization time:1 h;inset:relative peak histogram
2.4 传感器的特异性检测
采用DPV法对制备的电化学生物传感器的特异性进行表征,实验结果如图4(a-f)所示。由图4可以看出,在相同的实验条件下,玻碳电极表面的探针DNA与互补的目标DNA(曲线f)进行杂交时,电化学信号最强,这是由于探针DNA与互补的目标DNA形成了完整的DNA双链结构,杂交指示剂MB能够充分嵌入DNA双链结构中,产生较强的电化学信号。当探针DNA与单碱基错配的目标DNA(曲线e)以及两碱基错配的目标DNA(曲线f)进行杂交时,由于其未形成完整的DNA双链结构,杂交指示剂MB不能充分地嵌入双链结构中,造成其电化学信号与完全互补的DNA双链结构(曲线f)相比有明显的减少。当探针DNA与多碱基错配的目标DNA(曲线c)进行杂交时,几乎未形成DNA双链结构,因此其电化学信号仅比未杂交的探针DNA(曲线b)略微增强,其原因是:在进行杂交时,微量的ssDNA通过物理作用吸附在玻碳电极表面并与杂交指示剂MB进行自组装,产生微量的电化学信号,曲线a为裸玻碳电极与探针DNA的空白试验,其信号相对强度对比如图4插图所示。以上结果表明,实验所制备的电化学DNA传感器具有良好的特异性与选择性,能够对大肠杆菌DNA进行快速的特异性检测。
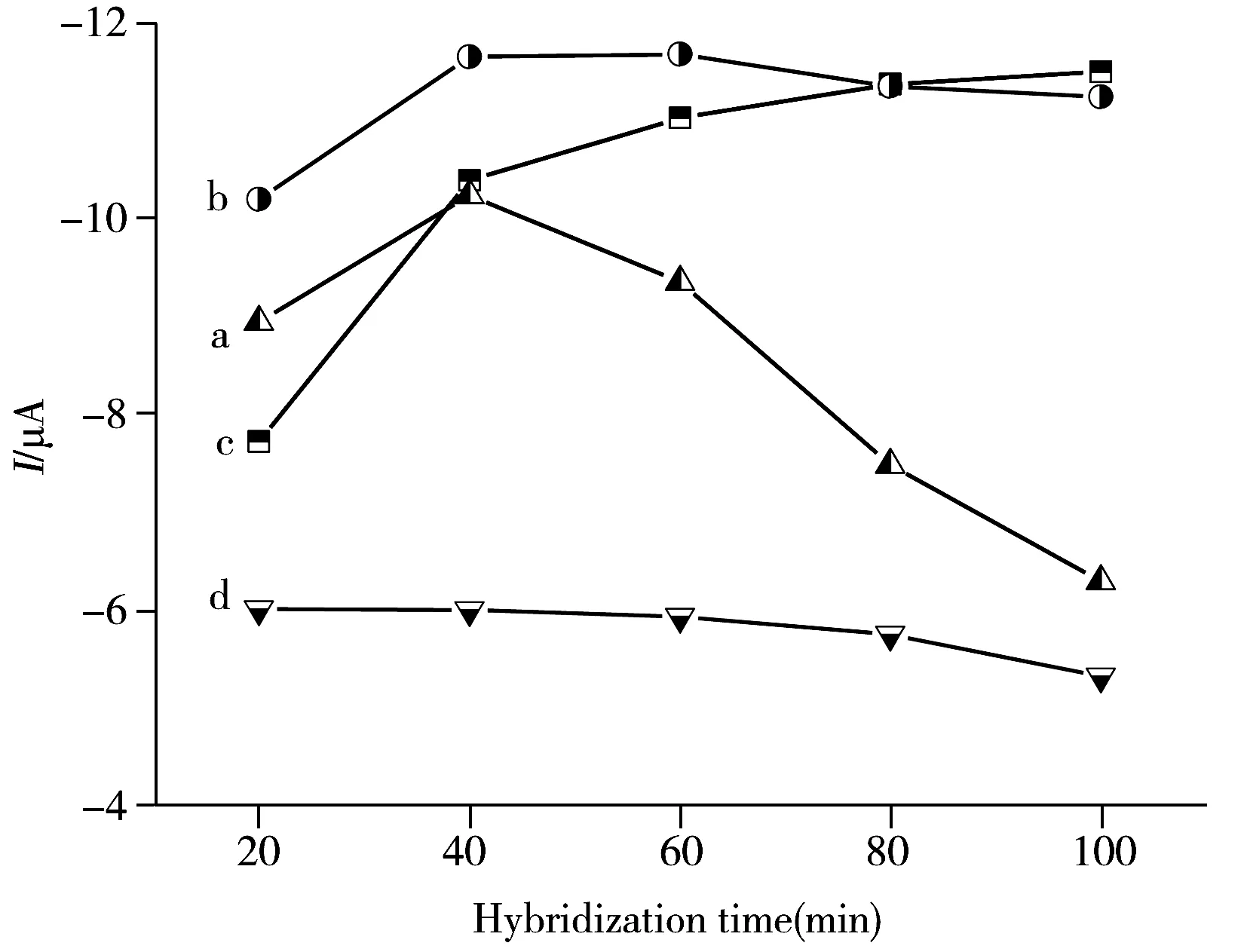
图5 不同温度条件下差分脉冲信号与不同杂交时间的关系图Fig.5 DPV curves of relationship between different temperatures and different hybridization times a.25 ℃,b.37 ℃,c.50 ℃,d.65 ℃
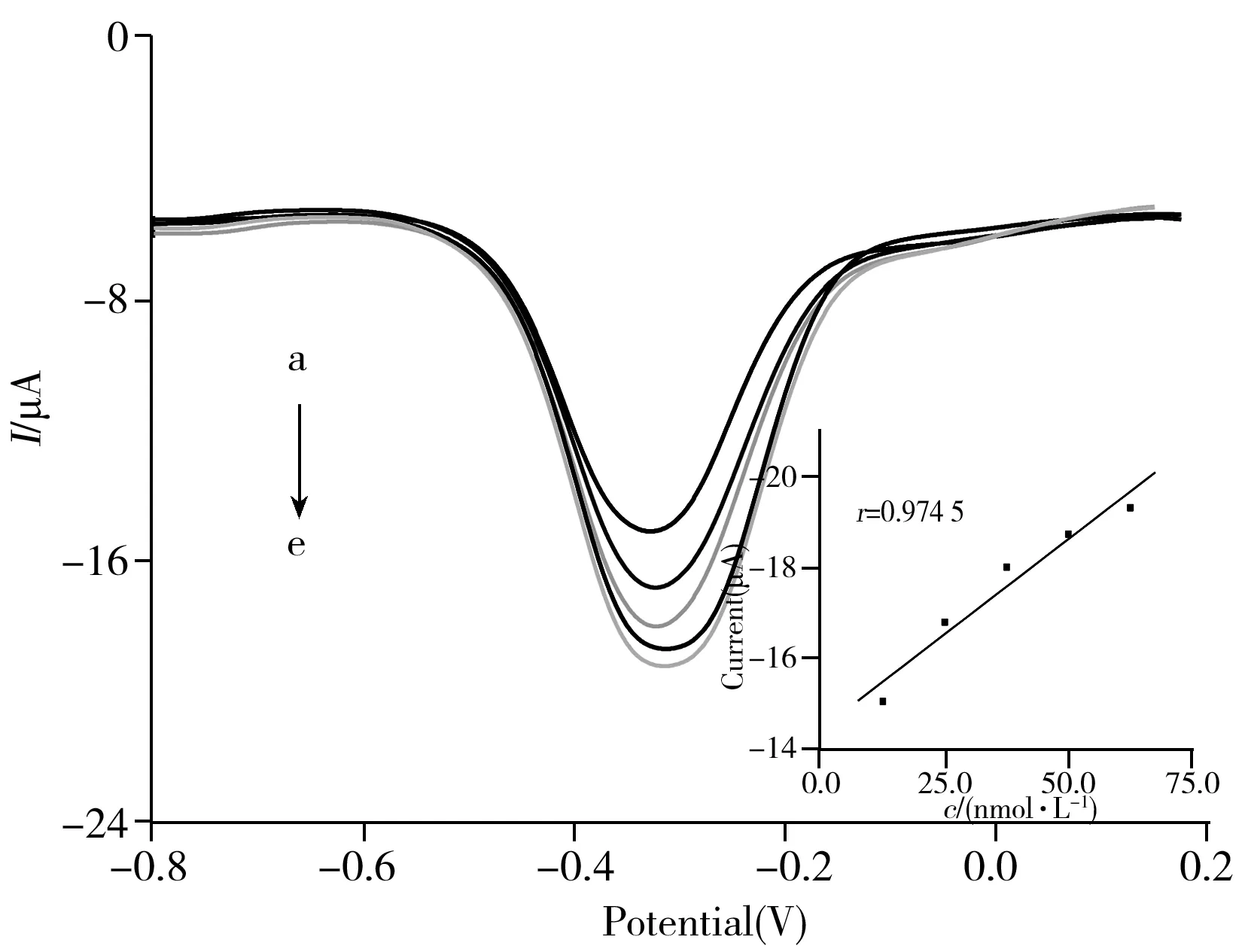
图6 电化学DNA传感器与不同浓度目标DNA杂交的差分脉冲曲线图Fig.6 DPV curves of hybridization signs between electroche-mical DNA sensor and different concentrations of target DNA concentration of target DNA(a-e):12.5,25.0,37.5,50.0,62.5 nmol/L;insert:linear relationship between concentration of target DNA and electrochemical signals
2.5 DNA杂交时间与杂交温度的优化
电化学DNA传感器的检测过程中,探针DNA与目标DNA的杂交时间与杂交温度会对差分脉冲信号具有一定影响。图5的研究结果显示,随着温度的升高,杂交时间逐渐缩短,当杂交温度达到65 ℃(曲线d)时,由于温度过高,并未出现明显的杂交现象,当杂交温度为25 ℃时,在100 min形成完整的DNA双螺旋结构,当杂交温度升至37 ℃时,在60 min形成完整的DNA双螺旋结构,当杂交温度达到50 ℃时,在40 min形成完整的DNA双螺旋结构,但由于其温度较高,形成的双螺旋结构很快遭到破坏,其电化学信号明显减少[21]。综合以上分析,实验采用37 ℃作为DNA杂交的最佳温度。
2.6 杂交指示剂MB的最佳组装时间与最佳浓度考察
考察了杂交指示剂MB的组装时间以及浓度的影响,结果显示,当探针DNA与目标DNA杂交后进行MB组装时,随着组装时间的增加,电化学信号逐渐增强,并在10 min处达到最大值,随着时间的增加,电化学信号不再出现明显的改变,因此选取10 min作为MB组装的最佳时间。在相同的实验条件下,随着MB浓度的逐渐增加,电化学信号逐渐增强,在MB浓度为6.76×10-5mol/L时达到最大值,此后随着MB浓度的增加,电化学信号无明显改变,因此选择6.76×10-5mol/L作为亚甲基蓝MB组装的最佳浓度。
2.7 电化学生物传感器的标准曲线、检出限及稳定性
考察了传感器与不同浓度目标DNA杂交的差分脉冲曲线图。结果显示,在最优实验条件下,随着目标DNA浓度的增加,电化学差分脉冲信号明显增强(图6),将不同的目标DNA浓度与电化学差分脉冲信号进行线性拟合即可得图6插图,两者具有良好的线性关系。其线性范围为12.5~62.5 nmol/L,线性拟合方程为:Ip=-14.46-0.083 03C(r=0.974 5)(式中C为目标DNA浓度,Ip为电信号值),通过对平行试验进行标准偏差分析,可以看出,在线性检测范围内本传感器具有较好的稳定性与重现性,根据3σ法,可以计算出实验制备的电化学DNA传感器的检出限为1.20×10-9mol/L。
3 结 论
本文构建了基于NaOH蚀刻玻碳电极特异性检测大肠杆菌特征序列DNA的电化学传感器,并以亚甲基蓝作为DNA杂交指示剂。对传感器的特异性,DNA杂交时间及温度,亚甲基蓝的组装时间及浓度条件进行了考察。结果显示,经NaOH蚀刻后的玻碳电极表面羧基层的存在提高了传感器的灵敏度,实现了在较短时间内对大肠杆菌特征序列DNA的特异性检测,其检出限可达1.20×10-9mol/L。
[1] Hohmann S.J.Biotechnol.,2010,150:545.
[2] Witkin E M.Bacteriolog.Rev.,1976,40(4):869-907.
[3] Zhang C,Xu S C,Zhang X P,Huang D D,Li R L,Zhao S H,Wang B.J.Electroanal.Chem.,2014,735:115-122.[4] Contag C H,Bachmann M H.Ann.Rev.Biomed.Eng.,2002,4(1):235-260.
[5] Rochelet M,Solanas S,Betelli L,Chantemesse B,Vienney F,Hartmann A.Anal.Chim.Acta,2015,892:160-166.[6] Contag C H,Bachmann M H.Ann.Rev.Biomed.Eng.,2002,4(1):235.
[7] Rompré A,Servais P,Baudart J,De-Roubin M R,Laurent P.J.Microbiol.Methods,2002,49(1):31-54.
[8] Abdel-Rahman M A,Tashiro Y,Sonomoto K.Biotechnol.Adv.,2013,31(6):877-902.
[9] Cretoiu S M,Radu B M,Banciu A.Histochemie,2015,143(1):83-94.
[10] Bracewell D G,Francis R,Smales C M.Biotechnol.Bioeng.,2015,112(9):1727-1737.
[11] Clifton-Hadley F A.Rev.Med.Microbiol.,2000,11(1):47-58.
[12] Gill R,Zayats M,Willner I.Cheminform.,2008,39(49):7602-7625.
[13] Sadik O A,Aluoch A O,Zhou A.Biosens.Bioelectron.,2009,24(9):2749-2765.
[14] Wu S Y,Rothery R A,Weiner J H.J.Biol.Chem.,2015,290(41):25164-25173.
[15] Jia F,Duan N,Wu S,Dai R,Wang Z,Li X.Microchim.Acta,2016,183(1):337-344.
[16] Karousis N,Suarez-Martinez I,Ewels C P,Tagmatarchis N.Struct.Chem.Rev.,2016,116(8):4850.
[17] Chen S J,Li F F,Zhong Y X,Wu B Y,Hu D Y,Zheng W,Zheng D Y.J.Instrum.Anal.(陈苏靖,李芳芳,钟云秀,吴白云,胡岱玉,郑伟,郑东云.分析测试学报),2015,34(9):1066-1071.
[18] Zhou J,Yang Y,Zhang C Y.Chem.Rev.,2015,115(21):11669.
[19] Zhao W W,Xu J J,Chen H Y.Chem.Rev.,2014,114(15):7421-7441.
[20] Lan D X,Zhang L.J.Instrum.Anal.(兰德香,张雷.分析测试学报),2015,34(12):1339-1347.
[21] Zajda J,Górski,Malinowska E.Bioelectrochemistry,2016,109:63-69.
Preparation of an Electrochemical Biosensor Based on Sodium Hydroxide Etching Glassy Carbon Electrode and Its Detection on E.coli
XU Shi-chao1,2*,WEN Jun-nan1,JIANG Nan1,LI Jiao1,WANG Cai-fu1,DONG Kai1,ZHANG Yi-yi1
( 1.Environmental and Chemical Engineering,Tianjin Polytechnic University,Tianjin 300387,China;2.The State Key Laboratory of Hollow Fiber Membrane Materials and Membrane Processes,Tianjin Polytechnic University,Tianjin 300387,China)
A high sensitive and selective electrochemical DNA sensor for E.coli was prepared by using NaOH etched glassy carbon electrode(GCE) as the substrate.Carboxyl was brought to the surface of GCE via NaOH etching,which improved DNA probes surface density.DNA probes was immobilized on the surface of GCE through the peptide bond.The sensitivity and selectivity of the sensor were characterized by cyclic voltammetry(CV) and differential pulse voltammetric(DPV) methods.The sensor shows a high sensitive and selective response to ssDNA of E.coli,and its linear range was 12.5-62.5 nmol/L with a detection limit of 1.20×10-9mol/L.
E.coli;NaOH etching;electrochemical biosensor
10.3969/j.issn.1004-4957.2017.04.020
2016-08-31;
2016-12-20
O657.1;Q523
A
1004-4957(2017)04-0555-05
*通讯作者:许世超,副教授,研究方向: 电化学生物传感及纳米催化材料,Tel:022-83955112,E-mail:xushichao@tjpu.edu.cn

