盐胁迫下丛枝菌根真菌(AMF)对尖瓣海莲幼苗生物量变化的影响
苗启晨,张晓楠,张世杰,张 颖,严廷良
(1.海南师范大学 生命科学学院,海南 海口 571158;2.中国热带农业科学院环境与植物保护研究所,海南 海口 571101)
盐胁迫下丛枝菌根真菌(AMF)对尖瓣海莲幼苗生物量变化的影响
苗启晨1,张晓楠1,张世杰1,张 颖1,严廷良2*
(1.海南师范大学 生命科学学院,海南 海口 571158;2.中国热带农业科学院环境与植物保护研究所,海南 海口 571101)
采用盆栽受控试验法,研究NaCl胁迫条件下丛枝菌根真菌(arbuscular mycorrhizal fun⁃gi,AMF)对尖瓣海莲(Bruguiera sexangulavar.rhynchopetala)幼苗生物量变化的影响.研究结果表明:随着盐浓度的增加,AMF能增加尖瓣海莲幼苗植株的叶面积和平均生物量、提高株高增长率和直径增长率;在高盐环境下,AMF能有效缓解盐害对尖瓣海莲造成的不利影响.
丛枝菌根真菌;尖瓣海莲;盐胁迫
长期生长于盐渍环境下的植物会不同程度地受到盐分胁迫的影响,绝大多数植物的生长和发育都会受到明显抑制,常表现为植物整株水平上生长速率的降低,叶片受损和根冠比增加等现象[1].植物盐胁迫毒害机理的相关研究表明,高盐度抑制植物生长发育的原因主要是渗透胁迫和离子胁迫两个方面[1-2].高盐环境会使植物细胞内介质的水势下降,水分的有效性明显降低,造成植物对水分吸收的困难,进而对植物细胞内形成渗透胁迫,引起植株的茎和部分根的生长受到抑制[3-4].很多研究还表明生长在逆境中的植物,一般具有对生物量分配模式可塑性的适应对策[5-6],植物生物量分配模式自我调节的变化趋势,往往符合植物生长最优分配理论的预测[6].
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)能与植物根系形成共生体,对植物的生长起到一定的影响.接种AMF后的最直观效应就是能提高苗木移栽成活率、促进生长发育、增加产量等[7].尖瓣海莲(Bru⁃guiera sexangulavar.rhynchopetala)属于红树科木榄属,常绿乔木,天然分布于海南岛东海岸、东寨港、清澜港等地.目前,研究学者们已在尖瓣海莲的分子分类、遗传变异、化学成分、潮汐淹浸适应、盐度胁迫及其内生菌等方面做了少量研究[8-12],但盐胁迫下丛枝菌根真菌(AMF)对尖瓣海莲幼苗生物量变化的影响还未见相关报道.为了探讨盐胁迫下AMF对红树植物各部分生物量累积和分配的影响,本实验以尖瓣海莲幼苗为研究对象,通过测定其直径增长率、株高增长率、叶面积、根冠比和生物量的变化情况,观察AMF对尖瓣海莲幼苗在盐生境下的生长的影响,为今后AMF影响红树植物生长的相关研究提供理论基础.
1 实验材料和方法
1.1 实验材料
(1)从海南东寨港红树林采集红树植物的细根和根际土壤,用样品袋密封保存带回实验室,并在24 h之内对样品进行前处理.
(2)从海南东寨港自然保护区采集红树植物尖瓣海莲的胚轴备用.
1.2 实验方法
1.2.1 AMF的取得
将采集到的红树植物的根样用蒸馏水冲洗、洗净,FAA固定保存.选择合适的根部,剪成约1 cm的根段,放入质量分数为8%的KOH溶液的锥形瓶中,90℃水浴40 min,再加入2%HCl溶液酸化5 min,然后用0.01%酸性品红乳酸甘油染色液在90℃水浴中染色约40 min,用水分色;挑取30条根段整齐摆放于载玻片上,滴加乳酸甘油,盖上盖玻片并小心压片.在显微镜下观察根段AMF侵染的情况,计算感染率.将感染率达80%以上的根段剪碎保留[13].
1.2.2 尖瓣海莲幼苗的培育和AMF对其幼苗的侵染
将尖瓣海莲的胚轴洗干净后插入矿泉水中进行培养,每7 d更换培养液一次,待胚轴长出4片真叶后将小苗移到高温高压灭菌过的河沙和矿泉水混合基质中进行培养,采用根段侵染法将已充分形成菌根的根剪成1 cm左右的根段,每盆培养沙内接种0.5 g新鲜根段,将含有AMF的根段埋于培养沙里时,AMF会通过转移而对尖瓣海莲幼苗根系进行侵染.经过一段时间后的培养,取尖瓣海莲幼苗部分根段在显微镜下观察菌根侵染情况.
1.2.3 不同浓度的Nacl溶液对尖瓣海莲幼苗的胁迫处理
AMF对尖瓣海莲侵染成功后,将其移栽到高温高压灭菌过的河沙中进行培养,一周后开始进行不同浓度的Nacl溶液胁迫处理,实验分为AMF侵染组(AM)和无AMF侵染组(NAM)两组,每组分别浇灌不同浓度的Nacl溶液,每个浓度为15棵苗,NaCl溶液的质量分数设为0、10‰、20‰、30‰四个梯度,每3 d浇灌一次,胁迫时间为90 d.
1.2.4 盐胁迫下AMF对尖瓣海莲幼苗生物量的测定方法
在胁迫之前测量每株幼苗的株高、直径和叶面积,胁迫结束后再次测量每株幼苗的株高、直径和叶面积.测量完毕后,将不同处理组的幼苗分成地上部分和地下部分,65℃烘干至恒重(前后两次质量差小于2 mg),分别计算地上部分和地下部分个体平均生物量(干重),求根冠比值并作图分析.

1.2.5 数据分析
实验数据采用SPSS13.0进行差异显著性分析和相关性分析,采用Excel 2003进行图表绘制.
2 实验结果与分析
2.1 Nacl胁迫下AMF对尖瓣海莲幼苗株高增长率的影响
如图1所示,不同浓度的NaCl溶液胁迫下,AMF侵染组(AM)和无AMF侵染组(NAM)的尖瓣海莲幼苗株高生长率变化趋势为:随着NaCl溶液浓度的升高,NAM组的平均株高增长率均呈下降趋势,且下降趋势较大.相对于NAM组,AM组的平均株高增长率表现为先微上升再逐渐下降的趋势,下降趋势不显著.
2.2 NaCl胁迫下AMF对尖瓣海莲幼苗直径增长率的影响
如图2所示,在AMF侵染组(AM)和无AMF侵染组(NAM)两种不同处理下,随着NaCl溶液浓度的升高,尖瓣海莲幼苗平均直径增长率均呈“上升—下降”趋势,在10‰时达到最高.AM组的各处理之间差异不显著.NAM组的30‰时的幼苗平均直径增长率均与其他处理组差异显著(P<0.05).每个浓度处理组下,AM组直径增长率均高于NAM组,且在10‰、20‰和30‰浓度处理下均差异显著(P<0.05).
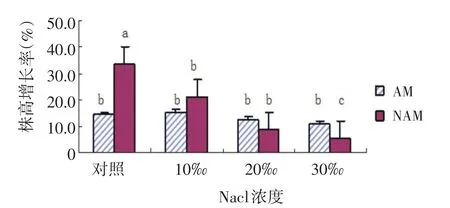
图1 尖瓣海莲幼苗平均株高增长率的变化Fig.1 Changes of the average plant height growth rate ofBruguiera Sexangulavar.Rhynchopetalaseedlings
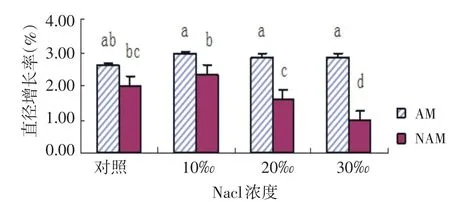
图2 尖瓣海莲幼苗平均直径生长率的变化Fig.2 Changes of the average diameter growth rate ofBruguiera Sexangulavar.Rhynchopetalaseedlings
2.3 NaCl胁迫下AMF对尖瓣海莲幼苗叶面积的影响
在AMF侵染组(AM)和无AMF侵染组(NAM)两种不同处理下,随着NaCl溶液浓度的增加,叶面积的变化均呈“上升-下降”的趋势,在10‰时达到最大值,且均与其他浓度组差异显著(P<0.05).NAM组在30‰时与其他处理差异显著(P<0.05).每个浓度的处理下,AM侵染组均比NAM组的叶面积大,且均达到显著差异水平(P<0.05)(见图3).
2.4 NaCl胁迫下AMF对尖瓣海莲幼苗平均生物量的影响
与直径增长率和叶面积变化趋势相同,在两种不同处理下,随着NaCl溶液浓度的增加,平均生物量的变化也是呈先升高后下降的趋势,且均在质量分数为10‰的NaCl溶液时生物量积累达到最大值,质量分数为30‰的NaCl溶液时达到最小值,且与其他浓度组有着显著差异(P<0.05).在20‰和30‰的NaCl溶液时,AM组的生物量显著高于NAM组,且差异显著(P<0.05)(见图4).
2.5 NaCl胁迫下AMF对尖瓣海莲幼苗地上生物量的影响
在两种不同处理下,随着NaCl溶液浓度的增加,NAM组的平均地上生物量的变化呈“上升-下降”的趋势,在质量分数为10‰的NaCl溶液时达到最大值;而AM组的平均地上生物量却随着NaCl溶液浓度的增加而逐渐下降;二者的在对照组和10‰浓度组的平均地上生物量均与20‰和30‰浓度组差异显著(P<0.05).在对照组和10‰浓度时,AMF对地上生物量的生长影响无显著差异;在10‰浓度处理组中AM组地上生物量低于NAM组,但无显著差异;在30‰处理时,AM组地上生物量显著高于NAM组,且达到P<0.05的显著水平(见图5).

图3 尖瓣海莲幼苗平均叶面积生长的变化情况Fig.3 Changes of the average leaf area growth ofBruguiera Sexangulavar.Rhynchopetalaseedlings
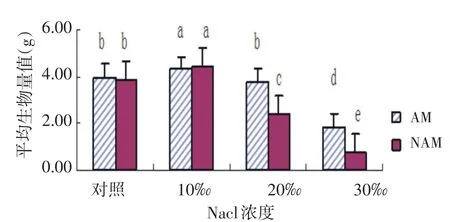
图4 尖瓣海莲幼苗平均生物量变化情况Fig.4 Changes of the average biomass ofBruguiera Sexangulavar.Rhynchopetalaseedlings
2.6 NaCl胁迫下AMF对尖瓣海莲幼苗地下生物量的影响
如图6所示,在两种不同处理下,随着NaCl浓度的增加,平均地下生物量的变化都是呈“升高-下降”的趋势,在10‰浓度时,两种处理的地下生物量均达到最大值,且与其他浓度差异显著(P<0.05).在对照、10‰、20‰浓度处理组中,AM组地下生物量均高于NAM组,但无显著差异性.而在30‰浓度处理时,AM组显著低于NAM组并且有显著差异(P<0.05).
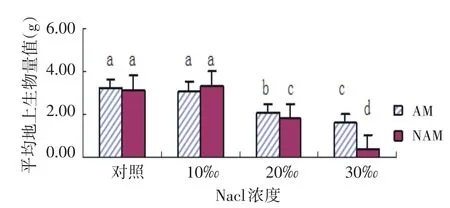
图5 尖瓣海莲幼苗地上生物量变化情况Fig.5Changes of the average above-ground biomass ofBruguiera Sexangulavar.Rhynchopetalaseedlings
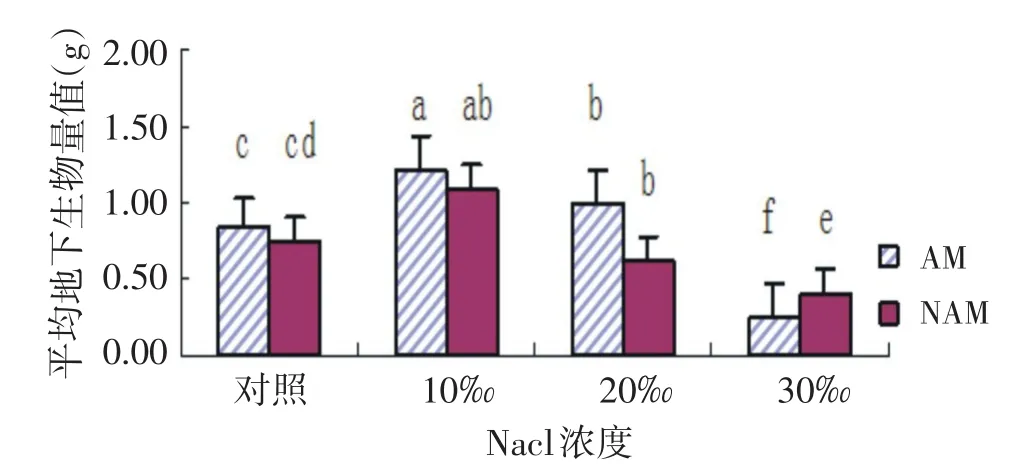
图6 尖瓣海莲幼苗地下生物量变化情况Fig.6Changes of the average underground biomass ofBruguiera Sexangulavar.Rhynchopetalaseedlings
2.7 NaCl胁迫下AMF对尖瓣海莲幼苗根冠比值的影响
盐胁迫下,AM组随着盐浓度的增加呈现先升高后下降的趋势,并在20‰浓度时根冠比值最高,30‰浓度时根冠比值显著低于其他浓度(P<0.05).而在NAM组,随着盐浓度的增高,根冠比值呈不断升高的趋势,在最高盐度30‰时达到最大值,与其他浓度差异显著(P<0.05),并且是AM组的6倍左右,显著性差异(P<0.05)(见图7).

图7 尖瓣海莲幼苗根冠比变化情况Fig.7 Changes of Root-shoot ratio ofBruguiera Sexangulavar.Rhynchopetalaseedlings
3 结论与讨论
研究者以不同种植物为研究对象,研究了AMF对寄主植物的促生作用,发现AMF对盐生和非盐生植物均能促进其生长,比如,AMF能促进盐生植物盐苑(Aster.tripoliam)叶片的伸长,提高其耐盐能力[13];对非盐生植物如黄瓜的盐胁迫实验也表明AMF能提高盐胁迫下植株的耐盐性并促进其叶片及根部的生长[14].AMF能促进盐渍土壤中植物的生长,增加叶片叶面积和叶绿素含量,提高植株地上部分及地下部分干物质产量,已得到了很多研究结果的证实[14-18].Mass E V在对阔叶树种苗木的研究试验中证实了AMF能增加盐渍土阔叶树种苗木的生长量[19],Weissenhorn I对果树的研究中发现AMF能提高果树的光合能力,增强其耐盐性.本实验的研究结果显示,在盐胁迫下,AMF均能增加尖瓣海莲幼苗植株的叶面积、直径生长率和平均生物量,这和上述众多实验结果是一致的.在对照组和较低盐度(10‰)时,NAM组植株株高生长率高于AM组,在高盐度(20‰和30‰)时AM组高于NAM组,30‰的盐度是较接近海水的盐度,表明在接近海水盐度情况下,AMF有利于提高尖瓣海莲植株的株高生长率.
同时,盐碱的环境条件对生物量及其向不同器官分配比例的变化也说明了其对生态环境的适应能力.在高盐度下,NAM组地下生物量分配增加,根冠比明显增大,地下生物量增加有利于积累光合产物,地上生物量减少有利于减少水分的丢失,这些变化的特征说明了在盐胁迫下,幼苗对环境非常敏感,植株已受到严重的盐胁迫.而AM组随着盐度的增加呈现出先升高后下降的趋势.本研究表明AMF不仅对尖瓣海莲的生长具有非常明显的促进作用,而且还可以增强其抗盐能力.因此我们推断AMF可能在红树林湿地生态系统中同样具有重要的生态功能,未来可以对红树林生态系统开展系统的AMF菌种资源研究,筛选具有耐淹、耐盐以及高效促生作用的AMF菌种资源,广泛用于农作物增产、环境治理、红树林的生态恢复等方面.
[1]Polidoro B A,Greenway H,Munns R.Mechanisms of salt tolerance in nonhalophytes[J].Annual review of physiology,1980,31:149-190.
[2]Munns R,Guo J,Passioura J B,et al.Leaf water status controls day-time but not daily rates of leaf expansion in salt-treated barley [J].Australian Journal of Plant Physiology,2000,27:949-957.
[3]Munns R,Termaat A.Whole-plant responses to salinity[J].Australian Journal of Plant Physiology,1986,13:143-160.
[4]Munns R.Comparative physiology of salt and water stress[J].Plant Cell and Environment,2002,25:239-250.
[5]潘晓玲,马映军,高炜,等.中国西部干旱区生态环境演变过程[J].中国沙漠,2004,24(6):663-673.
[6]Rawson H M,Turner N C,Begg J E.Agronomic and physiological responses of soybean and sorghow crops to water deficits.Ⅳ. Photosynthesis,transpiration and water use efficiency of leaves[J].Australian Journal of Plant Physiology,1978,5:195-209.
[7]刘润进,陈应龙.菌根学[M].北京:科学出版社,2007.
[8]王宇涛.珠江河口红树林生境AMF群落多样性及其环境响应[D].广州:中山大学,2011.
[9]周涵涛,林鹏,孙晟.福建九龙江口红树植物分子分类的研究[J].海洋科学,2001,25(8):42-46.
[10]潘文,周涵韬,陈攀,等.木榄属3种红树植物的遗传变异和亲缘关系分析[J].海洋科学,2005,29(5):23-28.
[11]包淑云,林文翰.红树植物尖瓣海莲的化学成分研究[J].中国中药杂志,2006,31(14):1168-1171.
[12]廖宝文,邱凤英,张留恩,等.盐度对尖瓣海莲幼苗生长及其生理生态特性的影响[J].生态学报,2010,30(33):6663-6371.
[13]Biermann B J,Linderman R G.Quantifying vesieular-arbuseular myeorrhizal:a proposed method towards standardization[J]. New Phytologist,1981,87:63-67.
[14]韩冰,郭世荣,贺超兴,等.丛枝菌根真菌对盐胁迫下黄瓜植株生长、果实产量和品质的影响[J].应用生态学报,2012,23(1):154-158.
[15]Mass E V.Salt tolerance of plants[J].Applied Agricultural Research,1986,1:12-26.
[16]李敏,辛华,郭绍霞,等.丛枝菌根真菌对盐渍土中番茄和辣椒生长及矿质元素吸收的影响[J].莱阳农学院学报,2005,22(1):38-41.
[17]Kaya C,Higgs D,Kirnak H,et al.Mycorrhizal colonization improves fruit yield and water use defficiency in water melon (Citrullus lanatus Thunb)grown under well-watered and water-stressed conditions[J].Plant and Soil,2003,253(2):287-292.
[18]Duke E R,Johnson C R,Koch K E.Accumulation of phosphorus,dry matter and betaine during NaCl stress of split-root cirtus seedlings colonized with vesicular-arbuscular mycorrhizal fungi on zero,one or two halves[J].New Phytologist,1986,104:583-590.
[19]Weissenhorn I,Floris P,Nederland B.Mycorrhiza and Salt Tolerance of Trees:EU project Mycorem QLK3-1999-00097:Sci⁃entific Report[R].2002.
责任编辑:刘 红
Effects ofArbuscular mycorrhizal fungi(AMF)on Biomass Changes ofBruguiera sexangulavar.rhynchopetalaSeedlings Under Salt Stress
MIAO Qichen1,ZHANG Xiaonan1,ZHANG Shijie1,ZHANG Ying1,YAN Tingliang2*
(1.School of Life Science,Hainan Normal University,Haikou571158,China;2.Chinese Academy of Tropical Agricultural Sciences Environment and Plant Protection Institute,Haikou571101,China)
Under salt stress compared with ordinary cultivation,the effects of inoculatingarbuscular mycorrhizal fungi(AMF)on the changes of plant biomass inBruguiera sexangulavar.rhynchopetalaseedlings were studied by adopting me⁃socosm experiment.The results show that AMF can increase the seedlings’leaf area,plant height growth rate,diameter growth rate and the average biomass with the increasing of the salt stress degree,and the AMF infection group could relieve the adverse effects on the plants effectively.
arbuscular mycorrhizal fungi;Bruguiera sexangulavar.rhynchopetala;salt stress
Q 948
A
1674-4942(2017)01-0014-05
2016-10-12
国家自然科学基金(31360173);有害生物控制与资源利用国家重点实验室2015开放课题(SKLBC15KF06);GEF海南省湿地保护体系项目
*通讯作者:严廷良,硕士,E-mail:912069732@qq.com
10.12051/j.issn.1674-4942.2017.01.003

