高血压合并糖尿病与老年人认知功能的关系
郭 琼,张建起,石 蕊
(武警后勤学院附属医院心血管内科,天津 300162)
轻度认知障碍(mild cognitive impairment,MCI)是一种介于正常衰老和痴呆的中间状态[1],部分MCI人群将发展成阿尔兹海默病(Alzheimer’s disease,AD),给家庭和社会带来沉重负担。高血压和糖尿病(diabetes mellitus,DM)是老龄人口的常见多发病,两者均是认知功能减退的危险因素。目前国内外研究大多关注高血压或DM对老年人认知功能减退的影响,而对同时合并此两种疾病对老年人认知功能的影响相关报道较少。本研究旨在讨论高血压合并DM与老年人认知功能减退的关系。
1 对象与方法
1.1 研究对象
选取2015年6月至2016年6月期间在武警后勤学院附属医院心血管内科诊治的60~80岁患者129例。入选标准:(1)原发性高血压和(或)2型DM;(2)头部核磁共振检查无明确脑梗死及广泛脑白质脱髓鞘;(3)配合认知功能评估;(4)签署知情同意书。排除标准:(1)继发性高血压;(2)存在可导致认知功能障碍的其他脑部疾病(如颅内占位、多系统萎缩、帕金森病、多发性硬化、额颞叶痴呆等)及全身疾病;(3)严重颅内外血管狭窄(狭窄率>50%);(4)脑卒中病史;(5)合并严重全身疾病(如心功能不全、肾功能不全、呼吸衰竭等);(6)严重听力、视力障碍或肢体残疾。根据合并高血压和DM情况分为3组:单纯高血压组(n=59)、单纯DM组(n=30)和高血压+DM组(n=40)。
1.2 方法
收集患者资料包括年龄、性别、身高、体质量、受教育年限、独居情况、吸烟史、饮酒史、痴呆家族史、高血压病家族史、糖尿病家族史和脑卒中家族史;计算体质量指数;测量收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)及血脂水平。
对所有入组者行简易精神状况检查量表(mini-mental state examination,MMSE)和蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)评估。认知功能减退标准:MMSE得分文盲≤19分、小学文化程度≤22分、初中及以上程度≤26分;或MoCA得分<26 分(受教育年限<12年者加1分)。
1.3 统计学处理

2 结 果
2.1 一般资料比较
与单纯DM组相比,单纯高血压组和高血压+DM组患者的SBP、DBP、高血压病程和有高血压家族史者显著增加;与单纯高血压组相比,单纯DM组和高血压+DM组患者的FPG、HbA1c、糖尿病病程和有糖尿病家族史者显著增加(P<0.05;表1)。
2.2 各组认知功能比较
与单纯高血压组和单纯DM组相比,高血压+DM组患者的MMSE和MoCA评分显著降低,且MCI发生率显著增高,差异均具有统计学意义(P<0.05;表2)。
2.3 MCI组与非MCI组患者资料比较
依据MoCA评分结果将所有患者分为两组:MCI组(n=48)与非MCI组(n=81)。两组患者的年龄、受教育年限、独居情况、SBP、HbA1c、高血压病史、糖尿病病史和痴呆家族史间的差异具有统计学意义(P<0.05;表3)。

表1 各组患者基线资料比较Table 1 Comparison of baseline data among groups
DM: diabetes mellitus; BMI: body mass index; SBP: systolic blood pressure; DBP: diastolic blood pressure; FPG: fasting plasma glucose; HbA1c: glycosylated hemoglobin; TG: triglycerides; TC: total cholesterol; HDL-C: high-density lipoprotein cholesterol; LDL-C: low-density lipoprotein cholesterol. Compared with hypertension group,*P<0.05,**P<0.01; compared with DM group,△P<0.05
2.4 多因素分析
以是否存在MCI为因变量,以年龄、受教育年限、SBP、HbA1c、高血压病程、糖尿病病程、独居情况和痴呆家族史为自变量,采用向前逐步法进行非条件 logistic回归,回归方程为:Y=-17.714+0.144X1-0.190X2+1.076X3+1.103X4+1.245X5+1.090X6(X1为年龄,X2为受教育年限,X3为HbA1c,X4为高血压病程,X5为独居情况,X6为痴呆家族史)。结果显示:年龄、HbA1c、高血压病程、独居、痴呆家族史是认知功能减退的危险因素(P<0.05),受教育年限是认知功能减退的保护因素(P<0.05;表4)。
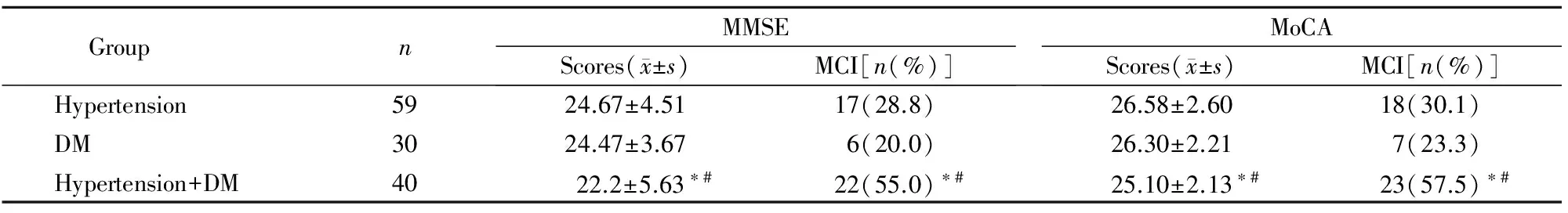
表2 各组患者认知功能比较Table 2 Comparison of cognitive function among groups
DM: diabetes mellitus; MMSE: mini-mental state examination; MoCA: Montreal cognitive assessment; MCI: mild cognitive impairment. Compared with hypertension group,*P<0.05; compared with DM group,#P<0.05
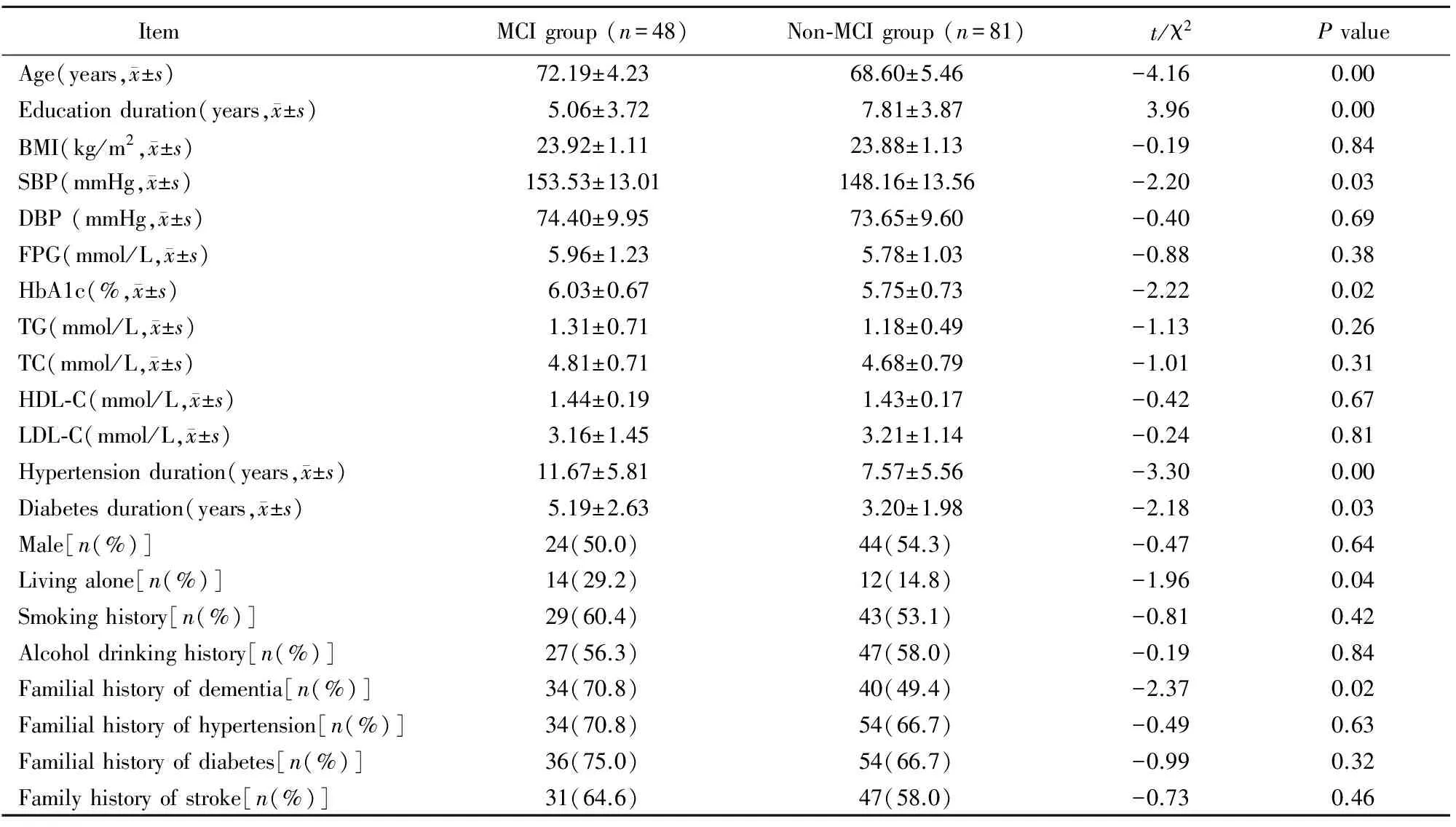
表3 MIC组与非MIC组患者一般资料比较Table 3 Comparison of baseline data between MCI group and non-MCI group
MCI: mild cognitive impairment group; BMI: body mass index; SBP: systolic blood pressure; DBP: diastolic blood pressure; FPG: fasting plasma glucose; HbA1c: glycosylated hemoglobin; TG: triglycerides; TC: total cholesterol; HDL-C: high-density lipoprotein cholesterol; LDL-C: low-density lipoprotein cholesterol

表4 MCI的logistic回归分析Table 4 Logistic regression analysis for MCI
HbA1c: glycosylated hemoglobin
3 讨 论
认知功能是大脑皮层高级神经活动的重要内容,是个体在觉醒状态下认识和理解事物的心理过程,是与外界沟通的必要能力[1]。MCI是指患者出现轻度记忆或认知障碍,但不足以诊断为痴呆的临床现象,是介于正常衰老与痴呆之间的过渡状态。MCI患者每年将有5%~25%进展成AD,给家庭和社会带来沉重负担。如能通过筛查鉴别MCI人群,在早期采取干预措施,延缓其发生发展,无论从经济学或是社会学角度都将有重大意义。 因MCI表现无特殊性,诊断多借助于各种神经心理量表,常用的量表包括MMSE、MoCA等。MMSE汉化程度高、可操作性及接受程度好,但反映功能进展方面逊色于MoCA。而MoCA与理论依据和临床研究的相关性好,但耗时长、测试项目难度高、临床可操作性较差。在本研究操作过程中,MoCA较MMSE更为敏感,筛选出MCI人数较MMSE多,但操作难度相对较大,MMSE则耗时短,更适合门诊随访患者的快速评测。
目前已知的认知功能障碍危险因素包括人口学因素(年龄、性别、家族史等)、遗传学因素(载脂蛋白E4、早老素1、早老素2、tau蛋白、β淀粉样肽前体等)、生活方式(吸烟、不合理饮食、缺乏锻炼及社会退缩等)、个人史(教育水平低下、头部创伤、精神疾病等)及血管性疾病(高血压、糖尿病等)[2]。横断面研究发现[3],高血压引起认知功能损害主要表现为注意力、记忆、定向力、执行功能及交流障碍等;DM患者则主要表现为空间执行功能、学习、记忆能力受损。 在本研究中,MCI组较非MCI组的年龄更大、受教育年限更短、独居人数更多,并有更高的SBP、HbA1c、痴呆家族史及更长的高血压、糖尿病病程,进一步对MCI进行回归分析后,发现年龄、HbA1c、高血压病程、独居、痴呆家族史是认知功能减退的危险因素,受教育年限是认知功能减退的保护因素,这与国内外报道一致。
高血压导致认知功能减退的机制包括以下几种假设。(1)动脉粥样硬化。多用脉压和脉搏波传导速度进行评估,有研究报道以上指标增高与语言学习、非语言性记忆、工作记忆及认知测评得分降低有关,这是对此理论的佐证之一[4]。(2)自主神经调节功能失衡使得血压正常昼夜节律减弱或消失。夜间血压非生理性下降引起压力负荷对脑血管造成损害,促使脑小血管病变或增加脑大血管事件发生率,影响认知功能[5-9]。(3)高血压患者脑血流量下降,导致组织缺血缺氧。而脑组织中神经元能量储备极少,对缺血缺氧敏感,造成认知功能减退[10,11]。(4)长期高血压可导致脑白质小动脉结构改变,损害脑白质,破坏皮质和皮质下联系结构,导致大脑各功能区联系中断,认知功能信息传递受影响[12,13]。
DM造成中枢神经系统损害的机制包括以下几种假设。(1)长期神经元细胞内的葡萄糖浓度升高,引起糖基化产物堆积,蛋白质交联,促进脑动脉血管壁硬化并抑制抗氧化物合成,引起血管内皮系统损伤,进而导致神经元细胞外基质结构异常。(2)葡萄糖浓度升高使得山梨醇旁路途径增加,其代谢产物增多会增加神经元细胞的渗透性,导致氧自由基增多,对神经元细胞产生损害。(3)通过增强蛋白激酶途径使葡萄糖浓度升高,使神经元细胞外基质的组蛋白基因发生改变,从基因水平对神经元细胞功能产生影响[14]。(4)DM个体胰岛素敏感性下降,脑内胰岛素受体功能紊乱影响葡萄糖代谢。同时,胰岛素是神经细胞的一种营养因子,长期严重不足会导致神经元退行性变[15,16]。
本研究发现,与单纯高血压组和单纯DM组相比,高血压+DM组患者的MCI发病率更高、减退程度更为明显。其可能机制在于:高血压和DM均对脑血管有一定损害,两者在加重血管动脉粥样硬化、损伤血管内皮细胞、促进血管重塑方面具有协同作用;脑组织缺血缺氧与脑内糖代谢紊乱形成恶性循环,也可能使认知功能减退进一步加重。
本研究提示与单纯高血压和单纯DM患者相比,高血压合并DM会加重认知功能减退,提示临床应对此类患者进行早期干预,延缓MCI的发生发展。本研究存在一定局限:样本量较小,可能出现统计学效果偏差;对机制的探讨尚处于理论阶段;长期随访尚未完善,不足以全面反映病程进展。在以后研究中有待于进一步完善。
【参考文献】
[1] DeCarli C. Mild cognitive impairment: prevalence, prognosis, aetiology, and treatment[J]. Lancet Neurol, 2003, 2(1): 15-21. DOI: 10.1016/S1474-4422(03)00262-X.
[2] 中国防治认知功能障碍专家共识专家组. 中国防治认知功能障碍专家共识[J]. 中华内科杂志, 2006, 45(2): 171-173.
Expert group of consensus on prevention and treatment of cognitive impairment in China. Consensus on prevention and treatment of cognitive impairment in China[J]. Chin J Intern Med, 2006, 45(2): 171-173.
[3] Jayaraman A, Pike CJ. Alzheimer’s disease and type 2 diabetes: multiple mechanisms contribute to interactions[J]. Curr Diab Rep, 2014, 14(4): 476. DOI: 10.1007/s11892-014-0476-2.
[4] Waldstein SR, Rice SC, Thayer JF,etal. Pulse pressure and pulse wave velocity are related to cognitive decline in the Baltimore Longitudinal Study of Aging[J]. Hypertension, 2008, 51(1): 99-104. DOI: 10.1161/HYPERTENSIONAHA.107.093674.
[5] Chi NF, Chien LN, Ku HL,etal. Alzheimer disease and risk of stroke: a population-based cohort study[J]. Neurology, 2013, 80(8): 705-711. DOI: 10.1212/WNL.0b013e31828250af.
[6] Yamaguchi Y, Wada M, Sato H,etal. Impact of ambulatory blood pressure variability on cerebral small vessel disease progression and cognitive decline in community-based elderly Japanese[J]. Am J Hypertens, 2014, 27(10): 1257-1267. DOI: 10.1093/ajh/hpu045.
[7] Alperovitch A, Blachier M, Soumare A,etal. Blood pressure variability and risk of dementia in an elderly cohort, the Three-City Study[J]. Alzheimers Dement, 2014, 10(5 Suppl): S330-S337. DOI: 10.1016/j.jalz.2013.05.1777.
[8] Lattanzi S, Luzzi S, Provinciali L,etal. Blood pressure variability predicts cognitive decline in Alzheimer’s disease patients[J]. Neurobiol Aging, 2014, 35(10): 2282-2287. DOI: 10.1016/j.neurobiolaging.2014.04.023.
[9] 郑桃林, 刘 超, 何 伟, 等. 原发性高血压合并轻度认知功能障碍的相关性研究[J]. 中华老年多器官疾病杂志, 2016, 15(8): 613-616. DOI: 10.11915/j.issn.1671-5403.2016.08.145.
Zheng TL, Liu C, He W,etal. Correlation of essential hypertension and mild cognitive impairment in the elderly[J]. Chin J Mult Organ Dis Elderly, 2016, 15(8): 613-616. DOI: 10.11915/j.issn.1671-5403.2016.08.145.
[10] 薛 敏, 魏 菁. 高血压患者认知功能及危险因素的分析[J]. 解放军护理杂志, 2007, 24(9B): 16-18. DOI: 10.3969/j.issn.1008-9993.2007.09.007.
Xue M, Wei J. Cognitive function of patients with essential hypertension and its risk factors[J]. Nurs J Chin PLA, 2007, 24(9B): 16-18. DOI: 10.3969/j.issn.1008-9993.2007.09.007.
[11] Efimova IY, Efimova NY, Triss SV,etal. Brain perfusion and cognitive function changes in hypertensive patients[J]. Hypertens Res, 2008, 31(4): 673-678. DOI: 10.1291/hypres.31.673.
[12] 王 平, 曾 慧. 高血压与认知功能关系研究进展[J]. 中国全科医学, 2011, 14(2C): 677-679. DOI: 10.3969/j.issn.1007-9572.2011.06.039.
Wang P, Zeng H. Research progresses on the relationship between hypertension and cogntitive function[J]. Chin Gen Pract, 2011, 14(2C): 677-679. DOI: 10.3969/j.issn.1007-9572.2011.06.039.
[13] Semplicini A, Inverso G, Realdi A,etal. Blood pressure control has distinct effect on executive function, attention, memory and markers of cerebrovascular damage[J]. J Hum Hypertens, 2011, 25(2): 80-87. DOI: 10.1038/jhh.2010.28.
[14] Harrison LB, Raskin P, Lingvay I. Response to comment on: Harrisionetal. β-cell function preservation after 3.5 years of intensive diabetes therapy.Diabetes Care 2012; 35: 1406-1412[J]. Diabetes Care, 2013, 36(1): e17. DOI: 10.2337/dc12-1659.
[15] Luchsinger JA, Tang MX, Shea S,etal. Hyperinsulinemia and risk of Alzheimer disease[J]. Neurology, 2004, 63(7): 1187-1192. DOI: 10.1212/01.WNL.0000140292.04932.87.
[16] Kalmijn S, Feskens EJ, Laxmer LJ,etal. Glucose intolerance, hyperinsulinaemia and cognitive function in a general population of elderly men[J]. Diabetologia, 1995, 38(9): 1096-1102. DOI: 10.1007/s001250050397.

