1株总状毛霉CGMCC8700的鉴定及蛋白质谱分析
蒋立文,谢靓,廖卢艳,周红丽,周辉,曾玉伦
1(食品科学与生物技术湖南省重点实验室,湖南 长沙,410128) 2(湖南农业大学 食品科技学院,湖南 长沙,410128)
1株总状毛霉CGMCC8700的鉴定及蛋白质谱分析
蒋立文1,2*,谢靓1,2,廖卢艳1,2,周红丽1,2,周辉1,2,曾玉伦1,2
1(食品科学与生物技术湖南省重点实验室,湖南 长沙,410128) 2(湖南农业大学 食品科技学院,湖南 长沙,410128)
毛霉是发酵大豆制品常用的菌种,通过常规分离方法从自然发酵的豆制品中分离得到一种纯种霉菌,采用培养和显微观察方法,分析其脂肪酸组成、(G+C)%摩尔含量、rRNA基因序列的ITS1-5.8S-ITS2区、结合蛋白质谱分析毛霉蛋白质的组成。经过鉴定该霉菌为总状毛霉(CGMCC8700),菌丝为棉絮状,有厚垣孢子,孢子呈卵圆形或椭圆形,黄褐色,G+C摩尔含量为39.53%,TM值为70%,rRNA基因序列的ITS1-5.8S-ITS2区包括640个碱基,蛋白质全谱质谱鉴定为该毛霉有1 304个特定的肽段,鉴定到肽段的长度集中在8和22之间,但长度为11的肽段最多,平均肽段长度为14.62,平均蛋白质的鉴定覆盖度为17.25%。这些指标与毛霉菌发酵特性有关。
总状毛霉CGMCC8700;脂肪酸;TM值;质谱
毛霉菌种是一种重要的微生物资源,中国工业微生物菌种保藏中心(China Center of Industrial Culture Collection,CICC)保藏的65种毛霉菌中,有19种标注可以用于腐乳或者豆豉生产;中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center, CGMCC)公开的毛霉菌有309种,可用于腐乳或豆豉生产的仅有1种,为五通桥毛霉(3.00025)。这说明酿造专用的微生物资源没有建立统一的信息库。目前国内毛霉的研究很多,主要代表性研究集中在酶系分布、发酵特性、产品品质等方面[1-5]。
关于毛霉菌CGMCC8700的运用已经有很多相关研究,主要体现在对毛霉菌前期选育[6-8]、豆豉生产[9-14]、酶系分布及与风味变化关系[15-16]、发酵过程中异黄酮的转化[17]等。
蛋白质组全谱分析是指以完整的组织、细胞、血液或体液等复杂样本为研究对象,采用质谱技术和生物信息学方法,识别出样品中尽可能多的多肽或蛋白序列,并对其做一系列相关功能注释。目前基于质谱技术的大规模蛋白质组鉴定技术已非常成熟,该技术已颠覆了传统鉴定蛋白质序列(如Edman法、2-DE)的方法[18-19]。与传统方法相比,基于质谱的蛋白质组学研究具有通量大、精度高、适用范围广等特点,并且在食品营养与健康方面运用广泛[20],真菌的蛋白质研究也受到关注[21-22]。为强化对毛霉菌的系统研究,本研究将以传统豆豉、腐乳分离出来的毛霉菌(中国工业微生物菌种保藏中心登记注册号为:CGMCC8700)为对象,其进行了分析和鉴定。
1 材料与方法
1.1 主要材料与试剂
毛霉菌种来源:CGMCC8700,菌种保藏用培养基:Potato Dextrose Agar (PDA )。
主要试剂:45 g NaOH溶于150 mL甲醇和150 mL蒸馏水中(溶液1);190 mL浓HCl,275 mL溶于135 mL蒸馏水中(溶液2);200 mL正己烷与200 mL甲基叔丁醚均匀混合(溶液3);10.8 g NaOH溶于90 mL蒸馏水中(溶液4);饱和NaCl溶液(溶液5)。
1.2 仪器与设备
HP6980气相色谱分析仪,美国Agilent公司[配备分流/不分流进样口,氢火焰离子化检测器(FID)及HP气相色谱工作站(HP chemstationver A5.05),色谱柱为Ultra-2柱,柱长25 m,内径0.2 mm,滤膜厚度为0.33 μm];TripleTOFTM5600 plus高分辨质谱仪,AB sciex公司的Lambda35UV/VIS Spectrometer紫外/可见分光光度计,美国Perkin/Elmer公司;Sherolock全自动细菌鉴定系统,美国MIDI公司。
1.3 实验方法
1.3.1 菌种显微鉴定
选取生长速度快,菌丝致密,孢子量多的单个菌落,继续进行多次点种培养,然后用稀释平板分离,待长出单菌落移接斜面。进行初步的应用试验[6]后进行保存、鉴定、测试生长表征指标。
1.3.2 测定菌株DNA中G+C mol%的方法
(1)将待测DNA样品0.1×SSC稀释至OD260值在0.3~0.4;(2)在波长260 nm下首先记录25 ℃时的OD值,然后设定升温程序,从65 ℃升温到95 ℃,每分钟升温1 ℃;(3)OD值上升表示变性开始,记录比色皿的温度和OD值,直到OD值不变,代表变性已经结束;(4)根据热变性曲线,得出熔链温度TM值,计算G+C mol%的含量。0.1×SSC溶液中计算公式为:
G+C mol%=G+C mol%1.365+2.08(TM未知-TM1.365)
1.3.3 菌种脂肪酸测定方法
(1)用接种环从培养基表面挂取少量的真菌培养物,在8 mL螺口玻璃管中,加入1 mL溶液1,拧紧螺盖,沸水浴5 min,取出振荡5~10 s,再拧紧螺盖,沸水浴25 min;(2)待样品管冷却后,再加入2 mL溶液2,盖严振荡,然后于(80±1)℃进行恒温水浴,冰浴冷却;(3)在冷却管中加入1.25 mL溶液3,快速振荡10 min,弃去下层水相,再加入3 mL溶液4和几滴溶液5,快速振荡5 min,取2/3有机相于样品瓶中,进行测定;(4)色谱分析条件:采用HP6980气相色谱分析仪,炉温为二阶程序升温,起始温度为170 ℃,每5 ℃/min升温至260 ℃,随后以每分钟40 ℃升温到310 ℃维持1.5 min。进样口温度为250 ℃,载气为H2,进样速度为0.5 mL/min,分流进样模式,分流比为100∶1,进样量为2 μL,检测器温度为300 ℃,H2流速30 mL/min,空气流速为216 mL/min,补充氮气流速为 30 mL/min。
1.3.4 蛋白质全谱测定的实验流程
(1)蛋白提取:将分离纯化的纯种斜面收集培养物,用200 μL的TEAB,用超声破碎仪进行破碎,加入4倍体积的冷丙酮(含终浓度为10 mmol/L DTT)沉淀2 h,13 000 r/min 离心20 min,收集沉淀;加入800 μL的冷丙酮(含终浓度为10 mmol/L DTT)重悬沉淀;13 000 r/min离心20 min,收集沉淀,然后风干沉淀,加入100 μL的TEAB溶解蛋白;(2)蛋白质定量:采用 Bradford定量;(3)蛋白质的SDS-PAGE检测、酶切、标记;(4)除盐:将标记过程中的标记试剂和相关 buffer 的盐除去,以便于后续分析;(5)等量混合各样本中的标记肽段;(6)MS/MS质谱检测及分析;(7)生物信息分析。
1.4 主要测定方法
1.4.1 微生物主要培养特征及显微特征的鉴定
采用PDA培养基进行培养,同时利用常规显微试验对菌丝生产、繁殖体生成情况进行显微鉴定。
1.4.2 测定菌株DNA中G+C mol%的方法
采用溶解温度法(Tm值),以大肠菌群埃希氏大肠杆菌E.coliK12(CGMCC1.365)为参比对照,仪器采用紫外分光光度计测定,用PTP-1数字温控仪控温。
1.4.3 菌体脂肪酸含量
采用Sherolock全自动细菌鉴定系统对菌株进行菌种脂肪酸测定。
1.4.4 微生物蛋白质全谱分析
Uniprot/Mucor(包含23827条蛋白质序列)(2016年3月更新)数据库。采用与 AB Sciex 5600 plus 配套的搜索引擎——ProteinPilot v4.5 进行数据解析。在选择数据库时,遵循如下原则:若为已经测序生物,直接选用该物种数据库,若为非测序生物,则选择与被测样品最为相关的大类蛋白质组数据库。
2 结果与讨论
2.1 选育菌种的培养特征、显微特征
经鉴定为总状毛霉(Mucorracemosus),平皿生长可布满培养基,菌丝为薄棉絮状,浅黄褐色(图1a);孢囊具有短的、稀疏的假轴状分枝,孢子囊直径在(20~100) μm(图1b),囊轴近卵形,(17~60) μm×(10~45) μm(图1c),孢囊孢子近球形,宽椭圆形,单个无色,聚集在孢囊中呈灰褐色(5~8.5) μm×(4~7) μm(图1d)。结合孢子未见,厚垣孢子形状、大小不一致,无色或者浅黄色(图1d)。
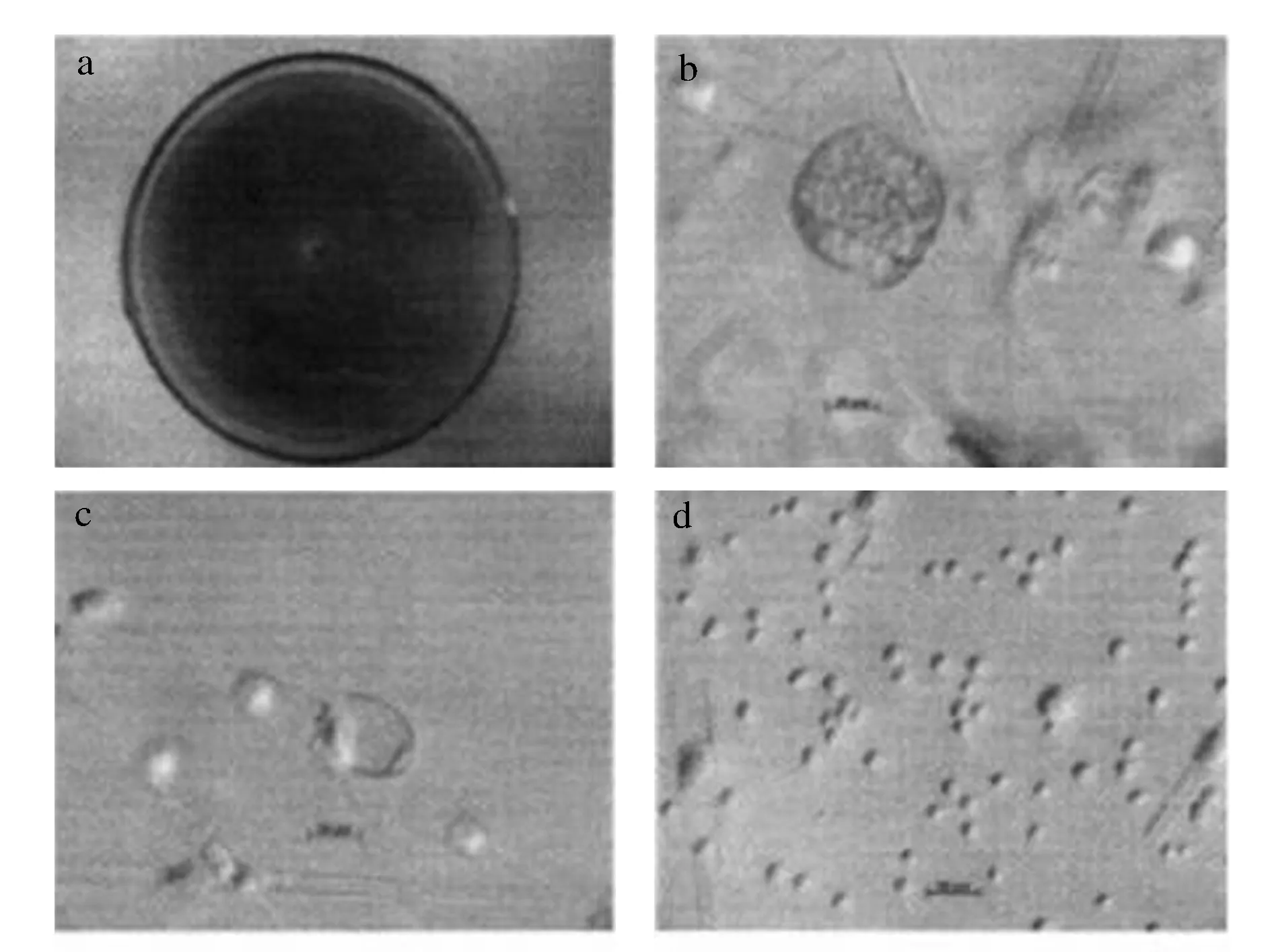
图1 总状毛霉培养特征、显微特征Fig.1 Mucorracemosus cultural characteristics, microscopic characteristics
2.2 毛霉菌种的TM值和G+C mol %
按照规定的方法,测定的TM值和G+C%含量见表1。根据TM值毛霉菌的变性温度比大肠杆菌低,毛霉菌的耐热性比大肠杆菌还要差些,同时可以推断大肠杆菌G+C mol %高于毛霉菌。
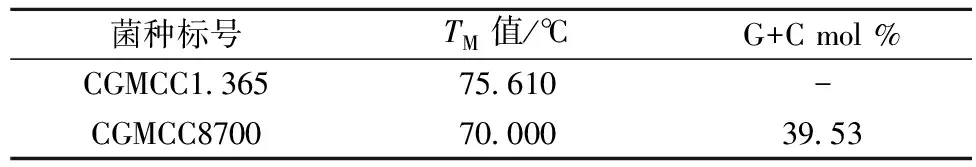
表1 CGMCC8700的TM值和G+C mol%含量
2.3 脂肪酸组成测定
细胞中脂肪酸构成对菌种性能有非常重要的作用和意义。从表2可以看出,饱和脂肪酸C14∶0、C16∶0、C18∶0占总比例超过25.46%,不饱和脂肪酸和饱和脂肪酸比例为2.67∶1,脂肪酸含量、饱和脂肪酸和不饱和脂肪酸含量的比例直接影响微生物本身细胞膜的流动性及可能的低温下生长适应能力。其组成与微生物细胞结构、耐热性、生长特性密切相关[23]。
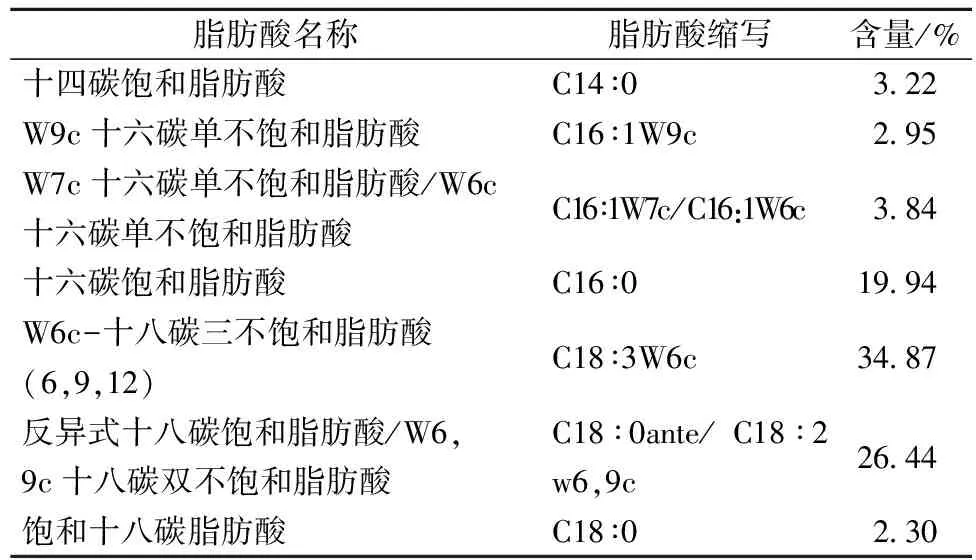
表2 总状毛霉菌脂肪酸组成测定
2.4 蛋白质全谱鉴定的结果
采用基于质谱方法的蛋白质组鉴定基本流程,即对MS/MS质谱数据经过系列优化处理后与数据库进行相似性比较打分从而进行蛋白鉴定。蛋白质鉴定信息统计结果见表3。

表3 蛋白质鉴定信息表
注:*表示可信度至少为95%以上,**表示至少含有2个unique肽段的鉴定蛋白质数目。
2.4.1 Unique肽段数分布
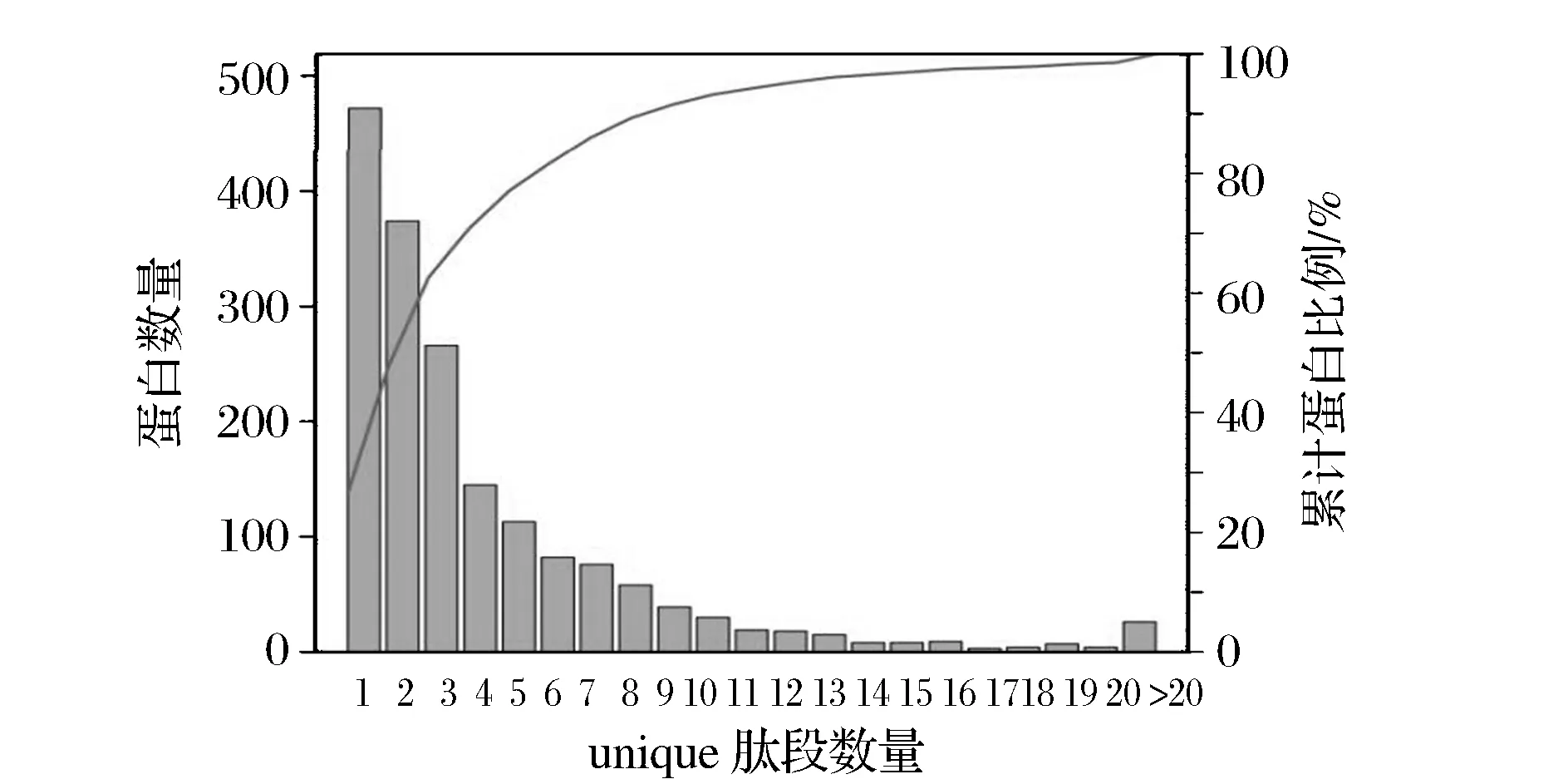
图2 CGMCC8700中鉴定蛋白中的 unique 肽段数分布Fig.2 Unique peptide profile of identified several proteins in CGMCC 8700
Unique肽段为仅在一个蛋白质中存在的肽段。由这类型肽段的存在,可以唯一地确定相应蛋白质的存在。图2为CGMCC8700鉴定到的所有蛋白所包含的95%可信度Unique肽段数的双坐标分布图,横坐标为蛋白质包含的Unique肽段数,左侧纵坐标为与横坐标对应的蛋白数目;右侧纵坐标为与横坐标对应的累计蛋白比例,从鉴定结果可以看出,至少含有2个Unique肽段的蛋白质数目为1 304,占总蛋白质的73.42%。Unique肽段是针对毛霉菌CGMCC8700特有的肽段,在至少含有Unique-2肽段在鉴定比例达到70%以上,说明其独特性,这为以后深入研究不同毛霉菌本身蛋白特性提供了依据。
2.4.2 肽段长度分布
图3是本次鉴定到肽段的长度分布。从图3中可以看出,CGMCC8700鉴定到肽段的长度也同样集中在 8 和 22 之间,但长度为 11 的肽段最多,平均肽段长度为14.62,肽段数量适当。如果鉴定到的肽段偏高或者偏低,说明实验阶段使用的酶选用不恰当,使得酶切肽段大部分高于或者低于质谱仪的检测范围,从而使得可检测肽段偏少,鉴定蛋白数目降低。此次鉴定到的肽段主峰在11、12,介于质谱仪的鉴定范围中值,保证鉴定到足够多的蛋白。
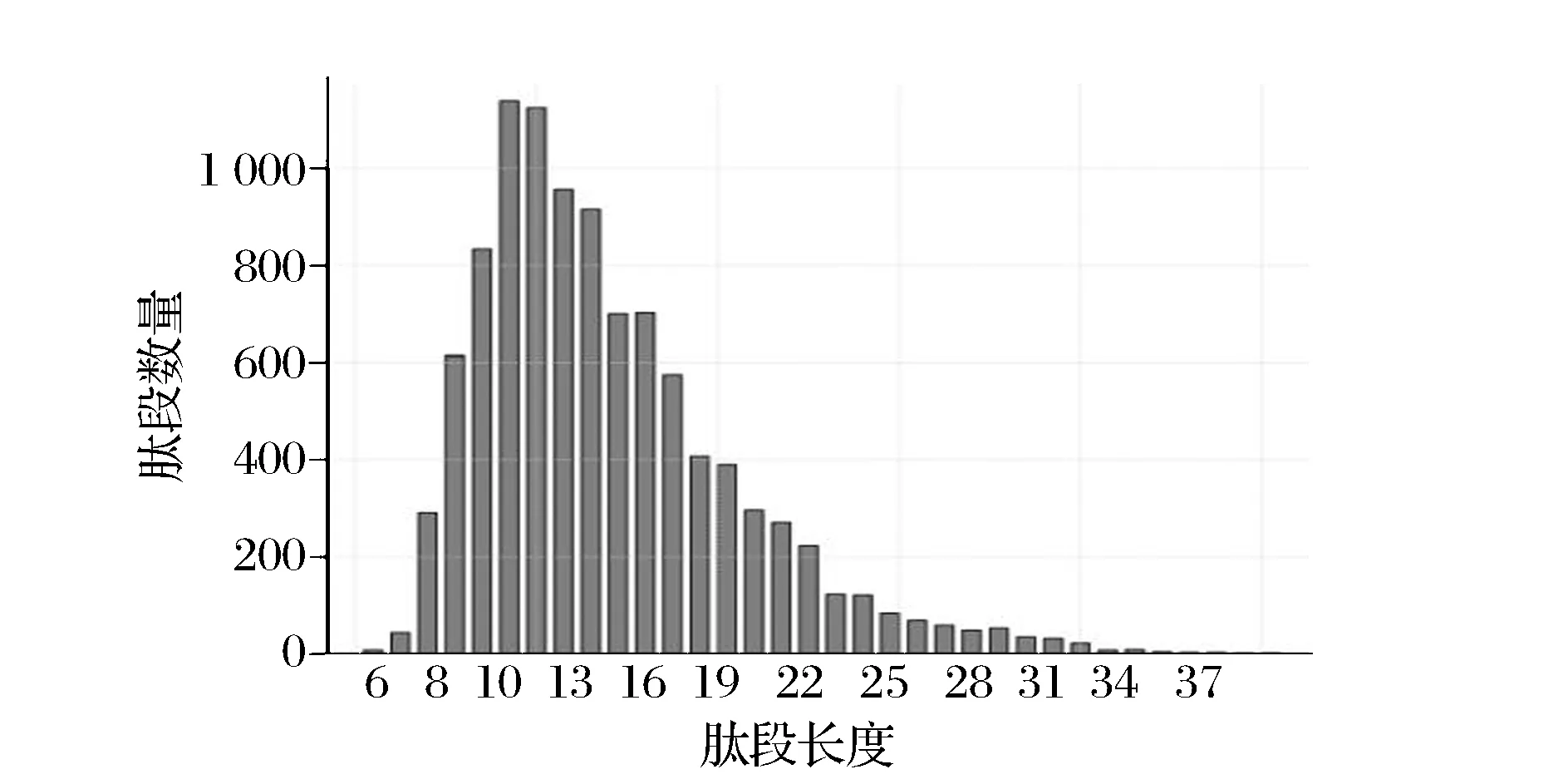
图3 CGMCC8700中肽段长度分布Fig.3 Peptide segment length distribution in CGMCC 8700
2.4.3 蛋白覆盖度分布
对于一个鉴定到的蛋白质,如果包含支持该蛋白的肽段数目越多,说明该蛋白的可信度越高。因此,蛋白质的鉴定覆盖度也能间接反应鉴定结果的整体准确性。图4为CGMCC8700蛋白质鉴定(95%可信度肽段)覆盖度分布饼图中,不同颜色的饼代表了具有不同鉴定覆盖度范围的蛋白质百分比。CGMCC8700鉴定覆盖度在(0, 10%)范围内的蛋白质百分比为40.6%,覆盖度大于等于20%的蛋白占总蛋白的33.44%,平均蛋白质的鉴定覆盖度为17.25%。

图4 CGMCC8700蛋白鉴定覆盖度的整体分布Fig.4 coverage of the distribution of identified protein in CGMCC 8700
蛋白鉴定主要是鉴定Unique肽段(Unique肽段指每个蛋白或者蛋白家族特有的多肽序列),而unique肽段占蛋白质全长的比例一般较低,因此鉴定的蛋白质覆盖度偏低的较多,所以此数据是具有参考价值的。
3 结论
该菌株经过鉴定为总状毛霉(CGMCC8700),菌丝为棉絮状,有厚垣孢子,孢子呈卵圆形或椭圆形,黄褐色,G+C含量为39.53%,TM值为70%,rRNA基因序列的ITS1-5.8S-ITS2区包括640个碱基,蛋白质全谱质谱鉴定为该毛霉有1 304个特定的肽段,鉴定到肽段的长度集中在8和22之间,但长度为11的肽段最多,平均肽段长度为14.62,平均蛋白质的鉴定覆盖度为17.25%。
上述研究结果只是对从传统发酵豆制品分离得到的1株毛霉菌进行初步的鉴定和分析,得到了一些有意义有价值的信息但需要更加系统,或许可采用相关的其他类似菌株比较相关指标的差异性来确定分离得到微生物的差异,这有待进一步探索。
发酵微生物是传统发酵产品的核心和灵魂,其优良的生长条件、形成所需要的酶系复合型、定时定向分泌酶系得到相应的代谢产物是发酵食品重要的研究内容,这将为发酵食品的差异性、功能性、营养性等奠定非常重要的基础。因此充分比较更应该采用更多的类似样本,建立发酵食品微生物资源库,实现资源共享,同时利用宏基因组学、代谢组学等有机结合[20],探讨菌种特性、酶系的形成控制和释放、风味与品质形成之间的关联性[24-26],这是下一步研究的重要方向。
致谢:上述分析得到了中国科学院微生物研究所和杭州联川生物信息技术有限公司的支持,在此表示感谢。
[1] 钟晓敏,付静,蓝嘉,等.Actinomucorelegans、Aspegillusoryzae和Rhizopusoligosporus产蛋白酶条件及蛋白酶性质的比较[J].食品与发酵工业,2009,35(5):40-44.
[2] Pan JQ.Purification and characterization of one alkaline protease fromActinomucorelegansAS3.2778[J].China Biotechnology, 2008,271(2):223-231.
[3] 潘进权.雅致放射毛霉AS3.2778酸性蛋白酶的纯化及性质研究[J].中国生物工程杂志,2008,28(9):111-118.
[4] 潘进权,罗晓春,谢明叔.毛霉蛋白酶的组分特性及对大豆蛋白水解的研究[J].中国粮油学报,2009,24(5):31-35.
[5] 潘进权,罗晓春,谢明权.雅致放射毛霉AS3.2778碱性蛋白酶的纯化及水解特性[J].华南理工大学学报:自然科学版,2008, 36(12):106-111.
[6] 邓芳席,刘素纯.腐乳毛霉菌种选育及产酶条件研究[J].湖南农业大学学报:自然科学版,1995,21(1):56-60.
[7] 邓芳席,黄见良.耐高温腐乳菌株选育及产酶条件研究[J].湖南农业大学学报:自然科学版,1996,22(2):196-200.
[8] 夏岩石,夏延斌,蒋立文.腊八豆生产菌株的选育[J].现代食品科技,2007,23(2):22-25.
[9] 蒋立文,周传云,邬玉香.传统美食腊八豆工业化生产的研究[J].食品科学, 2003,24(3):59-64.
[10] 陶湘林.原料蒸煮条件对毛霉型豆豉品质的影响研究[D].长沙:湖南农业大学,2014.
[11] 陶湘林,蒋立文,苏悟,等.电子鼻、电子舌鉴别不同蒸煮条件的毛霉型豆豉品质的研究[J].核农学报,2015,29(12):2 349-2 354.
[12] 李清明,蔡霞,蒋立文,等.腊八豆质构与感官评价相关性的研究(英文)[J].农业科学与技术:英文版,2014,15(1):159-161.
[13] 杨伊磊,陈力力,李梦丹,等.不同条件下毛霉豆豉制曲过程的动态分析[J].粮食与油脂,2015,28(11):30-33.
[14] 杨伊磊,李梦丹, 陈力力,等.毛霉型豆豉后发酵工艺条件的优化研究[J].中国酿造,2015,34(10):23-26.
[15] 欧阳晶,杨俊换,苏悟,等.腊八豆低温后发酵过程中的挥发性成分变化研究[J].食品工业科技,2014,35(17):275-279.
[16] 李雨枫,欧阳晶,苏悟,等.传统发酵豆豉蛋白质生物学变化与抗氧化能力研究[J].中国酿造,2014,33(11):20-24.
[17] 邬玉香,夏延斌,刘爱玲.大豆异黄酮在腊八豆生产中的稳定性[J].湖南农业大学学报:自然科学版,2002,28(3):237-238.
[18] 刘伟,王腾蛟,唐海琳,等.高通量细菌鉴定方法研究进展[J].微生物学通报,2014,41(12):2 501-2 509.
[19] 张成普,徐平,朱云平.原核生物蛋白质基因组学研究进展[J].生物工程学报,2014,30(7):1 026-1 035.
[20] 周蕴华,尹慧勇.质谱技术在现代营养学和食品分析检测中的应用[J].生命科学,2013,25(2):240-247.
[21] 顾丰颖,高洁,阮晖,等.真菌的蛋白质组学研究——方法与进展[J].中国食品学报, 2012, 12(8):135-140.
[22] 张瑶, 徐平,李文均,等.放线菌蛋白质组学研究进展[J]. 生物工程学报,2014, 30(7):1044-1058.
[23] 张琦,王志, 何仕武,等.多不饱和脂肪酸对微生物低温适应性的影响[J].生命科学, 2012,24(1):58-62.
[24] 王静,孙宝国.中国主要传统食品和菜肴的工业化生产及其关键科学问题[J].中国食品学报, 2011,11(9):1-7.
[25] 张国华,何国庆.我国传统馒头发酵剂的研究现状[J].中国食品学报,2012,12(11):115-120.
[26] 俞邱豪,张九凯,叶兴乾,等.基于代谢组学的食品真实属性鉴别研究进展[J].色谱,2016,34(7):657-664.
Identification and protein spectrum analysis ofMucorracemosusCGMCC8700
JIANG Li-wen1,2*, XIE Jing1,2,LIAO Lu-yan1,2, ZHOU Hong-li1,2, ZHOU Hui1,2, ZENG Yu-lun1,2
1(Hunan Provincial Key Laboratory of Food science and Biotechnology,Changsha 410128, China) 2(College of Food Science and Technology, Hunan Agricultural University,Changsha 410128, China)
Mucor is a kind of specie commonly used for fermented soybean products. In this paper, a pure mold was isolated from naturally fermented soy products using conventional separation methods. Through culture and microscopic observation method, its fatty acid composition, (G+C)% (mol) content, rRNA gene sequence ITS1-5.8S-ITS2 region, binding protein spectrum were analyzed. The results showed that it was identified asMucorracemosus(CGMCC8700) and had mycelium of cotton wool, thick wall sporeswith oval or elliptical shape, brown color, G+C mol content of 39.53%, andTMvalue of 70%. ITS1-5.8S-ITS2 region of rRNA gene sequence comprising 640 bp. Proteins spectrum identified by mass spectrometry had 1 304 specific peptides forMucorracemosus. The sizes of the identified peptides were ranged from 8aa to 22aa with average size of 14.62aa, wherein the number of 11aa peptide was the highest. The average coverage for identification of protein was 17.25%. These indices were related to fermentation characteristics.
MucorracemosusCGMCC8700;fatty acid;TMvalue; mass spectrum(MS)
10.13995/j.cnki.11-1802/ts.201703014
博士,教授(本文通讯作者,E-mail:1024305380@qq.com)。
国家自然科学基金(31571819)
2016-10-10,改回日期:2016-11-29

