麝香石斛组织培养过程中生长效应及多糖含量变化
肖丽君+陈小强+赵铭+王东元+覃美运+王景太


摘要:麝香石斛(Dendrobium parishii Rchb. f.)是原种石斛,具有很高的观赏价值和药用价值。试验利用组织培养技术筛选培养基合适的激素浓度,在最优条件下观察麝香石斛试管苗7~108 d的生长情况,分析麝香石斛不同生长阶段植物多糖含量的变化情况和积累规律。结果显示,麝香石斛多糖含量随培养时间的增加而提高,0~40 d增长速率较为缓慢,40~80 d增长较快,之后的多糖含量又开始趋于平缓。
关键词:麝香石斛(Dendrobium parishii Rchb. f.);组织培养;生长效应;多糖
中图分类号:S567.9+1 文献标识码:A 文章编号:0439-8114(2017)06-1090-03
DOI:10.14088/j.cnki.issn0439-8114.2017.06.024
Abstract: Dendrobium parishii Rchb. f. is Dendrobium protospecies,which is of high ornamental and medicinal value. By using tissue culture techniques, the best concentration of 6-BA and NAA for the growth of plant tissues was selected. Under the optimal conditions, the plantlets was cultured and analyzed in different growth phases in 7 to 108 d, and the plant polysaccharides was also analyzed with time changes. The results show that the content of polysaccharides of D. parishii increased with the cultured time adding, and the growth rate is relatively slow in 0 to 40 d, rapidly in 40 to 80 d, and after then begins to flatten.
Key words: Dendrobium parishii Rchb. f.; tissue culture; growth effects; polysaccharide
兰科(Orchidaceae)石斛属(Dendrobium Sw.)目前有1 100多种,是兰科中的第二大属[1]。其中麝香石斛(Dendrobium parishii Rchb. f.)是原种石斛,不仅具有很高的观赏价值,而且还有重要的药用价值。麝香石解有效药用成分主要是多糖、生物碱、类黄酮、菲类化合物等物质。其中含量最多的是生物碱和多糖[2]。多糖是麝香石斛中最重要的药用成分,也是自然界中最多的一种有机高分子化合物,不仅可以提高免疫功能,还可以抗病毒、降血糖、抗肿瘤等[3]。许多研究都证实了以组织培养物代替原植物做药用的可行性,顾慧芬等[4]通过研究发现,铁皮石斛组培苗和野生品的多糖类型与含量基本是相同的;高建平等[5]研究报道,铁皮石斛组织培养物原球茎药用作用与原药材相似;何铁光等[6]也证明,铁皮石斛类原球茎的多糖含量与野生品相近,药理作用相同。试验利用组织培养技术,通过调节不同植物激素浓度配比进行培养基配方优化,在最适培养基的基础上对麝香石斛进行试管培养,并在其不同生长阶段测定多糖含量,以期建立并优化麝香石斛试管苗培养体系,研究其生长过程中多糖的积累规律,为提高多糖含量及大规模生产有效药用成分提供技术参数,同时也为石斛多糖合成机理的研究提供理论依据。
1 材料与方法
1.1 材料
选用继代多次、具有稳定形态特征和生长速率的麝香石斛试管苗为外植体,由天津农学院植物细胞工程中心提供。试剂、仪器由天津农学院农学与资源环境学院中心实验室提供。
1.2 麝香石斛最适生长培养基筛选
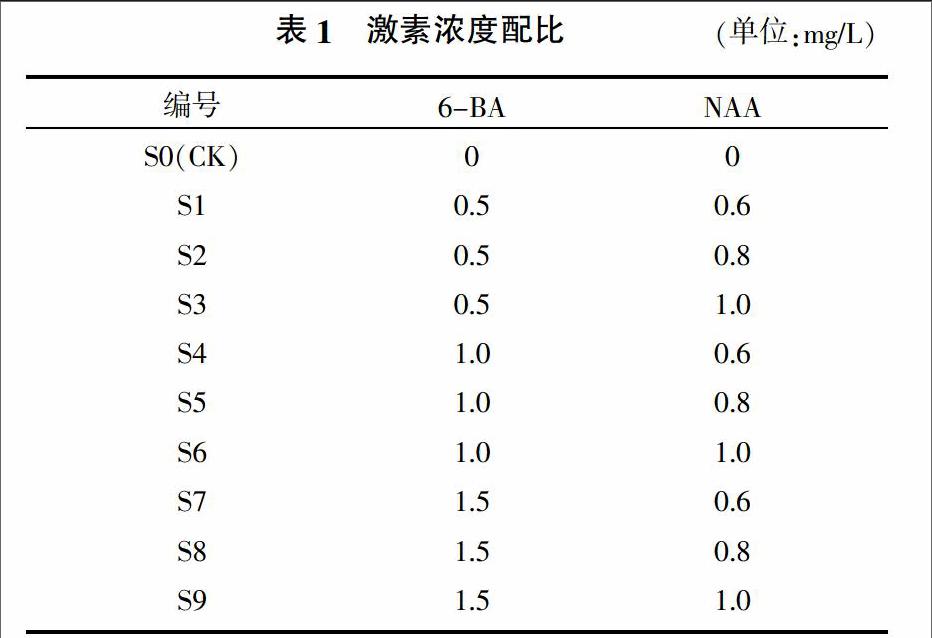
在麝香石斛組织培养过程中,以MS培养基为基本培养基,添加蔗糖30 g/L、琼脂6.5 g/L、活性炭2 g/L,通过调整植物激素含量,筛选出最适合麝香石斛试管苗生长的培养基,激素浓度配比见表1。每处理做30次重复,观察一段培养时间(分别是20、40、60、80、100 d)内麝香石斛试管苗的变化情况,选取最适合麝香石斛试管苗生长的激素浓度配比。
1.3 多糖测定
各个待测材料的鲜样先用去离子水洗净,再用滤纸吸干水分,称重得鲜重。在烘箱里以105 ℃对麝香石斛材料杀青15 min,再将其置于80 ℃恒温烘箱中烘至恒重;接着用研钵研碎,称重得干重,然后分别装入样品袋,贴上相应的标签,放入干燥器中保存。采用苯酚-浓硫酸法对多糖含量进行测定。
1.3.1 标准曲线 参照李满飞等[7]的方法完成麝香石斛多糖标准曲线绘制。先把在105 ℃烘箱中干燥至恒重的葡萄糖标准品称取0.1 g,用去离子水定容于1 000 mL的容量瓶中。得到0.1 mg/mL葡萄糖溶液,再分别精确吸取0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.60、0.80 mL样品加到试管中,都加入去离子水到2.0 mL刻度。然后各加入苯酚试剂(10 g苯酚定容在150 mL的容量瓶中)1.0 mL,摇匀;迅速加入浓硫酸5.0 mL,摇匀,放置5 min,置沸水浴中加热15 min后,冷水迅速冷却到室温。另外,用去离子水2.0 mL进行同法操作,作为空白对照。在紫外分光光度计的波长490 nm处测各葡萄糖标准品溶液的吸光度,以吸光度值对浓度绘制标准曲线,进行线性回归,求出标准曲线方程。
1.3.2 多糖的测定 每个样品取2 g,研磨后加入20 mL去离子水,将研磨液加热1 h后,进行二级提取,将提取液通过3 000 r/min离心5 min,取上清液0.1 mL,分别稀释10、20、30倍。取稀释液1 mL加入5%苯酚5 mL、浓硫酸5 mL,静置5 min,接下来放到沸水浴中15 min,然后用冷水冷却到室温。将样品加入到比色皿中,在490 mm处测定吸光度;空白为1 mL去离子水加5 mL苯酚和5 mL浓硫酸。依据标准曲线求出各样品的多糖含量。
2 结果与分析
2.1 不同激素浓度配比下麝香石斛试管苗生长变化
试验各个时期麝香石斛试管苗的生长情况见表2。在表2中,优:表示在所有试验处理中生长发育状况最好,其生长状况要明显优于对照;良:表示生长发育状况次于优水平,重量约是优水平的80%左右;中:表示生长发育状况次于良水平,重量约是良水平的60%~80%左右;差:表示生长发育状况较差,或者死亡。将不同激素浓度下的麝香石斛试管苗生长情况进行分析,结果见图1。从表2和图1可见,对照由于没有添加激素,其生长是最慢的;S4处理可能是由于操作过程不当,导致其被细菌感染而逐渐死亡;其余的处理如S1和S2在培养的后期,其生物量明显要高于其他处理,说明此时激素的浓度配比较合适,S6相对于其他处理生长量是最大的,说明最适合植物生长的激素组合为6-BA 1.0 mg/L+NAA 1.0 mg/L。根据观察,S6处理的试管苗生长较为茂盛,因此接下来的试验中,将采用S6处理的激素组合对麝香石斛试管苗进行增殖培养。
2.2 麝香石斛试管苗多糖测定
把S6处理(最优条件)放入培养基,则培养基为MS+6-BA 1.0 mg/L+NAA 1.0 mg/L+蔗糖30 g/L+活性炭2 g/L+琼脂6.5 g/L,用其对麝香石斛试管苗进行组织培养。然后分别在培养开始的7、14、22、29、36、54、72、108 d取麝香石斛在培养过程不同生长阶段的试管苗,测定不同阶段麝香石斛试管苗的多糖含量,确定麝香石斛试管苗多糖含量最高的时期。
2.2.1 标准曲线的绘制 根据测得的试验数据得到标准曲线的回归方程,
OD=2.607 4C,R2=0.999 1,
式中,OD为吸光值,C为待测液体的浓度,单位是mg/mL。通过线性回归方程,拟合出多糖标准曲线,具体见图2。通过测定麝香石斛试管苗中的多糖在490 nm波长下的吸光值,根据公式计算得到样品的多糖浓度,比较并摸索多糖浓度随着时间变化的增长规律,后续需要调整浓度范围,从而确定每一個样品中的多糖含量。
2.2.2 不同培养阶段麝香石斛试管苗多糖含量测定 通过图2拟合出的曲线,在紫外分光光度计上测定不同培养阶段麝香石斛试管苗中的多糖含量,结果见表3。将不同培养阶段多糖含量作图,得到图3。从图3可以看出,麝香石斛试管苗多糖的含量随培养时间的增加而提高,在0~40 d增长速率较为缓慢,40~80 d增长情况较快,说明此阶段是植物组织培养阶段中植物多糖增长最快的时期,之后植物多糖含量增长的速率开始趋缓。
3 讨论
3.1 不同激素浓度配比对麝香石斛试管苗生长的影响
植物激素具有促进植物分裂生长的作用,其作用机制一般是通过使细胞壁松弛,从而使细胞壁增长;在许多植物中,还可以使RNA和蛋白质的含量增加[8]。不同激素浓度配比对植物的再生有很大影响[9],控制细胞分裂素类和生长素类两者的浓度,可以控制试管苗的增殖与生根,生长素/细胞分裂素的比值小时,有利于分化和增殖,比值大时则有利于生根[10]。陈兆贵等[11]对铁皮石斛组织培养过程中不同激素影响做了相应的研究,发现原球茎增殖以MS+NAA 1.0 mg/L+6-BA 1.0 mg/L+KT 1.0 mg/L为最佳条件。本试验发现,不同激素对植物的生长效应确实是不同的,而最适合麝香石斛试管苗生长的激素浓度为6-BA 1.0 mg/L+NAA 1.0 mg/L。分析认为,植物激素能使麝香石斛试管苗加快生长,因此,推测其体内多糖含量也随之增加。
3.2 不同培养阶段麝香石斛试管苗多糖含量的变化
植物多糖是细胞代谢产生的聚合度较大的物质,属于植物的非结构性碳水化合物,是植物生长过程中必不可少的提供能量的营养物,如淀粉、糖原等都是重要的植物多糖。多糖为石斛类植物最主要的有效成分,因此麝香石斛试管苗中多糖含量成为评定试管苗生长效应的重要因素。试验在麝香石斛组织培养过程中,随着不同时间的变化,比较了多糖的增长情况,发现麝香石斛组织培养增殖期间,在0~40 d左右时试管苗多糖的增加量并不是很大,约在200~1 400 μg/g,说明植物组织培养初期对于合成多糖的能力相对较弱,可能是由于植物的光合系统还没有完全形成造成的,因为光合系统是产生多糖的最关键系统,植物可以通过三羧酸循环将CO2转化为非结构性碳水化合物,而在组织培养过程的初期,其多糖是通过植物吸收营养得来的。通过分析,可以得到多糖的含量在植物组织培养初期后40~80 d左右时迅速增加,可能是此时植物的光合系统逐渐趋于完善的缘故,其在60、80 d的多糖含量分别快速增加到4 143、6 423 μg/g。80 d后,其多糖含量趋于平缓。
试验结果表明,最适合麝香石斛试管苗生长的培养基为MS+6-BA 1.0 mg/L+NAA 1.0 mg/L+蔗糖30 g/L+活性炭2 g/L+琼脂6.5 g/L,在此条件下麝香石斛试管苗多糖含量随培养时间的增加而提高,其中在试管苗培养时间0~40 d的多糖含量增长较为缓慢,40~80 d多糖含量增长较快,之后开始趋于平缓。
参考文献:
[1] 吉占和.中国植物志[M].北京:科学出版社,1999.
[2] 林 萍,毕志明,徐 红,等.石斛属植物药理活性研究进展[J].中草药,2003,34(11):附19-附22.
[3] 时潇丽,姚春霞,林 晓,等.多糖药物应用与研究进展[J].中国新药杂志,2014,23(9):1057-1062.
[4] 顾慧芬,忻晓君,周文婷,等.铁皮石斛试管苗快速生长与栽培研究及多糖含量测定[J].中成药,1999,21(12):658-659.
[5] 高建平,金若敏,吴耀平,等.铁皮石斛原球茎与原药材免疫调节作用的比较研究[J].中药材,2002,25(7):487-489.
[6] 何铁光,杨丽涛,李杨瑞,等.铁皮石斛原球茎多糖DCPP1a-1对氧自由基和脂质过氧化的影响[J].天然产物研究与开发,2007, 19(3):410-414.
[7] 李满飞,徐国钧,平田义正,等.中药石斛类多糖的含量测定[J].中草药,1990,21(10):10-12.
[8] 刘天宝.不同叶序植物内源细胞分裂素和生长素差异分析[D].合肥:安徽农业大学,2010.
[9] 陈振光.园艺植物离体培养学[M].北京:中国农业出版社,1996.84-85.
[10] 王 忠.植物生理学[M].北京:中国农业出版社,2002.
[11] 陈兆贵,谭 俊.不同激素配比对铁皮石斛组织培养的影响研究[J].惠州学院学报(自然科学版),2006,26(3):11-14.

