溶藻细菌F8与藻毒素降解菌T1的原生质体融合研究
张安妮+沈红池+陈雪珍+周新程+张文艺


摘要:为制备出兼具溶藻及降解藻毒素(MC-LR)的双效工程菌,研究不同的亲本原生质体灭活方式、不同PEG浓度、pH以及作用的温度对原生质体融合的影响,探讨溶藻细菌F8与藻毒素降解菌T1菌株的原生质体融合的适宜条件。结果表明,对F8菌株的原生质体采用45 ℃热灭活、T1菌株的原生质体紫外灭活,采用pH为8.0的30%的PEG溶液,融合温度为30 ℃,原生质体融合率可达28.17%。
关键词:溶藻细菌;藻毒素降解菌;原生质体融合
中图分类号:Q813.2;X172;X524 文献标识码:A 文章编号:0439-8114(2017)06-1033-04
DOI:10.14088/j.cnki.issn0439-8114.2017.06.010
Abstract: In order to prepare double engineering bacterium which could both dissolve algae and degradation of microcystin degrading bacteria(MC-LR), the influence of different parent protoplast inactivating methods, concentrations of PEG, pH and temperature on the protoplast fusion were studied. And the suitableconditions of protoplast fusion between dissolve algae bacteria F8 and algae toxin degradation bacterium T1 strain were explored. The results indicated that when the F8 protoplast was inactivated heat by 45 ℃,T1 protoplast was under UV inactivated, pH of PEG solution was 8.0, the mass fraction of PEG solutionwas 30% and the fusion temperature was 30 ℃, the protoplast fusion rate could reach 28.17%.
Key words: algae-lysing bacteria; microcystin degrading bacteria; protoplast fusion
21世纪以来,细胞融合技术作为现代生物技术的核心技术之一得到迅速发展,广泛用于农牧业、轻工、医疗等方面,在植物细胞遗传学和育种学领域,通过细胞融合技术使得植物细胞内遗传物质重新组合,获得杂种细胞,进而培育成新植物体[1-3];在人源化抗体的研制方面,已经培育出具有较高价值的能够用于诊断及治疗病症的单克隆抗体[4,5];在轻工业方面,原生质体融合技术主要用于酒精发酵工艺的改良,构建能够直接发酵淀粉的酵母菌株用于降低能耗[6-10]。随着越来越多的学者对原生质体融合技术的重视,这一方法也逐渐拓宽到环境保护领域[11-15]。本研究利用原生质体融合技术实现溶藻与藻毒素(MC-LR)降解功能的融合,引入所需的目标功能,满足环境保护与治理的需求。
1 材料与方法
1.1 菌种来源
本研究已筛选出的TR3菌株、实验室从太湖流域野生白鲢鱼肠中筛选的MC-LR降解菌F8(Lysinibacillus fusiformis),在美国国立生物技术信息中心(NCBI)GenBank中注册序列号JQ991003,中国微生物菌种保藏管理委员会普通微生物中心保藏号CGMCC NO.6106。
1.2 样品准备
对处于细菌生长迟滞期的F8菌株进行原生质体的制备与再生,所使用的溶菌酶浓度为5 mg/L,酶解时间为30 min,酶解温度为33 ℃,制备后的原生质体分別进行45 ℃热灭活。
将培养至对数期的T1菌株进行原生质体的制备与再生,试验过程中采用的溶菌酶浓度为0.05 mg/mL,酶解温度为30 ℃,酶解时间为1 h。制备的原生质体,分别进行紫外灭活(点光源距离15 cm,照射60 min)、45、50、55、60 ℃热灭活,分别标记为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ处理,以备后用。
1.2.1 原生质体的制备 原生质体的制备按照以下方法进行,以溶菌酶浓度、酶解温度、酶解时间、细菌生长阶段为影响因素,探索其对原生质体制备的影响。
1)菌体重悬:将4 mL活化的菌液4 500 r/min离心10 min,以SMM缓冲液洗涤2~3次后,用SMM缓冲液重悬;
2)酶解:加入溶菌酶使得体系浓度达到设定值,设置不同温度与时间,水浴保温酶解;
3)原生质体重悬:3 000 r/min离心后以0.55 mol/L的NaCl溶液洗涤原生质体2~3次,再用4 mL 0.55 mol/L NaCl溶液重悬原生质体。
4)测定原生质体制备率:将溶菌酶处理前的细胞和酶解后的原生质体悬液均用无菌水稀释到合适梯度,放置10 min,使得原生质体吸水胀破,取100 μL涂布于细菌固体培养基,每个梯度做3个平行,30 ℃倒置培养48 h,分别计菌落数A和B,计算原生质体制备率,以检验制备效果。
原生质体制备率=■×100%
式中,A为总菌落数,即未经溶菌酶处理的菌液涂布于细菌平板上生长的菌落数;B为未原生质体化的细菌菌落数,即原生质体悬液经无菌水稀释后涂布于细菌平板上生长的菌落数。
1.2.2 原生质体的再生 原生质体的再生按照以下方法,研究溶菌酶浓度、酶解温度、酶解时间、细菌生长阶段对原生质体再生的影响。
取“1.2.1”步骤(4)的原生质体悬浮液,用高渗NaCl溶液稀释到合适的3个梯度,分别吸取100 μL涂布于高渗固体培养基,每个梯度做3个平行,置于30 ℃恒温培养箱培养48 h,计再生菌落数C,计算原生质体再生率,以检验再生效果。
原生质体再生率=■×100%
式中,A为总菌落数;B为未原生质体化的细菌菌落数;C为再生菌落数,即原生质体悬液,经高渗NaCl溶液稀释后在高渗平板上长出来的菌落数。
1.3 培养基
1)细菌培养基:蛋白胨10 g/L,牛肉膏3 g/L,NaCl 5 g/L,调节pH至7.2~7.4。固体细菌培养基加入琼脂粉20~24 g/L。
2)高渗液体培养基:蛋白胨10 g/L,酵母浸出汁5 g/L,牛肉膏5 g/L,蔗糖170 g/L(0.5 mol/L),调节pH至7.2。高渗固体培养基加入琼脂粉20~24 g/L。
上述培养基均在高压灭菌锅中于121 ℃条件下灭菌20 min。
1.4 方法
将不同灭活方式处理后的两亲本原生质体各取1 mL于5 mL灭菌离心管中,混匀后3 800 r/min离心20 min,弃去上清液,加入新生磷酸钙溶液0.2 mL,摇匀,加入1.8 mL适当浓度的PEG(聚乙二醇)4 000,在不同温度下水浴保温不同时间,3 800 r/min离心10 min,弃去上清液,用SMM(磺胺间甲氧嘧啶钠)溶液定容至2 mL,并以SMM梯度稀释到适当浓度,吸取100 μL涂布于高渗固体培养基,每个梯度做3个平行,置于30 ℃恒温培养箱培养48 h,计融合子形成个数E,计算原生质体融合率,以检验融合效果。
原生质体融合率=(■)×100%
式中,E为融合处理后再生的细菌菌落数;F为两原生质体灭活处理后存活的平均菌落数;G为两亲本酶解前完全平板上平均菌落数;H为两原生质体灭活处理后未原生质体化的菌落數。
2 结果与分析
2.1 亲本灭活方式对原生质体融合的影响
为提高筛选效率,国内外学者陆续对灭活原生质体融合开展了研究,热灭活与紫外灭活成为各国学者主要选用的方法[16-19]。但就双亲均采用热灭活方式进行融合的这一方式存在一定的分歧,李佳玮等[20]成功以双亲热灭活融合出具有亲本有效性状的菌株,而国外部分学者认为双亲热灭活融合后能获得兼具亲本性状的菌株可能性较小[21]。因此,选用5种亲本灭活方式,对亲本灭活方式对原生质体融合的影响进行探索,寻求获得高融合率的亲本最优灭活方式。
由表1可知,双亲均采用热灭活或双亲分别采用热灭活与紫外灭活方式下,融合子的形成个数差异较大。在不同融合方式下形成融合子的融合率如图1所示,双亲采用热灭活方式,不同灭活温度条件的变化,其形成融合子的融合率均较低,不能达到较好的融合效果,而双亲株中,对F8原生质体采用45 ℃热灭活、T1原生质体紫外灭活后进行融合可达到31.97%的融合率。这与国外学者的研究结果相类似。
2.2 不同浓度的PEG溶液对原生质体融合的影响
PEG溶液的作用是在高渗条件下促使原生质体相互聚集、融合,其分为多种不同分子质量剂型,国内外学者一般采用的PEG剂型为4 000~6 000[22-24],选用分子质量6 000的PEG为促融剂,研究PEG不同浓度条件下对原生质体融合的影响,以融合率衡量融合效果。
由图2可知,过高浓度的PEG溶液会对细胞产生一定的毒性作用。40%~45%浓度的PEG溶液之间可能存在一个临界值,高于该值,原生质体可能会因为毒害作用导致死亡,造成原生质体融合率下降。PEG浓度在30%~40%之间时,原生质体融合率变化不大,略有减小趋势,这可能是30%的PEG溶液已经达到了比较好的融合效果,继续增加PEG浓度,其毒害作用会在一定程度上逐步体现,但并不是主流。为控制毒性作用,达到高融合率,本研究采用30%的PEG溶液作为最适浓度,进一步考虑其他因素对双效工程菌原生质体融合的影响。
2.3 pH对原生质体融合的影响
由图3可知,PEG溶液的酸碱度对融合效果影响较为明显,pH为8.0条件下的PEG溶液促融效果最好,可达26.78%,pH偏中性条件下PEG溶液促融效果较差,仅为4.83%~8.66%;pH偏碱条件下的PEG溶液促融效果较pH为8.0条件下有所降低,为10.83%~21.89%,明显优于偏中性条件,这可能是由原生质体的生理特性所决定的,原生质体由于其细胞壁的缺失,对外环境酸碱的适应性远不如双亲株细菌,因此,选用pH为8.0的30%PEG溶液为促融剂。
2.4 作用温度对原生质体融合的影响
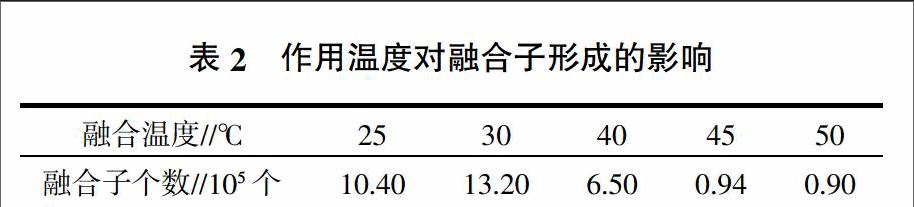
一定浓度条件下的PEG溶液在促进原生质体融合时,作用温度对原生质体融合存在一定的影响,结果见表2。
由表2可知,在30 ℃条件下,形成融合子个数最多,达1.32×106个,此条件下融合率可达28.17%。如图4所示,温度高于30 ℃的条件下,随着温度的升高,融合子个数急剧减少,融合率显著降低,在45~50 ℃时,融合率几乎为0;温度低于30 ℃时,融合子个数少于30 ℃时,融合率达20.50%。综合上述情况,30 ℃是pH为8.0、30%PEG溶液促融条件下较为适宜的作用温度。
3 小结
试验结果表明,不同的亲本原生质体灭活方式对原生质体融合产生较大的影响,不同浓度条件下的PEG溶液在促进原生质体融合时,作用的温度对原生质体融合存在影响。此外,PEG溶液的酸碱度也是影响融合的因素。对F8原生质体采用45 ℃热灭活、T1原生质体紫外灭活后,采用pH为8.0的30%PEG溶液,融合温度为30 ℃,可达到最佳双效工程菌原生质体融合的效果,原生质体融合率可达28.17%。本研究对于同步溶藻、藻毒素降解双效工程菌基础研究和双效工程菌剂的开发有一定的理论和参考价值。
参考文献:
[1] 杨明轩,游孟昊,王美文,等.葡萄糖浓度对细胞融合效果的影响[J].现代生物医学进展,2014,14(17):3236-3239.
[2] BADR-ELDEN A M,NOWER A A,NASR M I,et al. Isolation and fusion of protoplasts in sugar beet(Beta vulgaris L.)[J].Sugar Tech,2010,12(1):53-58.
[3] SAPIR A,AVINOAM O,PODBILEWICZ B,et al. Viral and developmental cell fusion mechanisms:Conservation and divergence[J].Developmental Cell,2008,14(1):11-21.
[4] 刘 勇,张德咏,谭新球,等.5种光合细菌种间原生质体融合及优良农用融合子的筛选鉴定[J].生命科学研究,2004,8(4):344-350.
[5] 刘晓瑜,章晓栋,魏永伟.偏肺病毒对副粘病毒细胞融合的新注释[J].微生物学报,2015,54(4):376-382.
[6] 纪敦敦,邱宏端,谢 航.采用原生质体融合技术选育提高氨氮降解效能的光合细菌[J].大连海洋大学学报,2011,26(5):407-413.
[7] 路玲玲,王 敏,朱会霞,等.原生质体融合构建耐高温高产酒精酵母[J].食品科学,2007,28(4):231-236.
[8] BRADBEER J F,HANCOCKS R,SPYROPOULOS F,et al. Self-structuring foods based on acid-sensitive low and high acyl mixed gellan systems to impact on satiety[J].Food Hydrocoll,2014,35:522-530.
[9] 李居宁,易庆平.青岛啤酒酵母和高浓酵母原生质体融合选育高浓酿造菌株[J].食品科学,2014,35(3):173-177.
[10] 褚洁洁,杜金华,李 红.利用雙亲灭活原生质体融合技术选育高效发酵啤酒酵母[J].酿酒科技,2015(12):15-18.
[11] 赵丽红,尹文利,刘 爽.原生质体融合技术在污水处理领域的应用[J].环境工程,2014,32(6):4-7.
[12] KAUR B,SHARMA M,SONI R,et al. Proteome-based profiling of hypercellulase-producing strains developed through interspecific protoplast fusion between Aspergillus nidulans and Aspergillus tubingensis[J].Applied Biochemistry and Biotechnology,2013,169:393-407.
[13] USHIJIMA S,NAKADAI T,UCHIDA K. Further evidence on the interspecific protoplast fusion between Aspergillus oryzae and Aspergillus sojae and Subsequent haploidization, with special reference to their production of some hydorolyzing enzyme[J].Agric Biol Chem,1990,54(9):2393-2399.
[14] 刘其友,李 政,张云波,等.原生质体融合技术提高微生物絮凝剂处理含油废水效果的研究[J].化学与生物工程,2010,27(10):69-72.
[15] KUMAR M,SINGH M P,TULI D K. Genome shuffling of Pseudomonas sp. ioca11 for improving degradation of polycyclic aromatic hydrocarbons[J].Advances in Microbiology,2012(2):26-30.
[16] 葛菁萍,安 琦,张玉环,等.灭活原生质体融合选育木糖、葡萄糖共发酵酿酒酵母工程菌[J].菌物学报,2014,33(1):87-96.
[17] 曾柏全,李 淼,冯金儒.双亲灭活青霉菌与枯草芽孢杆菌原生质体融合[J].中国食品学报,2015,15(6):45-50.
[18] 易 弋,黎 娅,程谦伟,等.双亲灭活原生质体融合选育高性能酒精酵母菌的研究[J].中国酿造,2012,31(4):75-78.
[19] 杨 健,姚 笛,王 颖,等.紫外诱变球毛壳霉原生质体选育木聚糖酶高产菌株[J].中国食品添加剂,2012(6):93-97.
[20] 李佳玮,张文琴,林 海,等.双亲灭活原生质体融合法选育阿维菌素高产菌株[J].沈阳药科大学学报,2006,23(5):320-323.
[21] URANO N,HIGASHIKAWA R,HIRAI H. Effect of mitochondria on electrofusion of yeast protoplasts[J].Enzyme and Microbial Technology,1998,23(1-2):107-112.
[22] 吴 萍,郭伟群,张娟琨,等.原生质体融合选育多杀菌素高产菌株[J].粮油食品科技,2012,20(3):46-49.
[23] 张 禹,毛淑红,路福平,等.原生质体融合技术选育分解草酸乳酸菌菌株的研究[J].生物技术通报,2013(1):186-190.
[24] HARA S,JIN F J,TAKAHASHI T,et al. A further study on chromosome minimization by protoplast fusion in Aspergillus oryzae[J].Molecular Genetics and Genomics,2012,287:177-187.

