响应面法优化毒三素链霉菌中利普司他汀的提取工艺
闫同顺,杨金艳,王 方,祝加男
(1.鲁南制药集团股份有限公司国家手性制药工程技术研究中心,山东临沂276006;2.临沂大学 生命科学学院,山东临沂276000)
响应面法优化毒三素链霉菌中利普司他汀的提取工艺
闫同顺1,杨金艳2,王 方1,祝加男1
(1.鲁南制药集团股份有限公司国家手性制药工程技术研究中心,山东临沂276006;2.临沂大学 生命科学学院,山东临沂276000)
采用响应面法对毒三素链霉菌提取工艺进行优化。首先确立乙醇为最佳的溶剂。以利普司他汀提取收率为指标,以乙醇为浸提溶剂,对料液比、乙醇体积分数、浸提时间、浸提温度和浸提次数进行单因素实验。在此基础上,选取料液比、乙醇体积分数、浸提时间为自变量,采用Box-Behnken设计的方法,研究各自变量及其交互作用对利普司他汀提取收率的影响。结果表明:毒三素链霉菌中利普司他汀的最佳提取工艺条件为液料比6.32∶ 1 mL/g、乙醇体积分数95%、浸提时间3.61 h。在此条件下,利普司他汀提取收率的预测值为83.35%,实验验证值为84.50%,相对误差为1.36%。
毒三素链霉菌;利普司他汀;提取;单因素优化;响应面分析
进入21世纪,由于人们物质生活水平的提高和饮食结构的不合理,肥胖症呈现年轻化和普遍化态势,严重影响人们的生活和健康。奥利司他(orlistat)商品名为赛尼可(Xenical),是瑞士Hoffmann-La Roche公司研发的一种非全身作用的、具有良好耐受性和有效性的新型减肥药物[1],能减少体内1/3脂肪的水解和吸收[2],是目前世界减肥流行的一个全新选择。
化学方法全合成奥利司他无成本优势,目前主要方法是将发酵法生产的利普司他汀氢化制备奥利司他[3]。利普司他汀作为一种脂肪酶抑制剂,最早在20世纪80年代由罗氏公司于1株毒三素链霉菌的变异株发酵液中发现[4-5]。经过对利普司他汀产生菌的诱变育种、高产菌株筛选和发酵工艺的研究[6-8],利普司他汀的发酵单位由当初的不足2 g/L提高至7 g/L以上的水平[9-10]。利普司他汀属于胞内产物[11],难溶于水,通过发酵液固液分离,得到含利普司他汀的菌丝体。然后,选择一种有机溶剂对菌体进行破壁提取,对影响提取收率的因素进行系统研究,这直接关系到下游产品的质量和整条工艺的总收率,有关这方面的研究报道较少。李玲等[11]利用甲醇超声破碎菌丝体,通过大孔树脂分离纯化利普司他汀,但甲醇收率低、毒性高。胡卫民等[12]和安鸿等[13]采用丙酮萃取与超声破碎菌体细胞的提取工艺,虽然收率高于甲醇,但所得产品纯度低、色素重,不利于后续工艺的继续纯化。
本文中,笔者在单因素实验[14]的基础上,利用响应面法[15-17],通过对乙醇浸提菌体时的不同影响因素进行优化研究,以确定最佳的提取工艺条件,为该工艺应用提供相关数据。
1 材料与方法
1.1 材料、试剂与仪器
菌体的获得:毒三素链霉菌发酵液由笔者所在发酵工程实验室(生工五室)发酵而得,向发酵液中加入浓盐酸调pH 3~4,加入发酵液体积8%的珍珠岩助滤剂,过滤得含利普司他汀的菌体;利普司他汀对照品(色谱纯度90%),实验室自制;甲醇、丙酮、乙醇(分析纯),西陇化工股份有限公司;乙腈(色谱纯),国药集团化学试剂有限公司。
Agilent 1100型 高效液相色谱仪,Agilent Technologies;SHB-B88 型水循环真空泵,郑州长城科工贸有限公司;100 mm布氏漏斗、500 mL抽滤瓶,蜀牛玻璃仪器有限公司;HZQ-QX全温振荡器,哈尔滨东联电子科技有限公司;JY92-Ⅱ D 型超声波细胞粉碎机,宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 菌体浸提方法及溶剂的确定
取15 g菌体,置于250 mL三角瓶中,按照质量体积比(g/mL)1∶ 5的比例分别向其中加入甲醇、丙酮和乙醇,每种溶剂重复处理3次。密封后,放入摇床,于200 r/min振摇2 h,布氏漏斗过滤,得利普司他汀浸提滤液。
1.2.2 利普司他汀的分析方法
将溶剂浸提所得利普司他汀滤液用乙腈稀释10倍,过0.22 μm滤膜后,直接进样。色谱条件:色谱柱 C-18柱(4.6 mm×250 mm,5 μm);流动相V(乙腈)∶V(85%磷酸)∶V(水)=860∶ 0.05∶ 140;检测波长210 nm;进样量5 μL;流速1.5 mL/min;柱温30 ℃。
1.2.3 利普司他汀提取收率的计算
取1 g菌体,置于25 mL的容量瓶中,加入20 mL丙酮,于超声波细胞粉碎机100 W、30 ℃超声30 min,再次加入丙酮定容,取样,过0.22 μm有机滤膜,进样作高效液相色谱(HPLC)分析,按外标法依据对照品标线计算利普司他汀浓度,从而得出1 g菌饼中利普司他汀的含量,将其记为A,则待测菌饼质量X克时,计算出的利普司他汀浓度为B,滤液体积为V时,按式(1)计算提取收率。
提取收率=[(BV)/(XA)]×100%
(1)
1.2.4 单因素实验
以乙醇为浸提溶剂,分别考察温度、液料比、溶剂浓度、浸提时间和浸提次数等因素对利普司他汀提取收率的影响。
1.2.5 响应面法实验
响应面分析法是利用合理的设计并通过实验得到一定数据,采用多元二次逐步回归方程拟合因素与响应值之间的函数关系,通过回归方程分析寻找最佳工艺参数,解决多变量问题的一种统计方法[18]。结合单因素影响实验结果,采用Box-Behnken实验设计,选取液料比X1、乙醇体积分数X2、浸提时间X33个主要影响因素,在单因素实验结果基础上,采用三因素三水平的响应面分析方法,以-1、0、+1代表变量的水平,按方程xi=(Xi-X0)/ΔX对自变量进行编码,式中:xi为变量的编码值,Xi为变量的真实值,X0为实验中心点变量的真实值,ΔX为变量的变化步长,利普司他汀提取收率Y为响应值。
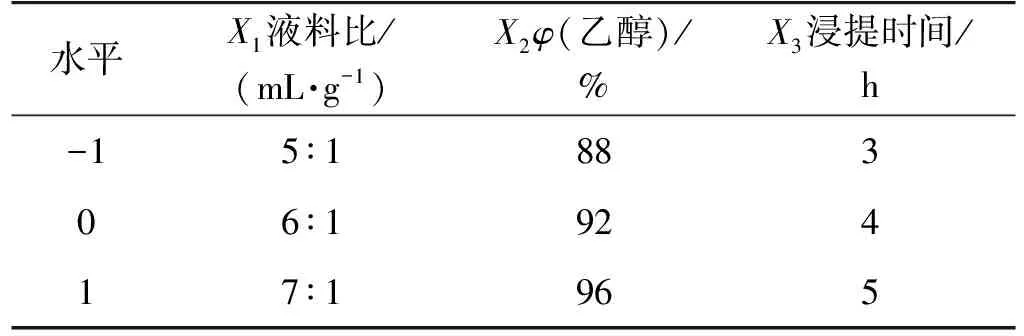
表1 Box-Behnken设计因素与水平
2 结果与讨论
2.1 浸提溶剂的选择
甲醇、乙醇和丙酮3种溶剂对菌体进行浸提处理,得到利普司他汀的浸提收率分别为86%、83%和88%,利普司他汀的纯度分别为88%、90%和85%。尽管丙酮浸提收率高,但纯度低,可能是丙酮破坏菌体细胞壁,提取产品的同时,也浸提出了更多的杂质。从溶剂毒性大小、产品质量和环境兼容性角度考虑,选择乙醇浸提菌体,作为实验溶剂进行后续研究。
2.2 单因素实验结果及分析
2.2.1 温度对利普司他汀提取收率的影响
在固定液料比3∶ 1 (mL/g)、乙醇体积分数90%、浸提时间2 h、提取次数1次的条件下,考察温度对利普司他汀提取收率的影响,结果见图1。
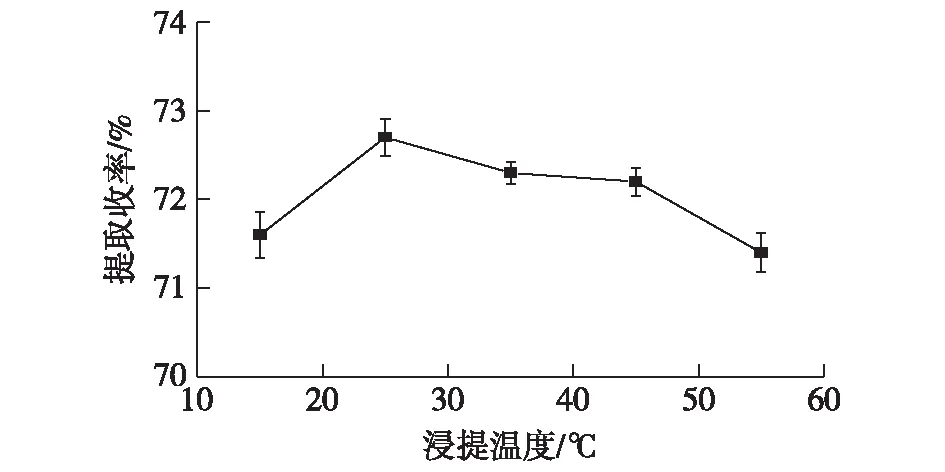
图1 浸提温度对利普司他汀提取收率的影响Fig.1 Effect of extraction temperature on extraction rate of lipstatin
由图1可知:在实验温度范围内,利普司他汀的提取收率变化不大,在15~25 ℃时,利普司他汀的提取收率逐步增加,但随着温度由25 ℃升至55 ℃,利普司他汀提取收率呈缓慢的下降趋势。这是因为利普司他汀属于内酯类化合物,温度升高,加剧了产品的水解反应,使利普司他汀浓度减小。因此,25 ℃为利普司他汀的最佳提取温度。
2.2.2 液料比对利普司他汀提取收率的影响
在固定温度25 ℃、乙醇体积分数90%、浸提时间2 h、提取次数1次条件下,考察液料比对利普司他汀提取收率的影响,结果见图2。

图2 液料比对利普司他汀提取收率的影响Fig.2 Effect of solvent/material ratio on extraction rate of lipstatin
由图2可知:液料比的增加,有利于利普司他汀提取收率的增加,当液料比增加至6∶ 1 mL/g时,提取收率已接近最大值;再继续增加料液比,利普司他汀提取收率略为降低,这可能是因为增加乙醇体积的同时,体系中的水量也增多,致使产品水解。因此,从成本角度及后续工艺处理的要求考虑,选择6∶ 1 mL/g为最佳的液料比。
2.2.3 浸提时间对利普司他汀提取收率的影响
在固定液料比6∶ 1 mL/g、温度25 ℃、乙醇体积分数90%、提取次数1次的条件下,考察浸提时间对利普司他汀提取收率的影响,结果见图3。
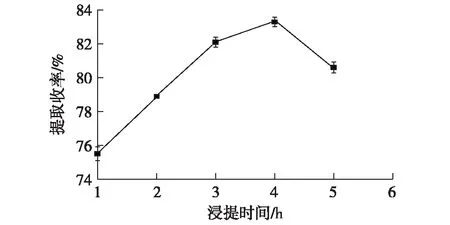
图3 浸提时间对利普司他汀提取收率的影响Fig.3 Effect of extraction time on extraction rate of lipstatin

2.2.4 乙醇体积分数对利普司他汀提取收率的影响
在固定液料比6∶ 1 mL/g、温度25 ℃、浸提时间4 h、提取次数1次的条件下,考察乙醇体积分数对利普司他汀提取收率的影响,结果见图4。

图4 乙醇体积分数对利普司他汀提取收率的影响Fig.4 Effect of ethanol concentraion on extraction rate of lipstatin
由图4可知:乙醇体积分数对利普司他汀提取收率影响十分显著。随着乙醇体积分数的增加,利普司他汀提取收率迅速增加,至乙醇体积分数95%时,利普司他汀提取收率达84%,再增加乙醇体积分数至99%,利普司他汀提取收率为83.8%。从成本角度考虑,选择95%的乙醇为最佳浸提浓度。
2.2.5 浸提次数对利普司他汀提取收率的影响
在固定液料比6∶ 1 mL/g、温度25 ℃、浸提时间4 h、乙醇体积分数95%的条件下,考察浸提次数对利普司他汀提取收率的影响,结果见图5。
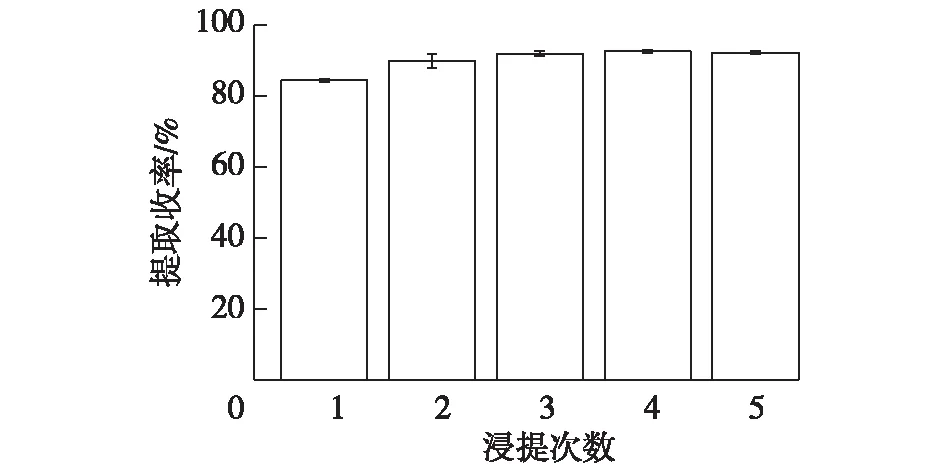
图5 浸提次数对利普司他汀提取收率的影响Fig.5 Effect of extraction number on extraction rate of lipstatin
由图5可知:乙醇浸提1次,利普司他汀提取收率达到84.5%,乙醇浸提2次,利普司他汀提取收率可达90%,再增加浸提次数,利普司他汀提取收率变化不明显。从简化工艺、节约溶剂用量角度考虑,选择乙醇浸提1次菌体,比较有利于利普司他汀后续的分离纯化和质量保证。
2.3 响应面实验结果分析
2.3.1 响应面优化的实验结果
选择对提取收率影响较为明显的3个因素:液料比(x1)、乙醇体积分数(x2)、浸提时间(x3)为主要考察因素,每个因素选3个水平,以提取收率为响应值,进行Box-Behnken实验设计,结果见表2。
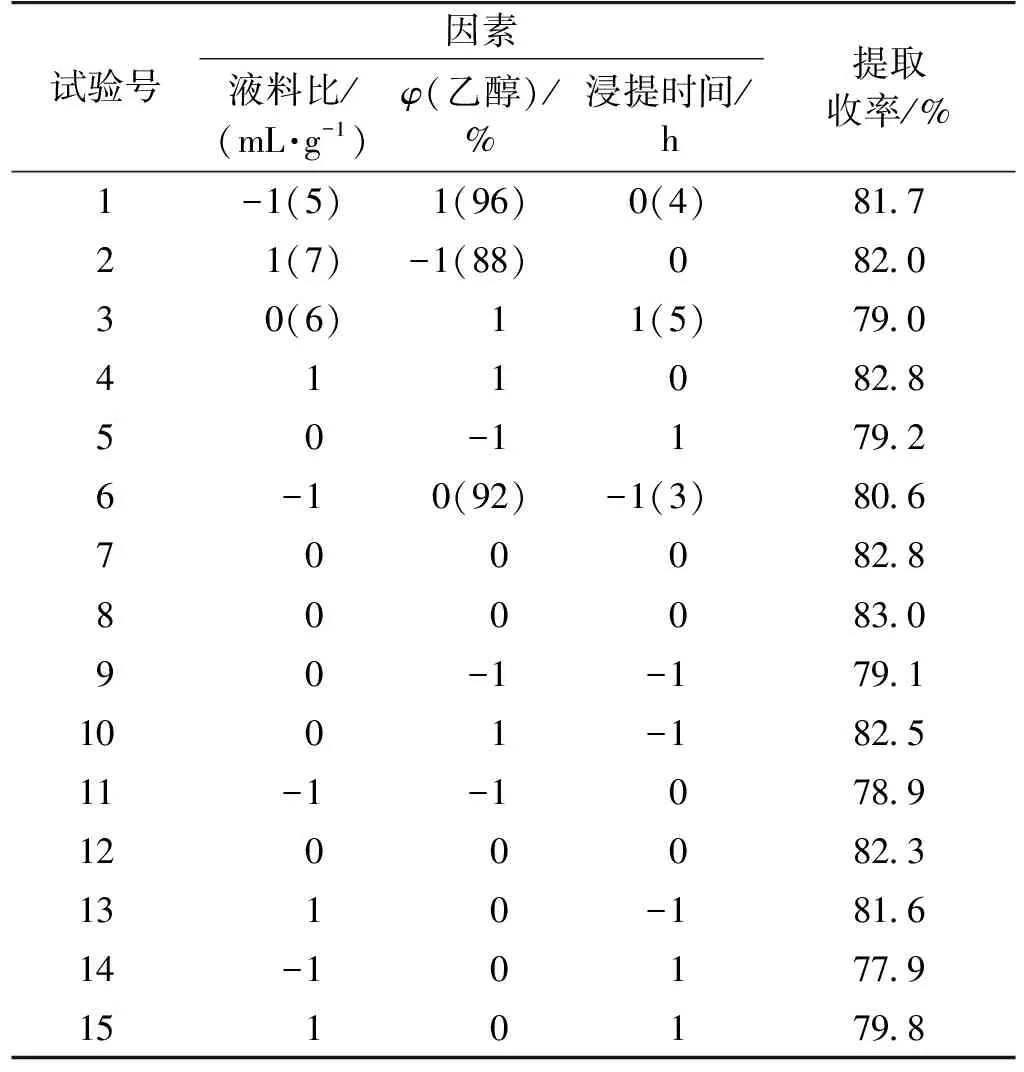
表2 Box-Behnken设计与结果
2.3.2 模型的建立及显著性检验
利用Design-Expert 8.0.6软件对表2实验数据进行多元回归拟合,得到利普司他汀提取收率(Y)对液料比(x1)、乙醇体积分数(x2)、提取时间(x3)的二次多项回归模型为
对该模型进行方差分析,结果见表3。从表3可以看出:F值=36.21,P<0.000 1,表明模型高度显著。3个因素的显著性排序(从大到小)为浸提时间、液料比、乙醇体积分数。该模型的调整确定系数R2= 0.957 7,说明模型能够解释95.77%的响应值变化。因此,模型拟合程度良好,可以用此模型对毒三素链霉菌中利普司他汀的提取收率进行分析和预测。
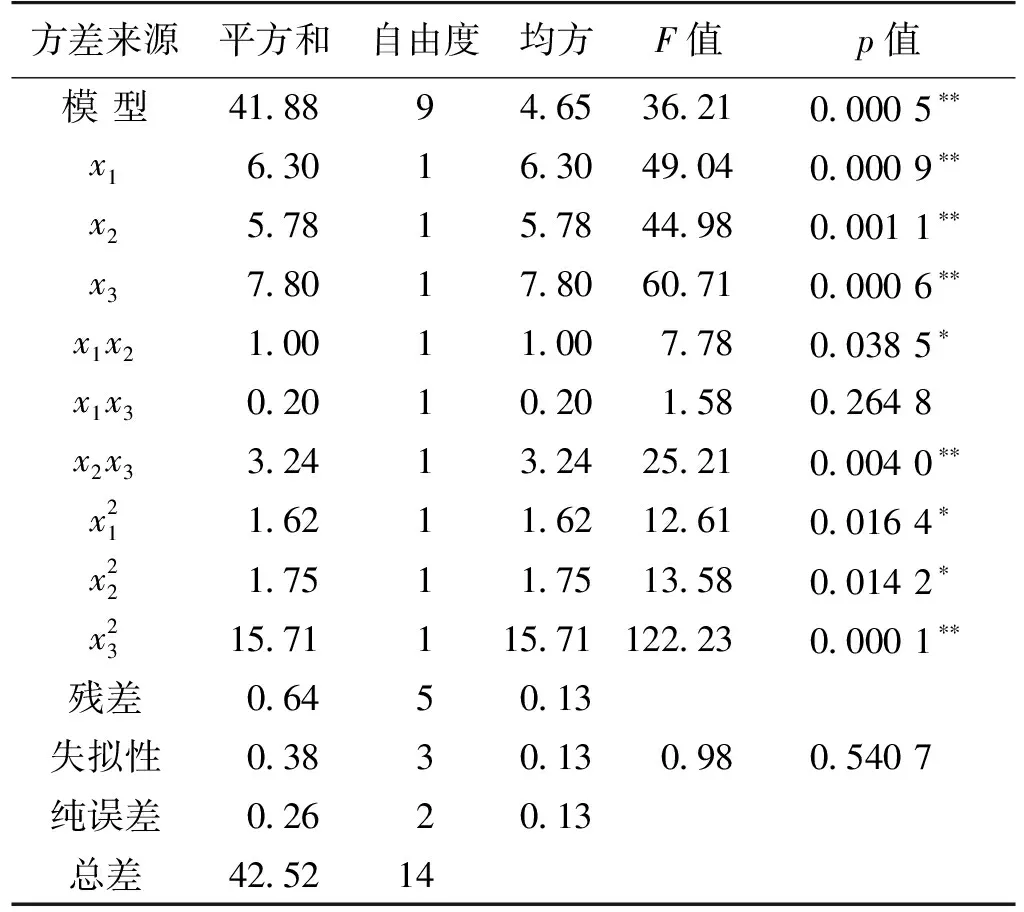
表3 拟合二次多项式模型的方差分析
注:**表示极显著水平(p<0.01);*表示显著水平(p<0.05)。
2.3.3 利普司他汀提取工艺的响应面分析与优化
图6~8是响应面优化结果3D图。由图6可知:随着液料比(X1)的不断加大和乙醇体积分数(X2)的不断提高,利普司他汀提取收率逐步增加,当到达最高点之后,再增加液料比和乙醇体积分数,提取收率变化趋于平稳。由图7浸提时间(X3)曲面斜率大于液料比(X1)曲面斜率可知,浸提时间对利普司他汀提取收率的影响大于液料比对提取收率的影响。由图8可见:利普司他汀提取收率的大小受到浸提时间(X3)和乙醇体积分数(X2)的共同影响。随着浸提时间的延长,提取收率先增加,后减少。而随着乙醇体积分数增加,提取收率迅速增加,之后变化很小。
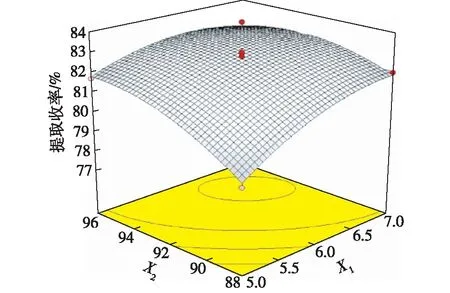
图6 提取收率与X1和X2的关系Fig.6 Effects of X1 and X2 on extraction rate of lipstatin

图7 提取收率与X1和X3的关系Fig.7 Effects of X1and X3 on extraction rate of lipstatin
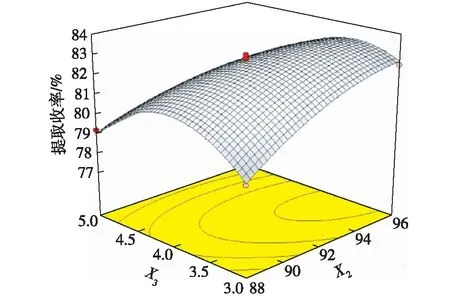
图8 提取收率与X2和X3的关系Fig.8 Effects of X2 and X3 on extraction rate of lipstatin
通过对回归模型求解,得出利普司他汀浸提收率最大值83.35%,此时x1=0.32、x2=0.76、x3=-0.39,液料比为6.32∶ 1 (mL/g)、乙醇体积分数为95%、浸提时间为3.61 h。
2.3.4 验证试验
在最优条件下进行试验验证,利普司他汀提取收率的平均值为83.35%,回归方程所得的利普司他汀提取收率的预测值为84.5%,相对误差为1.36%,说明回归方程能较好地反映各因素对提取收率的影响,证明应用响应面法在利普司他汀提取收率中所建的回归模型较可靠。
3 结论
首先通过甲醇、丙酮和乙醇3种溶剂对利普司他汀的提取收率及产品纯度考察,确立乙醇为最佳实验浸提溶剂。然后,通过单因素和响应面法优化试验,确定了毒三素链霉菌中利普司他汀的最佳提取工艺条件:液料比6.32∶ 1 mL/g、乙醇体积分数95%、浸提时间3.61 h、浸提温度25 ℃、浸提次数1次,在该条件下,利普司他汀提取收率的平均值为83.35%。该研究结果为利普司他汀提取工艺的生产放大提供了有力参考,具有较强的应用价值。
[1] 马维,付丽,王海波,等.新型减肥药奥利司他的研究进展[J].华西药学杂志,2009,24(4):431-433.
[2] ZHI J,MULLIGAN T E,HAUPTMAN J B.Long-term systemic exposure of orlistat,a lipase inhibitor,and its metabolites in obese patients[J].J Clin Pharmacol,1999,39(1):41-46.
[3] 赵志全,董惠均,隋华芹.一种制备高纯度奥利司他的方法:201110199143.6[P].2012-01-04.
[4] WEIBEL E K,HADVARY P,HOCHULI E,et al.Lipstatin,an inhibitor of pancreatic lipase,produced byStreptomycestoxytricini:Ⅱ.chemistry and structure elucidation[J].J Antibiot (Tokyo),1987,40(8):1086-1091.
[5] PAUL H,ERICH H,ERNST K,et al.Leucine derivatives:EP,129748[P].1985-01-02.
[6] 黄娟,陈正杰,冯军,等.紫外和微波结合诱变选育lipstatin产生菌[J].中国医药工业杂志,2006,37(1):12-14.
[7] 颜振,李海军,朱希强,等.Lipstatin发酵工艺的优化[J].食品与药品,2007,9(12):5-7.
[8] 董惠钧,姜俊云,陈芳.添加生物素和ATP对毒三素链霉菌脂类和利普斯他汀合成的影响[J].中国医药工业杂志,2014,45(1):19-24.
[9] 朱美容,许勇煌,王德刚.RP-HPLC测定利普司他汀的含量[J].今日药学,2013,23(11):720-722.
[10] 赵志全,刘茂田.一种发酵生产利普司他汀的方法及其培养基:201110207208.7[P].2011-12-07.
[11] 李玲,王艳,张征林.大孔树脂分离纯化利普司他汀[J].化工时刊,2013,27(2):25-28.
[12] 胡为民,庄英萍,王永红,等.毒三素链霉菌生产利普司他汀的发酵与提取工艺[J].中国医药工业杂志,2007,38(10):705-708.
[13] 安鸿,尹海滨.一种利普司他汀生产工艺:201210494679.5[P].2013-03-13.
[14] 张秀芬,陈金妹,姚丽云,等.白芽奇兰茶多酚的提取工艺及其抗氧化活性[J].生物加工过程,2016,14(4):48-54.
[15] ZHONG K,WANG Q.Optimization of ultrasonic extraction of polysaccharides from dried longan pulp using response surface methodology[J].Carbohydr Polym,2010,80(1):19-25.
[16] 赵国振,熊向峰,陈朝银,等.马铃薯淀粉同步糖化发酵制备L-乳酸条件的统计学优化[J].生物加工过程,2010,8(4):6-11.
[17] 赖颖,赵锦慧,陈茹.响应面法优化超声波法提取红枣多糖工艺[J].生物加工过程,2015,13(5):42-46.
[18] CAI W R,GUX H,TANG J.Extraction,purification,and characterization of the polysaccharides fromOpuntiamilpaalta[J].Carbohydr Polym,2007,71(3):403-410.
(责任编辑 荀志金)
Optimization of lipstatin extraction fromStreptomycestoxytriciniby response surface methodology
YAN Tongshun1,YANG Jinyan2,WANG Fang1,ZHU Jianan1
(1.National Engineering Research Center of Chiral Drugs,Lunan Pharmaceutical Group Corporation, Linyi 276006,China; 2.School of Life Science,Linyi University,Linyi 276000,China)
Response surface methodology was used to optimize the extraction conditions of lipstatin fromStreptomycestoxytricini.First,ethanol was established as the best solvent.The extraction yield of lipstatin was the index,ratio of solid to solvent,ethanol concentration,extraction time,extraction temperature and extraction numbers were studied as factors by extraction solvent ethanol.Based on the single factor experiments,the effects of ratio of solid to solvent,ethanol concentration,extraction time,as well as their interactions on extraction yield of lipstatin were studied by Box-Behnken design.The optimal extraction conditions of lipstatin fromStreptomycestoxytriciniwere as follows: the ratio of solid to solvent was 6.32∶ 1 mL/g,ethanol concentration was 95%,extraction time was 3.61 h.Under these conditions,the model-predicted and experimental values of lipstatin yield were 83.35% and 84.50%,respectively,revealing 1.36% relative error between them.
Streptomycestoxytricini; lipstatin; extraction; single factor optimization; respose surface analysis
10.3969/j.issn.1672-3678.2017.01.010
2016-10-19
国家科技支撑计划(2014BAI16B01)
闫同顺(1977—),男,山东昌乐人,高级工程师,研究方向:生化药物的分离、纯化,E-mail:yantongshun@lunan.cn
Q936; TQ464
A
1672-3678(2017)01-0063-06

