谷氨酰胺对脂多糖诱导的断奶仔猪氧化应激的影响
李 欢 黄 牛 何流琴 田军权 伍小松* 姚 康,2*
(1.湖南农业大学动物科技学院,长沙410128;2.中国科学院亚热带农业生态研究所,中国科学院亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测实验站,长沙410125;3.中国科学院大学,北京100049)
谷氨酰胺对脂多糖诱导的断奶仔猪氧化应激的影响
李 欢1黄 牛1何流琴2,3田军权2,3伍小松1*姚 康1,2*
(1.湖南农业大学动物科技学院,长沙410128;2.中国科学院亚热带农业生态研究所,中国科学院亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测实验站,长沙410125;3.中国科学院大学,北京100049)
本试验以大肠杆菌型脂多糖(LPS)建立氧化应激模型,探讨了谷氨酰胺(GLN)对断奶仔猪氧化应激的影响。选用24头28日龄的健康三元(杜×长×大)断奶仔猪,随机分成3组,每组8个重复,每个重复1头猪。对照组和应激组饲喂基础饲粮,GLN组饲粮在基础饲粮中添加1% GLN,试验期为30 d。在试验第22、25、28和30天,应激组和GLN组仔猪分别按每千克体重腹腔注射100 μg LPS,对照组仔猪腹腔注射相同剂量的灭菌生理盐水,第30天进行前腔静脉采血并屠宰采取所需肠道样品,检测氧化应激相关指标。结果显示:1)LPS攻毒前各组血清抗氧化能力指标均无显著差异(P>0.05)。LPS攻毒后,应激组血清丙二醛(MDA)含量显著高于对照组(P<0.05);GLN组血清MDA含量和超氧化物歧化酶(SOD)活性显著低于应激组和对照组(P<0.05)。2)LPS攻毒后,在十二指肠黏膜中,GLN组过氧化氢酶(CAT)和锌铜超氧化物歧化酶(CuZuSOD)基因相对表达量显著高于应激组(P<0.05)。在空肠黏膜中,GLN组CAT、锰超氧化物歧化酶(MnSOD)、谷胱甘肽过氧化物酶1(GPX1)和谷胱甘肽过氧化物酶4(GPX4)基因相对表达量显著高于对照组和应激组(P<0.05),对照组GPX4基因相对表达量显著高于应激组(P<0.05)。在回肠黏膜中,GLN组和应激组CAT基因相对表达量显著低于对照组(P<0.05),GPX4基因相对表达量显著高于对照组(P<0.05);GLN组MnSOD基因相对表达量显著高于对照组和应激组(P<0.05),CuZnSOD基因相对表达量显著高于对照组(P<0.05)。结果表明,GLN在一定程度上可以缓解断奶仔猪因LPS引起的氧化应激,以期为实际生产中减少氧化应激提供一定的理论基础。
谷氨酰胺;断奶仔猪;脂多糖;氧化应激;抗氧化能力
在仔猪饲养过程中,饲养管理水平、环境以及细菌和病毒感染等因素均会刺激仔猪产生应激,这些应激不仅会影响仔猪的正常生长发育,而且会影响其本身固有的免疫功能以及宰后肉质特性[1]。发生氧化应激时,动物对能量的需求量增大,机体会产生大量自由基,而这些过多的自由基会导致核酸和蛋白质的氧化,并通过脂质过氧化反应损伤生物膜,从而破坏肠黏膜的完整性及功能,进而降低仔猪的生长性能和免疫功能[2-4]。谷氨酰胺(GLN)作为人体以及其他哺乳动物血清中一种非常重要的且含量最丰富的游离氨基酸,在生物体代谢中起着至关重要的作用,具有抗应激、抗感染、抗氧化和增强免疫力等功能[5]。研究指出,在生物体中GLN可以维持和提高组织细胞内的谷胱甘肽(GSH)含量,从而清除各种自由基和过氧化物对细胞的损害,维持机体内环境的稳态[6]。研究也表明,高温条件下饲粮中添加GLN可显著提高黄羽肉鸡血液中谷胱甘肽过氧化物酶(GSH-Px)活性,显著降低血液中丙二醛(MDA)含量,从而提高机体的抗氧化能力[7]。虽然GLN有水溶解率不高、易转化为氨和焦谷氨酸等缺点,但其具有独特的抗氧化能力,使其在实际生产中的应用比较广泛。有关GLN提高动物机体抗氧化能力的机理尚不明确,特别是对断奶仔猪氧化应激的影响研究甚少。因此,本研究通过腹腔注射细菌脂多糖(LPS)建立仔猪氧化应激模型,探讨GLN对早期断奶仔猪氧化应激的影响,以期为揭示GLN提高动物机体抗氧化能力的机理提供一定的理论依据。
1 材料与方法
1.1 试验材料
GLN购自武汉远成共创科技有限公司,有效成分含量为99.5%;试验用细菌LPS购自美国Sigma Chemical公司,型号为大肠杆菌血清型(O55∶B5);RNA抽提试剂Trizol购自Invitrogen公司。
1.2 试验动物与饲养管理
选取28日龄、初始体重为(6.24±0.25) kg的健康三元杂交(杜×长×大)断奶仔猪24头(公母各占1/2),随机分成3组,每组8个重复,每个重复1头猪。对照组和应激组饲喂基础饲粮,GLN组饲粮在基础饲粮中添加1% GLN。试验期为30 d。基础饲粮按照NRC(2012)饲养标准配制,试验饲粮组成及营养水平见表1。试验第22、25、28和30天时,应激组和GLN组仔猪分别按每千克体重腹腔注射100 μg LPS,对照组仔猪腹腔注射相同剂量的灭菌生理盐水[3-4]。试验在中国科学院亚热带农业生态研究所动物房进行,仔猪采用单笼饲养,免疫消毒程序按照猪场常规程序进行,试验期间记录采食量、体重。每天喂食3次,时间分别为07:30、12:00和18:30,自由采食和饮水,粉料饲喂,以食槽无剩料为原则。每天清扫圈舍2次,保持圈内清洁。整个圈舍采取自然通风,在养殖期间所有圈舍进行不定期消毒。

表1 试验饲粮组成与营养水平(风干基础)

续表1项目Items基础饲粮Basaldiet谷氨酰胺饲粮GLNdiet抗氧化剂Antioxidant0.050.05防霉剂Fungicide0.100.10合计Total100.00100.00营养水平Nutrientlevels2)消化能DE/(MJ/kg)14.0214.05粗蛋白质CP20.0020.00赖氨酸Lys1.551.55蛋氨酸Met0.650.65苏氨酸Thr0.950.95色氨酸Trp0.250.25钙Ca0.750.75有效磷AP0.300.30
1)预混料为每千克饲粮提供 Premix provided the following per kg of diets:MgSO4·H2O 150.0 mg,FeSO4·7H2O 100.0 mg,CuSO4·5H2O 150.0 mg,MnSO4·H2O 40.0 mg,ZnSO4·H2O 100.0 mg,Na2SeO30.3 mg,KI 0.5 mg,CoCl2·6H2O 30.0 mg,VA 10 800 IU,VD 34 000 IU,VE 40 IU,VK 3.4 mg,VB11.6 mg,VB212 mg,VB66 mg,VB120.05 mg,生物素 biotin 0.2 mg,叶酸 folic acid 2 mg,烟酸 niacin 50 mg,D-泛酸钙D-calcium pantothenate 25 mg。
2)营养水平为计算值。Nutrient levels were calculated values.
1.3 样品的采集
试验仔猪在第1次注射LPS(或生理盐水)前和最后1次注射LPS(或生理盐水)后进行前腔静脉采血,采血10 mL,常温静置15 min,然后以3 000 r/min离心15 min分离制备血清,-80 ℃保存待测。最后1次注射LPS(或生理盐水)12 h后空腹屠宰仔猪,取肠道(十二指肠、空肠、回肠),用剪刀轻轻剖开10 cm左右的十二指肠、空肠和回肠肠段,用冰生理盐水轻轻冲洗肠壁内容物,并用滤纸吸干肠段表面的水分,而后用玻璃载玻片刮取肠黏膜,使用锡箔纸将样品进行包裹,立即放入液氮中速冻,然后转移至-80 ℃冰箱中保存待测[8]。
1.4 测定指标与方法
1.4.1 血清抗氧化指标
血清过氧化氢酶(CAT)、GSH-Px、超氧化物歧化酶(SOD)活性、总抗氧化能力(T-AOC)和MDA含量均采用比色法测定,试剂盒均购自南京建成生物工程研究所。
1.4.2 引物设计
根据GenBank上猪的相关基因序列,以Primer premier 5.0软件设计CAT、锰超氧化物歧化酶(MnSOD)、锌铜超氧化物歧化酶(CuZuSOD)、谷胱甘肽过氧化物酶1(GPX1)和谷胱甘肽过氧化物酶4(GPX4)基因序列的引物,并选取β-肌动蛋白(β-actin)作为内参基因。用NCBI数据库中的Primer-Blast (http://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHome)工具确认引物的特异性。本试验所用引物均由上海生工工程技术服务有限公司合成,实时荧光定量PCR(RT-qPCR)引物序列见表2。
1.4.3 小肠黏膜氧化应激相关基因的表达
1.4.3.1 总RNA提取和反转录反应
使用RNAios Plus(TaKaRa,9109)试剂提取总RNA,使用超微量紫外分光光度计(ND2000,美国NnaoDro)测定总RNA的纯度和浓度。OD260 nm/OD280 nm在1.8~2.2的RNA纯度较好。将纯度较好的RNA经1%琼脂糖凝胶电泳后,以28S rRNA和18S rRNA的灰度值比为2∶1为依据,评判提取的RNA的质量。使用TaKaRa反转录试剂盒(TaKaRa,RR047A)对提取的RNA进行反转录合成cDNA。
1.4.3.2 实时荧光定量PCR


表2 引物序列
1.5 统计分析
实时荧光定量数据采用2-△△Ct法计算基因的相对表达量[9]。所有数据采用SPSS 13.0软件进行单因素方差分析(one-way ANOVA),差异显著采用Duncan氏法进行多重比较,P<0.05为差异显著。所有数据均以“平均值±标准差”表示。
2 结 果
2.1 GLN对断奶仔猪血清抗氧化能力的影响
由表3可知,LPS攻毒前各组血清抗氧化能力指标均无显著差异(P>0.05)。由表4可知,LPS攻毒后,应激组血清MDA含量显著高于对照组(P<0.05),GLN组血清MDA含量显著低于应激组和对照组(P<0.05);对照组与应激组血清SOD活性无显著差异(P>0.05),但GLN组血清SOD活性显著低于对照组和应激组(P<0.05);各组血清GSH-Px、CAT活性和T-AOC均无显著差异(P>0.05),但GLN组血清GSH-Px和CAT活性均低于对照组和应激组,血清T-AOC高于对照组和应激组。
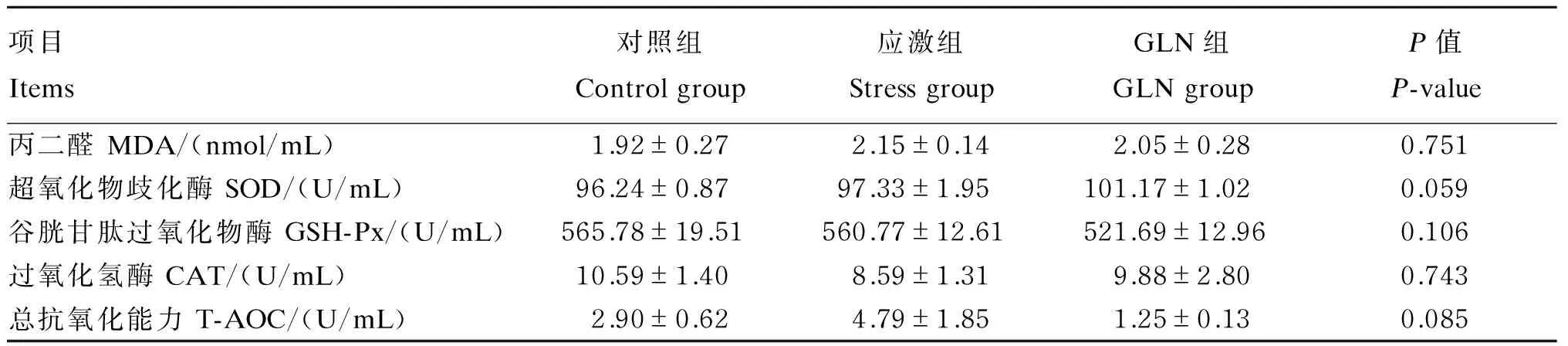
表3 LPS攻毒前GLN对断奶仔猪血清抗氧化能力的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.2 GLN对断奶仔猪小肠黏膜氧化应激相关基因表达的影响
由表5可知,LPS攻毒后,在十二指肠黏膜中,GLN组CAT和CuZnSOD基因相对表达量显著高于应激组(P<0.05),但与对照组无显著差异(P>0.05);各组MnSOD、GPX1和GPX4基因相对表达量无显著差异(P>0.05),但GLN组MnSOD、GPX1和GPX4基因相对表达量均高于应激组。

表4 LPS攻毒后GLN对断奶仔猪血清抗氧化能力的影响
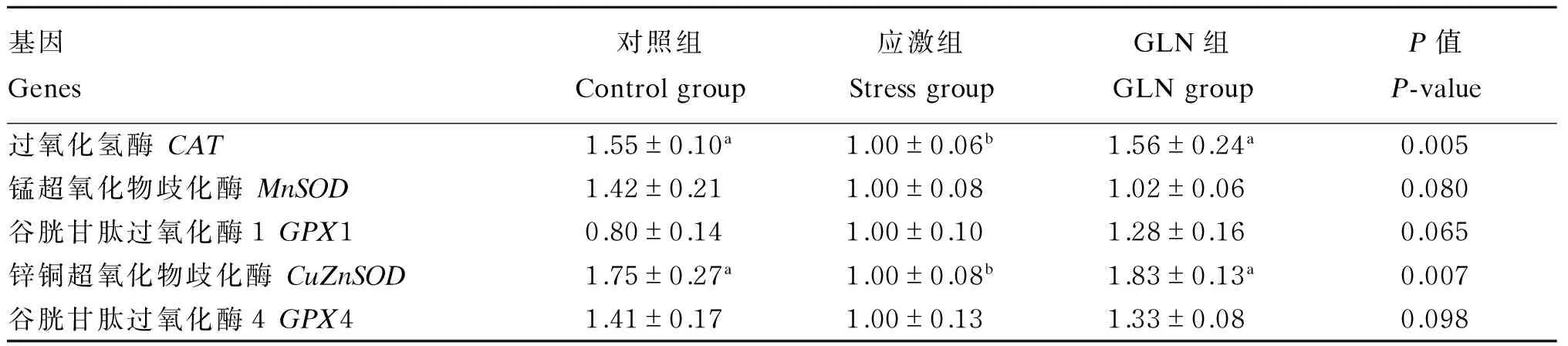
表5 GLN对断奶仔猪十二指肠黏膜氧化应激相关基因表达的影响
由表6可知,LPS攻毒后,在空肠黏膜中,GLN组CAT、MnSOD和GPX1基因相对表达量最高,显著高于对照组和应激组(P<0.05),且应激组CAT、MnSOD和GPX1基因相对表达量最低;各组CuZnSOD基因相对表达量无显著差异(P>0.05),
但GLN组CuZnSOD基因相对表达量高于对照组和应激组;GLN组GPX4基因相对表达量显著高于对照组和应激组(P<0.05),对照组GPX4基因相对表达量显著高于应激组(P<0.05)。

表6 GLN对断奶仔猪空肠黏膜氧化应激相关基因表达的影响
由表7可知,LPS攻毒后,在回肠黏膜中,GLN组和应激组CAT基因相对表达量显著低于对照组(P<0.05);GLN组MnSOD基因相对表达量最高,显著高于对照组和应激组(P<0.05);各组GPX1基因相对表达量无显著差异(P>0.05);GLN组CuZnSOD基因相对表达量显著高于对照组(P<0.05);GLN组和应激组GPX4基因相对表达量显著高于对照组(P<0.05)。
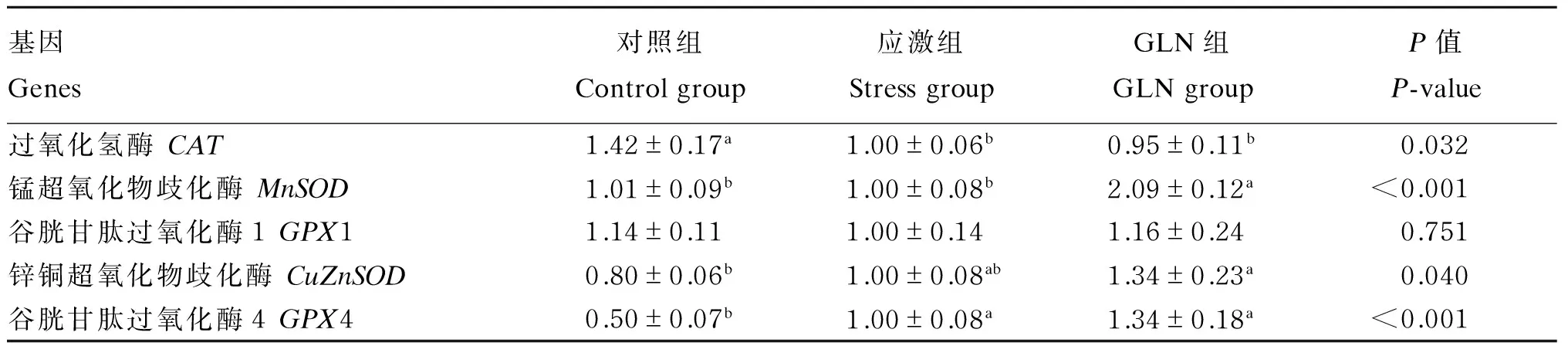
表7 GLN对断奶仔猪回肠黏膜氧化应激相关基因表达的影响
3 讨 论
3.1 GLN对断奶仔猪血清抗氧化指标的影响
众多研究表明,MDA、SOD、GSH-Px、CAT和T-AOC等均属于动物机体内抗氧化系统的组成成员。MDA是脂质过氧化反应链式终止阶段产生的小分子产物,其含量可以间接反映自由基的产生情况和机体组织细胞的脂质过氧化程度。SOD是生物体内重要的抗氧化酶,具有比较特殊的生理活性,是生物体内清除自由基的首要物质,其功能是催化超氧离子自由基的歧化反应,并且它可对抗与阻断氧自由基对细胞造成的损害,及时修复受损细胞,恢复自由基造成的机体细胞的损害。CAT的功能主要是促使过氧化氢(H2O2)分解为分子氧和水,清除体内的H2O2,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一。GSH-Px是机体内广泛存在的一种催化H2O2分解的重要酶,能特异性地催化GSH对H2O2的还原反应,催化GSH和H2O2反应生成水,从而可以减轻细胞膜多不饱和脂肪酸的过氧化作用,减少自由基的产生,起到保护细胞膜结构和功能完整的作用[10-11]。研究显示,GLN作为合成机体中抗氧化物质GSH的原料,能够维持和提高机体还原型GSH的水平,促进还原型GSH合成GSH-Px的前体物[12],从而达到清除机体自由基的目的。研究也表明内毒素能降低SOD、CAT和GSH-Px活性[13-15]。
本研究显示,LPS攻毒前各组血清抗氧化能力指标均无显著差异,而LPS攻毒后,应激组血清MDA含量较对照组显著升高,而SOD、CAT活性和T-AOC较对照组有降低趋势。这一结果与上述研究结果相一致,可能是由于LPS应激条件下断奶仔猪体内合成GSH-Px的效率降低,故需要外源性补充以满足正常需求。Denno等[16]报道,饲粮补充GLN可显著提高大鼠血清GSH含量。边连全等[17]研究表明,外源补充GLN能够显著提高肠黏膜中GSH含量和CAT活性,但降低了MDA含量。黄冠庆等[7]研究表明,高温[(33±2) ℃]条件下,饲粮中分别添加0.5%和0.8% GLN均可显著提高28和35日龄黄羽肉鸡血液中GSH-Px活性,显著降低血液中MDA含量,但对血液中SOD活性无显著影响。而本研究结果显示饲粮添加GLN可使血清MDA含量显著降低,与前人研究结果相一致,说明GLN可在一定程度上缓解LPS引起的断奶仔猪的氧化应激。
T-AOC作为衡量机体抗氧化系统功能状况的综合性指标,其高低可以在总体上反映机体抗氧化系统对外来刺激的代偿能力以及机体自由基代谢的状态[18]。本研究结果显示,饲粮添加GLN可提高血清T-AOC,且较应激组提高了2.14倍,这意味着GLN在一定程度上可提高断奶仔猪的机体抗氧化能力。本研究也显示,GLN组血清GSH-Px、SOD和CAT活性均低于对照组和应激组。研究已经表明,外源性补充GLN能够增强GSH-Px和CAT的活性,从而缓解体内由LPS诱导产生的氧化应激[18]。与本研究结果相反,可能是由于GLN提高了机体整体抗氧化能力所致,也可能是由于饲喂GLN的断奶仔猪本身已经提高了机体整体的抗氧化水平,从而增加了断奶仔猪对自由基的清除能力,当大肠杆菌型LPS入侵断奶仔猪时并未造成强烈的氧化应激和炎症反应,进而这些指标并没有及时作出相应的变化。
3.2 GLN对断奶仔猪小肠黏膜氧化应激相关基因表达的影响
GPX1、GPX4是体内2种重要的含硒蛋白质,都属于GSH-Px家族同工酶,具有清除氧自由基、抗脂质过氧化和保护细胞成分免受氧化攻击的重要作用。GPX1是在哺乳动物体内发现的第1个含硒酶[19],也是多数细胞中含量最丰富的硒蛋白质,被认为是哺乳动物体内的一种主要的抗氧化蛋白质[20]。GPX4对磷脂氢过氧化物的活性较高,是膜物质的重要抗氧化酶,联合维生素E发挥抗氧化作用,是哺乳动物体内唯一能直接还原磷脂的抗氧化酶,能保护宿主细胞免受细胞内和细胞膜脂蛋白质的脂质过氧化氢物(LOOHs)介导的损伤[21]。研究表明,如肠道GPX4基因相对表达量过高,说明该仔猪GPX4活性较高,从而更加有效地提高抗氧化能力[21]。本研究结果显示,LPS攻毒后,仔猪出现应激反应,在十二指肠、空肠和回肠黏膜中,GLN组的GPX1和GPX4基因相对表达量均高于应激组,特别是在空肠黏膜中GPX1和GPX4基因相对表达量显著增加。这一结果表明饲粮添加GLN后,促进了断奶仔猪小肠黏膜GPX1和GPX4基因相对表达量,提高了仔猪的抗氧化能力。
CuZnSOD与MnSOD为高度可诱导的基因,对氧化应激有高度的反应性,并调控CuZnSOD与MnSOD的合成和分泌。CuZnSOD是SOD家族的成员之一,是集体防御氧化损伤的一种重要的金属酶,能转移性地清除超氧阴离子自由基,在维持氧自由基平衡方面发挥着重要的作用[22]。MnSOD对氧化应激有着高度的反应性,在线粒体中MnSOD可以催化转换超氧化物分解为H2O2和氧分子,从而清除细胞器中有害的活性氧自由基(ROS)[22]。本研究结果显示,LPS攻毒后,GLN组小肠黏膜CuZnSOD和MnSOD基因相对表达量高于应激组,说明GLN具有促进小肠黏膜CuZnSOD与MnSOD基因表达的功能,从而提高了断奶仔猪对氧化应激的反应性。CAT是一种酶类清除剂,它可促使H2O2分解为分子氧和水,清除体内的H2O2,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一。而CAT基因是CAT的调控基因,调控CAT的合成和分泌。本研究中,LPS攻毒后,GLN可显著提高十二指肠和空肠黏膜中CAT基因相对表达量,而在回肠黏膜中无显著影响,意味着GLN可促进十二指肠和空肠黏膜CAT基因表达,进而提高CAT的活性,但在回肠黏膜中效果不佳。
4 结 论
本研究以大肠杆菌型LPS建立氧化应激模型,在饲粮中添加1% GLN检测对断奶仔猪氧化应激的影响,结果显示GLN显著降低了血清MDA含量和SOD活性,降低了血清GSH-Px和CAT活性,提高了血清T-AOC,同时提高了小肠黏膜GPX1、GPX4、CuZnSOD、MnSOD和CAT基因相对表达量(回肠CAT基因除外),说明饲粮添加GLN可以在一定程度上缓解因LPS引起的氧化应激反应,提高仔猪的抗氧化能力,进而增强仔猪的抗病能力。
[1] 李永义.茶多酚对氧化应激仔猪的保护作用及机制研究[D].博士学位论文.雅安:四川农业大学,2011.
[2] 于国江,冯会中,郑鹏飞,等.仔猪运输综合征诊治[J].中国猪业,2009,4(9):43-44.
[3] 王蕾,刘坚,侯永清,等.α-酮戊二酸对LPS慢性应激仔猪小肠黏膜形态与功能的影响[J].畜牧兽医学报,2010,41(1):46-52.
[4] 刘坚,侯永清,丁斌鹰,等.α-酮戊二酸对脂多糖应激断奶仔猪空肠黏膜蛋白合成和抗氧化能力的影响[J].中国畜牧杂志,2010,46(11):35-38.
[5] 林海.家禽热应激状态下的营养与生理反应[M]//李德发.动物营养研究进展.北京:中国农业科学技术出版社, 2004:237 -248.
[6] CURI R,LAGRANHA C J,DOI S Q,et al.Molecular mechanisms of glutamine action[J].Journal of Cellular Physiology,2005,204(2):392-401.
[7] 黄冠庆,林红英.谷氨酰胺对高温环境下黄羽肉鸡抗氧化能力的影响[J].中国饲料,2006(20):24-26.
[8] DAHLQVIST A.Method for assay of intestinal disaccharidases[J].Analytical Biochemistry,1964,7(1):18-25.
[9] SCHMITTGEN T D,LIVAK K J.Analyzing real-time PCR data by the comparative CT method[J].Nature Protocols,2008,3(6):1101-1108.
[10] 陈瑾,周小秋,冯琳.谷氨酰胺对动物肠道抗氧化能力的影响[J].饲料工业,2009,30(2):55-57.
[11] 曹婧然,谢颖,李辉,等.谷氨酰胺在氧化应激疾病中的作用及其机制的研究[J].临床误诊误治,2013,26(9):102-104.
[12] 杨彩梅,徐卫丹,陈安国.甘氨酰-L-谷氨酰胺对断奶仔猪生长性能及肠道吸收功能的影响[J].中国畜牧杂志,2005,41(8):6-8.
[13] ZHANG H J,GUO Y M,TIAN Y D,et al.Dietary conjugated linoleic acid improves antioxidant capacity in broiler chicks[J].British Poultry Science,2008,49(2):213-221.
[14] GHOSH B,HANEVOLD C D,DOBASHI K,et al.Tissue differences in antioxidant enzyme gene expression in response to endotoxin[J].Free Radical Biology and Medicine,1996,21(4):533-540.
[15] ABD-ALLAH A R A,HELAL G K,AL-YAHYA A A,et al.Pro-inflammatory and oxidative stress pathways which compromise sperm motility and survival may be altered by L-carnitine [J].Oxidative Medicine and Cellular Longevity,2009,2(2):73-81.
[16] DENNO R,ROUNDS J D,FARIS R,et al.Glutamine-enriched total parenteral nutrition enhances plasma glutathione in the resting state[J].Journal of Surgical Research,1996,61(1):35-38.
[17] 边连全,陈静,刘显军.谷氨酰胺对早期断奶仔猪小肠粘膜形态和抗氧化性能的影响[J].沈阳农业大学学报,2006,37(6):849-852.
[18] 郑荣梁,黄中洋.自由基生物学[M].3版.北京:高等教育出版社,2007.
[19] ROTRUCK J T,POPE A L,GANTHER H E,et al.Selenium:biochemical role as a component of glutathione peroxidase[J].Science,1973,179(4073):588-590.
[20] 王晓雅.硒蛋白的抗氧化作用[J].现代农业科技,2006(8):183-184.
[21] SUN Q,KOJIMA H,KOMURA S,et al.Effect of selenium on human phospholipid hydroperoxide glutathione peroxidase expression and host cell susceptibility to lipid hydroperoxide-mediated injury[J].Biochemistry and Molecular Biology International,1997,42(5):957-963.
[22] NOOR R,MITTAL S,IQBAL J.Superoxide dismutase-applications and relevance to human diseases[J].Medical Science Monitor,2002,8(9):210-215.
*Corresponding authors: WU Xiaosong, associate professor, E-mail: wuxiaosong529@126.com; YAO Kang, professor, E-mail: yaokang@isa.ac.cn
(责任编辑 李慧英)
Effects of Glutamine on Oxidative Stress of Weaned Piglets Challenged by Lipopolysaccharide
LI Huan1HUANG Niu1HE Liuqin2,3TIAN Junquan2,3WU Xiaosong1*YAO Kang1,2*
(1.CollegeofAnimalScienceandTechnology,HunanAgriculturalUniversity,Changsha410128,China; 2.ScientificObservingandExperimentalStationofAnimalNutritionandFeedScienceinSouthCentral,MinistryofAgriculture,HunanProvincialEngineeringResearchCenterforHealthyBreedingofLivestockandPoultry,KeyLaboratoryofAgro-EcologicalProcessesinSubtropicalRegion,InstituteofSubtropicalAgriculture,ChineseAcademyofSciences,Changsha410125,China; 3.UniversityofChineseAcademyofSciences,Beijing100049,China)
This study was conducted to evaluate the effects of glutamine (GLN) on oxidative stress of weaned piglets based on the oxidative stress model byEscherichiacolilipopolysaccharide (LPS). Twenty-four 28-day-old healthy crossbred (Duroc×Landrace×Largewhite) weaned piglets were randomly assigned into three groups with eight replicates per group and one piglet per replicate. The piglets in control group and stress group were fed the basal diets, and the others in GLN group were fed the basal diet supplemented with 1% GLN. The experiment lasted for 30 days. At days 22, 25, 28 and 30 of the experiment, the piglets in stress group and GLN group were injected intraperitoneally with 100 μg LPS per kg body weight, whereas piglets in control group were injected intraperitoneally with the same dosage of sterile saline. At day 30, blood samples were collected by precaval vein and the intestinal tract samples were collected after slaughter for detection of the oxidative stress related indexes. The results showed as follows: 1) serum antioxidant capacity indexes had no significant differences among all groups before LPS challenge (P>0.05). After LPS challenge, the content of malondialdehyde (MDA) in serum in stress group was significantly higher than that in control group (P<0.05), and the content of MDA and the activity of superoxide dismutase (SOD) in serum in GLN group were significantly lower than those in stress group and control group (P<0.05). 2) After LPS challenge, the relative gene expression levels of catalase (CAT) and Cu-Zn superoxide dismutase (CuZuSOD) in duodenum mucosa in GLN group were significantly higher than those in stress group (P<0.05). The relative gene expression levels ofCAT, manganese superoxide dismutase (MnSOD), glutathione peroxidase 1 (GPX1) and glutathione peroxidase 4 (GPX4) in jejunum mucosa in GLN group were significantly higher than those in control group and stress group (P<0.05), and the relative gene expression levels ofGPX4 in control group was significantly higher than that in stress group (P<0.05). The relative gene expression level ofCATin ileum mucosa in GLN group and stress group was significantly lower than that in control group (P<0.05), and the relative gene expression level ofGPX4 was significantly higher than that in control group (P<0.05). The relative gene expression level ofMnSODin ileum mucosa in GLN group was significantly higher than that in control group and stress group (P<0.05), and the relative gene expression level ofCuZnSODwas significantly higher than that in control group (P<0.05). The results suggest that GLN can alleviate oxidative stress of weaned piglets challenged by LPS to some extent, thereby provide a theoretical basis for reducing oxidative stress in actual production.[ChineseJournalofAnimalNutrition, 2017, 29(4):1350-1358]
glutamine; weaned piglets; lipopolysaccharide; oxidative stress; antioxidant capacity
10.3969/j.issn.1006-267x.2017.04.033
2016-10-13
国家973项目专题(2013CB127301);中科院“百人计划”项目;国家自然科学基金面上项目(31472107)
李 欢(1992—),男,河南南阳人,硕士研究生,动物营养与饲料科学专业。E-mail: 977141476@qq.com
*通信作者:伍小松,副研究员,E-mail: wuxiaosong529@126.com; 姚 康,研究员,博士生导师,E-mail: yaokang@isa.ac.cn
S816.7;S828
A
1006-267X(2017)04-1350-09

