射波刀立体定向放射治疗小肝癌的临床效果
张 弢, 孙 静, 何卫平, 李 欢, 王 卉, 孙颖哲, 朴俊杰, 张军华, 徐慧军, 段学章
(解放军第三〇二医院 肿瘤放射治疗中心, 北京 100039)
射波刀立体定向放射治疗小肝癌的临床效果
张 弢, 孙 静, 何卫平, 李 欢, 王 卉, 孙颖哲, 朴俊杰, 张军华, 徐慧军, 段学章
(解放军第三〇二医院 肿瘤放射治疗中心, 北京 100039)
目的 评价小肝癌(sHCC)患者接受射波刀立体定向放射外科治疗的疗效和安全性。方法 收集2011年3月-2012年12月解放军第三○二医院行射波刀治疗的28例sHCC患者。射波刀治疗总剂量35~60 Gy/3~5次,连续治疗3~6 d。中位随访时间36个月。依据改良版实体瘤疗效评价标准(mRECIST)进行近期疗效评价,以1、2、3年总生存率和局部控制率作为远期疗效评价指标。采用Kaplan-Meier法分析计算累积生存率和局部控制率。结果 28例患者中,完全缓解17例,部分缓解8例,稳定2例,疾病进展1例,近期有效率89.28%。1、2、3年生存率分别为92.86%、85.71%和78.57%;1、2、3年局部控制率分别为96.43%、92.86%和89.28%。毒性反应主要表现为 Ⅰ~Ⅱ 级事件。结论 射波刀治疗sHCC是安全、有效的,具有较高的局部控制率、生存率和低毒性反应,可以作为不适合手术治疗的sHCC的替代治疗。
肝肿瘤; 放射外科手术; 治疗结果
肝细胞癌(HCC)是成人最常见的原发性肝脏肿瘤,是世界第五大常见恶性肿瘤[1]。目前指南[2]推荐肝切除、肝移植和射频消融作为小肝癌(sHCC)的根治性治疗选择。然而由于各种原因,仅有10%~30%的确诊病例能够实施手术切除治疗[3]。同时,供体的缺乏以及严格的适应证使肝移植术亦受到很大限制。射频消融是不适合手术的sHCC的根治性治疗选择[4],但如果病灶靠近胆管或大血管,或位于肝脏深部,则治疗的安全性很难保障。因此,sHCC特别是无法得到根治性治疗的sHCC的最佳治疗方法仍存在争议。
既往由于正常肝组织的放疗敏感性、低剂量全肝照射后发生放射诱导性肝病的风险以及毗邻放射敏感器官如胃、十二指肠等原因,HCC的放射治疗受到很大限制[5]。近年来放疗设备的发展使得放射治疗sHCC的同时避免发生放射诱导性肝病等风险成为可能。立体定向放射治疗(stereotactic body radiotherapy,SBRT)已成为不适合外科手术、肝移植和射频消融的sHCC患者治疗的新选择。
射波刀是一种新型的SBRT系统,具有在线校位、呼吸门控、实时跟踪、图像引导放疗等功能,呼吸同步追踪系统可引导加速器持续跟踪肿瘤运动进行同步照射,临床精度达到1 mm以下,实现了精确治疗,提高肿瘤区剂量,减少了周围正常组织的受照剂量,提高了治疗增益比[6]。本研究旨在回顾性分析射波刀治疗sHCC的疗效和安全性。
1 资料与方法
1.1 研究对象 收集2011年3月-2012年12月在本院行射波刀治疗的sHCC患者,入选标准:(1)肿瘤最大直径≤3 cm;(2)无血管、淋巴结侵犯;(3)无肝外转移灶;(4)不适合或拒绝手术、射频消融等其他治疗;(5)Child-Pugh分级A或B;(6)ECOG评分0或1;(7)均为单个病灶。临床诊断主要依据国际肝癌指南[7]中肝癌的影像学特征,即同期多排CT扫描和(或)动态对比增强MRI检查显示肝脏占位在动脉期快速不均质血管强化,而静脉期或延迟期快速洗脱。如果肝脏占位直径≥2 cm,CT和MRI两项影像学检查中有一项显示肝脏占位具有上述肝癌的特征,即可诊断HCC;如果肝脏占位直径为1~2 cm,则需要CT和MRI两项影像学检查均显示肝脏占位具有上述肝癌特征,方可诊断HCC。所有患者均经过肝癌多学科会诊,并在治疗前签署知情同意书。
1.2 射波刀治疗
1.2.1 金标植入 术前需行血常规、凝血功能以及心、肺等系统检查,评估病情,确定无肝穿刺禁忌证。在射波刀治疗前7 d于CT引导下在肝肿瘤附近植入3~5枚金标。金标植入的要求:(1)金标最远距离肿瘤<6 cm;(2)每2颗金标间距>2 cm;(3)每2颗金标连线与水平线夹角>15°,且避免呈45°角;(4)最少植入3颗金标。植入金标患者采用呼吸同步及金标追踪技术,其他患者采用脊柱追踪技术。
1.2.2 CT定位 金标植入体内后1周后行CT定位。基准影像为CT平扫,可根据条件配以相应辅助影像,如CT增强、MRI、PET、3D血管造影等。定位时要求机架角度0°,层厚1 mm,电压120 V,电流400 mA,长度≥20 cm,层数≤512层。患者取仰卧位,头先进方式扫描。
1.2.3 射波刀治疗 由放疗治疗医师勾画出肿瘤靶区(gross target volume,GTV)及相应危及器官(正常肝组织、胃、小肠、十二指肠、双肾和脊髓等),GTV外放3~5 mm为计划靶区。放射物理师根据要求,利用G4 CyberKnife治疗计划系统(MultiPlan 4.0.2)行逆向调强治疗计划设计,总剂量35~60 Gy/3~5次,处方剂量线为72%~80%,周围正常器官受量均在正常耐受范围内(TG-101报告)。将设计好的射波刀治疗计划传输至治疗控制系统,确定治疗参数无误后开始治疗。连续治疗3~6天。1.3 疗效评价 每位患者在完成治疗后1个月进行1次临床和生物学评价,第1年每3个月随访1次,后每3~6个月随访1次。每次随访对患者的症状、体征、血常规、肝功能、AFP以及腹部CT或MRI(均为对比增强扫描)进行评价。
近期疗效评价依据改良版实体瘤疗效评价标准(mRECIST)[8]:(1)完全缓解(complete response,CR),指所有目标病灶动脉期增强显影均消失;(2)部分缓解(partial response,PR),指目标病灶(动脉期增强显影)的直径总和缩小≥30%;(3)疾病进展(progression disease,PD),指目标病灶(动脉期增强显影)的直径总和增加≥20%,或出现新病灶;(4)稳定(overall survival,OS),指缩小未达到PR或增加未达到PD。有效率=CR+PR,疾病控制率=CR+PR+SD。
以1、2、3年总生存率和局部控制率作为远期疗效评价指标,局部控制率指影像学上肿瘤无增大的患者占总数的比例。毒性反应评价依据国际癌症协会颁布的常见不良反应事件评价标准4.0版本[9]。
1.4 统计学方法 采用SPSS19.0软件进行数据分析。采用Kaplan-Meier法分析计算累积生存率和局部控制率。
2 结果
2.1 一般资料 共入选患者28例,其中男21例,女7例,中位年龄49岁。中位血清AFP水平19.3 ng/ml。中位肿瘤最大直径2.1 cm。初治患者10例,另18例既往接受过不同形式的治疗(表1)。27例患者在射波刀治疗前7 d于CT引导下在肝肿瘤附近植入3~5枚金标,采用呼吸同步及金标追踪技术,1例患者采用脊柱追踪技术。
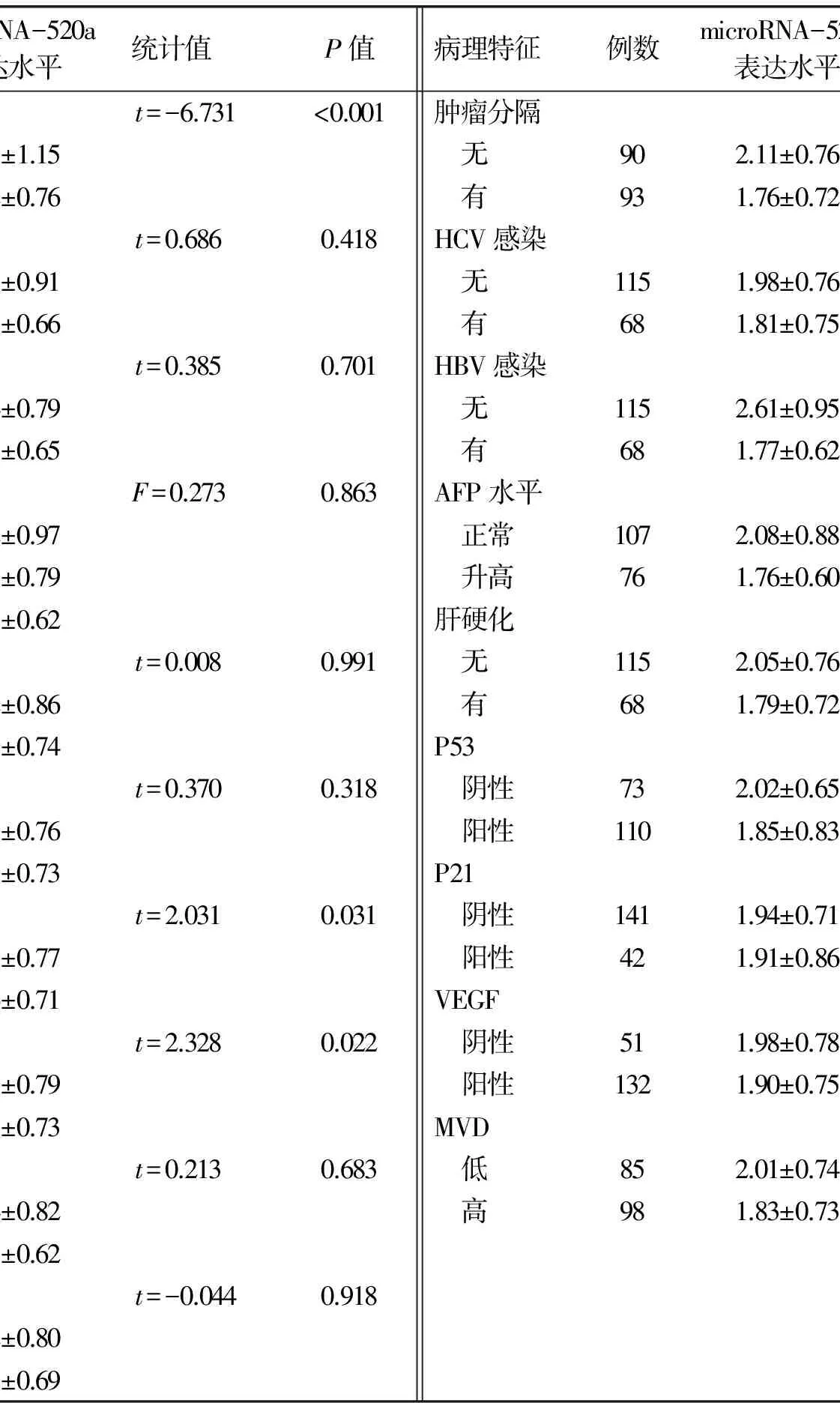
表1 患者的临床特点
注:TACE:经肝动脉化疗栓塞术;RFA:射频消融;PCA:氩氦刀冷冻消融
2.2 近期疗效 28例患者均完成了治疗,治疗3~6个月后,CR 17例(60.71%),PR 8例(28.57%),SD 2例(7.14%),PD 1例(3.58%)。有效率89.28%,疾病控制率96.42%。
2.3 远期疗效 中位随访时间为36个月(3~53个月)。随访至2015年10月,共有6例患者死亡,随访第1、2、3年各有2例患者死亡。死亡原因:上消化道出血2例、肝性脑病1例、肝肾综合征1例、肝衰竭1例、胆道梗阻1例。1、2、3年总生存率分别为92.86%、85.71%和78.57%(图1)。1、2、3年局部控制率分别为96.43%、92.86%和89.28%(图2)。
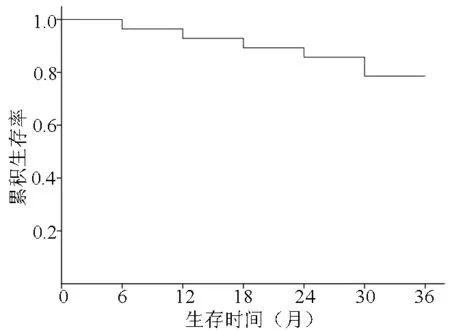
图1 射波刀治疗sHCC生存率

图2 射波刀治疗sHCC局部控制率
2.4 不良反应 所有患者均按治疗计划完成治疗,未见因无法耐受的不良反应而中断治疗。肝区不适、乏力、呕吐、厌食是最常见的急性毒性反应症状,治疗后1周左右逐渐缓解。1例患者发生了Ⅳ级高胆红素血症,并于放疗后第3个月死于肝衰竭。由于该患者的肿瘤直径仅3 cm,且治疗前肝功能良好(Child-Pugh A级),因此很难辨别是由于射波刀放疗导致了肝衰竭还是其他潜在的原因。另有6例患者发生肝毒性反应,表现为轻度的转氨酶和(或)胆红素升高,经保肝对症治疗均好转。其他患者在治疗期间和治疗后肝功能保持稳定。
血液毒性主要表现为Ⅰ~Ⅱ级的白细胞和血小板计数的下降,对于白细胞下降者,给予重组人粒细胞刺激因子升高白细胞,血小板下降未予处理,放疗后逐渐恢复。没有发生严重的胃肠道并发症,如消化道出血和穿孔。
2.5 预后情况 射波刀治疗后出现复发患者13例,其中肝内靶区内复发4例(其中1例发生在随访3年后),肝内靶区外复发9例,发生肺转移1例。中位复发时间为放疗后23.5个月(6~52个月)。对复发患者9例行TACE治疗,1例行射频消融,3例再次行射波刀放疗。
3 讨论
对于肝功能代偿良好的肝脏单个肿瘤,特别是sHCC,手术切除是目前最有效的治疗方法,5年生存率可以达到60%~70%[10-11]。但遗憾的是,由于肝功能失代偿、凝血机制差以及肿瘤部位深等原因,仅有少部分患者符合外科切除治疗条件[12]。由于供体缺乏和经费昂贵等原因,肝移植亦很难开展于绝大多数sHCC患者。对于不适合外科治疗的sHCC患者,经皮消融治疗可作为根治性的治疗手段,肝功能分级为Child A级的sHCC患者RFA治疗5年生存率可达到50%~70%,和手术治疗的结果相仿[13]。但如果病灶临近胆囊、大血管,或位于肝顶部膈肌下,则限制了经皮消融术的应用[14]。随着放疗设备的发展,肿瘤放射治疗由传统放疗向精准放疗转变,SBRT为不适合外科手术和射频消融的sHCC提供了机会。
SBRT具备高剂量精准放疗的特点,较早应用于无其他治疗选择的的头颈部肿瘤直径≤3 cm者[15]。20年前,Blomgren等[16]最早将SBRT应用于肝脏,作为原发或继发的不适合其他治疗方法的HCC的局部治疗手段,显示了较高的局部控制率和低毒性反应[17]。目前,HCC的SBRT治疗已成为TACE术后不完全栓塞的补救治疗、肝移植前的过渡治疗以及复发HCC治疗的选择[18-20]。
Yoon等[21]报道SBRT治疗不适合外科手术的sHCC患者93例,其中肿瘤最大直径<6 cm,病灶≤3个,每次分割剂量10~20 Gy,总剂量30~60 Gy,1、3年总生存率分别是86.0%、53.8%,认为SBRT可以作为不适合其他根治性治疗的sHCC的替代治疗选择。Yuan等[22]回顾性分析射波刀和外科切除治疗巴塞罗那分期Ⅰ期的HCC患者,射波刀治疗1、2和3年总生存率分别是72.7%、66.7%和57.1%,同期外科切除的总生存率分别是88.5%、73.1%和69.2%,外科切除的总生存率略高,但两者无统计学差异,初步认为对于早期HCC患者,射波刀放疗与外科切除的疗效是等同的。Dewas等[23]回顾性分析120例射波刀放疗患者,其中HCC 42例、肝转移癌72例、胆管细胞癌6例,中位肿瘤直径33 mm,中位GTV 32.38 cm3,中位总剂量45 Gy,1、2年的局部控制率分别是84%、74.6%,总剂量、肿瘤直径和体积是影响局部控制率的预后相关因素。但因本研究例数较少,未进行预后相关因素分析,待扩大样本量后再行研究。
本研究病例显示了较低的毒性反应,主要表现为轻度的转氨酶、胆红素升高和白细胞、血小板下降,大多在放疗后可逐渐恢复。仅1例有乙型肝炎肝硬化基础的患者在放疗后第3个月发生肝衰竭,但该患者未表现肝肿大和大量腹水,血清病毒复制指标亦为阴性,对于有肝硬化基础的患者来说,导致肝损伤的原因是复杂的,很难辨别其确切原因。但笔者认为,在放疗后3个月内发生严重肝损伤的患者,在完成放疗、肿瘤控制良好,且排除肿瘤发展造成的肝损伤后,则判定为放射诱导性肝病的可能性较大。放射诱导性肝病是既往限制放疗应用于HCC的主要障碍,全肝照射剂量30~35 Gy时发生放射诱导性肝病的风险约为5%~10%。基础肝功能、肝硬化背景以及计划靶区肝体积是发生放射诱导性肝病的重要因素[24]。Jung等[25]利用临床和剂量-体积参数,预测SBRT治疗不可外科切除的sHCC发生放射诱导性肝病的风险,发现Child-Pugh B级的肝硬化患者放疗后发生Ⅱ级肝毒性或更严重的放射诱导性肝病的风险更大。需要注意的是,虽然吲哚菁绿试验较Child-Pugh分级可更敏感地评价肝功能,并广泛应用于肝切除前,但有研究[26]显示在预测放射诱导性肝病方面,Child-Pugh分级相比吲哚菁绿试验是更重要的预测参数。
HCV感染是西方国家发生HCC的最主要原因,而HBV感染则是我国HCC的主要原因。HBV、HCV相关性肝癌的临床病理特点在诸多方面有明显差异,HBV相关性肝癌的癌肿较大,包膜不完整,易侵犯血管,而HCV相关性肝癌的癌肿体积相对较小,包膜完整,不易侵犯血管,治疗效果相对较好[27]。本研究中患者以HBV为主要病因,相对于以HCV为主的西方相关报道,本研究结果对于国内sHCC的射波刀治疗可能更具指导和借鉴意义。
综上所述,射波刀是一种新型的立体定向放射外科治疗系统,同步呼吸追踪、大剂量低分割放疗以及缩短疗程是其最主要的特点[28]。笔者认为射波刀SBRT是sHCC的一种有效、安全的治疗方法,具有较高的局部控制率、生存率,且毒性反应较低,疗效可观。应用剂量反面,虽然更高的剂量会带来更好的局部控制率,但发生放射诱导性肝病的风险也会增加,因此SBRT治疗sHCC的最佳剂量以及最佳的分割方式仍存在争议。尚需更长的随访时间来评估剂量-反应关系以及潜在的晚期毒性反应。射波刀和外科手术均属于局部治疗,本研究复发患者13例中有9例发生在放疗靶区外,是治疗失败的主要原因,提示射波刀联合化疗或靶向治疗可能是将来进一步提高疗效的有效治疗策略。
[1] PARKIN DM, BRAY F, FERLAY J, et al. Estimating the world cancer burden: Globocan 2000[J]. Int J Cancer, 2001, 94(2): 153-156.[2] BRUIX J, SHERMAN M. Management of hepatocellular carcinoma: an update[J]. Hepatology, 2011, 53(3): 1020-1022.
[3] LAU WY, LAI EC. Salvage surgery following downstaging of unresectable hepatocellular carcinoma-a strategy to increase resectability[J]. Ann Surg Oncol, 2007, 14(12): 3301-3309.
[4] LENCIONI R, CROCETTI L. Local-regional treatment of hepatocellular carcinoma[J]. Radiology, 2012, 262(1): 43-58.
[5] LAWRENCE TS, ROBERTSON JM, ANSCHER MS, et al. Hepatic toxicity resulting from cancer treatment[J].Int J Radiat Oncol Biol Phys, 1995, 31(5): 1237-1248.
[6] ADLER JR Jr, CHANG SD, MURPHY MJ, et al. The cyberknife: a frameless robotic system for radiosurgery[J].Stereotact Funct Neurosurg, 1997, 69(1-4 Pt 2): 124-128.
[7] European Association for the Study of the Liver . EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma[J].J Hepatol, 2012, 56(4): 908-943.
[8] LENCIONI R, LLOVET JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma[J].Semin Liver Dis, 2010, 30(1): 52-60.
[9] CHEN AP,SETSER A,ANADKAT MJ, et al.Grading dermatologic adverse events of cancer treatments: the Common Terminology Criteria for Adverse Events (CTCAE) version 4.0[J]. J Am Acad Dermatol, 2012, 67(5): 1025-1039.
[10] BRUIX J, BOIX L, SALA M, et al. Focus on hepatocellular carcinoma[J]. Cancer Cell, 2004, 5(3): 215-219.
[11] BRUIX J, SHERMAN M. Management of hepatocellular carcinoma[J]. Hepatology, 2005, 42(5): 1208-1236.
[12] RAHBARI NN, MEHRABI A, MOLLBERG NM, et al. Hepatocellular carcinoma: current management and perspectives for the future[J]. Ann Surg, 2011, 253(3): 453-469.
[13] LENCIONI R. Loco-regional treatment of hepatocellular carcinoma[J]. Hepatology, 2010, 52(2): 762-773.
[14] DECADT B, SIRIWARDENA AK. Radiofrequency ablation of liver tumours: systematic review[J]. Lancet Oncol, 2004, 5(9): 550-560.
[15] COMET B, KRAMAR A, FAIVRE-PIERRET M, et al. Salvage stereotactic reirradiation with or without cetuximab for locally recurrent head-and-neck cancer: a feasibility study[J].Int J Radiat Oncol Biol Phys, 2012, 84(1): 203-209.
[16] BLOMGREN H, LAX I, NSLUND I, et al. Stereotactic high dose fraction radiation therapy of extracranial tumors using an accelerator: clinical experience of the first thirty-one patients[J]. Acta Oncol, 1995, 34(6): 861-870.
[17] KLEIN J, DAWSON LA. Hepatocellular carcinoma radiation therapy: review of evidence and future opportunities[J]. Int J Radiat Oncol Biol Phys, 2012, 87(1): 22-32.
[18] KANG JK, KIM MS, CHO CK, et al. Stereotactic body radiation therapy for inoperable hepatocellular carcinoma as a local salvage treatment after incomplete transarterial chemoembolization[J]. Cancer, 2012, 118(21): 5424-5431.
[19] O′CONNOR JK, TROTTER J, DAVIS GL, et al. Long-term outcomes of stereotactic body radiation therapy in the treatment of hepatocellular cancer as a bridge to transplantation[J].Liver Transpl, 2012, 18(8): 949-954.
[20] HUANG WY, JEN YM, LEE MS, et al. Stereotactic body radiation therapy in recurrent hepatocellular carcinoma[J]. Int J Radiat Oncol Biol Phys, 2012, 84(2): 355-361.
[21] YOON SM, LIM YS, PARK MJ, et al. Stereotactic body radiation therapy as an alternative treatment for small hepatocellular carcinoma[J]. PLoS One, 2013, 8(11): e79854.
[22] YUAN Z, TIAN L, WANG P, et al. Comparative research on the efficacy of cyberknife and surgical excision for stage I hepatocellular carcinoma[J].Onco Targets Ther, 2013, 6: 1527-1532.
[23] DEWAS S, BIBAULT JE, MIRABEL X, et al. Prognostic factors affecting local control of hepatic tumors treated by stereotactic body radiation therapy[J]. Radiat Oncol, 2012, 7: 166.[24] CHENG JC, WU JK, HUANG CM, et al. Radiation-induced liver disease after three- dimensional conformal radiotherapy for patients with hepatocellular carcinoma: dosimetric analysis and implication[J].Int J Radiat Oncol Biol Phys, 2002, 54(1): 156-162.
[25] JUNG J, YOON SM, KIM SY, et al. Radiation induced liver disease after stereotactic body radiotherapy for small hepatocellular carcinoma: clinical and dose-volumetric parameters[J]. Radiat Oncol, 2013, 8: 249.
[26] LEE IJ, SEONG J, SHIM SJ, et al. Radiotherapeutic parameters predictive of liver complications induced by liver tumor radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2009, 73(1): 154-158.
[27] DUAN LW, SUN H, CHEN YS, et al. An analysis of clinicopathological features of viral hepatitis-associated liver cancer[J]. J Chin Physician, 2013,15(2): 213-215. (in Chinese) 段立伟, 孙寒, 陈永胜, 等. 病毒性肝炎相关性肝癌的临床病理特征分析[J].中国医师杂志, 2013,15(2): 213-215.
[28] MARTIN A, GAYA A. Stereotactic body radiotherapy: a review[J]. Clin Oncol, 2010, 22(3): 157-172.
引证本文:ZHANG T, SUN J, HE WP, et al. Clinical effect of CyberKnife stereotactic radiosurgery in treatment of patients with small hepatocellular carcinoma[J]. J Clin Hepatol, 2017, 33(4): 694-698. (in Chinese) 张弢, 孙静, 何卫平, 等. 射波刀立体定向放射治疗小肝癌的临床效果[J]. 临床肝胆病杂志, 2017, 33(4): 694-698.
(本文编辑:邢翔宇)
Clinical effect of CyberKnife stereotactic radiosurgery in treatment of patients with small hepatocellular carcinoma
ZHANGTao,SUNJing,HEWeiping,etal.
(RadiotherapyCenterofOncology, 302HospitalofPLA,Beijing100039,China)
Objective To investigate the clinical effect and safety of CyberKnife stereotactic radiosurgery in the treatment of small hepatocellular carcinoma (sHCC). Methods Twenty-eight patients with sHCC who underwent CyberKnife radiosurgery in 302 hospital of PLA form March 2011 to December 2012 were enrolled. The total dose of Cyber Knife radiosurgery was 35-60 Gy in 3-5 fractions for 3-6 consecutive days. The median follow-up was 36 months. Modified Response Evaluation Criteria in Solid Tumors was used as assessment indices for short-term therapeutic effect, and the 1-, 2-, and 3-year overall survival rates and local control rates were used as assessment indices for long-term therapeutic effect. The Kaplan-Meier method was used to calculate cumulative survival rate and local control rate. Results Among the 28 patients, 17 achieved complete remission (CR), 8 achieved partial remission (PR), 2 achieved a stable disease, and 1 had a progressive disease, resulting in a short-term response rate (CR+PR) of 89.28%. The 1-, 2-, and 3-year survival rates were 92.86%, 85.71%, and 78.57%, respectively, and the 1-, 2-, and 3-year local control rates were 96.43%, 92.86%, and 89.28%, respectively. Toxic reactions were mainly grade 1 and 2 events. Conclusion CyberKnife is a safe and effective option for sHCC and has the features of high local control rate, high survival rate, and few toxic reactions. Therefore, it can be used as an alternative treatment for patients with inoperable sHCC.
hepatocellular carcinoma; radiosurgery; treatment outcome
10.3969/j.issn.1001-5256.2017.04.019
2016-10-12;
2016-12-26。
首都特色基金(Z151100004015002);解放军三〇二医院院长创新基金(YNKT2014011)
张弢(1973-),男,主治医师,主要从事肝癌放疗方面的研究。
段学章,电子信箱:duanxuezhang2006@163.com。
R735.7; R730.55
A
1001-5256(2017)04-0694-05

