甘蔗过氧化物酶基因ScPOD02的克隆与功能鉴定
苏亚春 王竹青 李 竹 刘 峰 许莉萍 阙友雄 戴明剑 陈允浩
甘蔗过氧化物酶基因的克隆与功能鉴定
苏亚春 王竹青 李 竹 刘 峰 许莉萍*阙友雄 戴明剑 陈允浩
福建农林大学 / 农业部福建甘蔗生物学与遗传育种重点实验室 / 国家甘蔗产业技术研发中心, 福建福州 350002
过氧化物酶(POD)广泛存在于植物各种器官及其不同发育阶段, 在植物生长发育及应对逆境胁迫中起重要作用。本研究基于前期转录组数据, 从黑穗病菌侵染2 d的甘蔗抗黑穗病品种崖城05-179中分离到基因的cDNA (GenBank登录号为KU593507)及基因组DNA (GenBank登录号为KU593508)序列。其cDNA全长为1434 bp, ORF区为1047 bp, 编码348个氨基酸, 而基因组DNA全长为1558 bp, 含2个外显子和1个内含子。系统发育树显示, ScPOD02与水稻OsPrx11 (GenBank登录号为gi|55700889)属于同一个进化分支, 推测ScPOD02属于酸性胞外分泌/细胞壁类型的I.1型过氧化物酶家族。将该基因克隆到原核表达载体pET 32a上, 转化大肠杆菌BL21, 经异丙基-β-d-硫代半乳糖苷诱导成功获得了大小约60 kD的融合蛋白, 且该重组菌在聚乙二醇胁迫下的长势较对照快, 表明其耐受干旱胁迫的能力更强。实时荧光定量PCR (qRT-PCR)分析表明, 除ROC22和YZ03-103外,基因在甘蔗抗病品种(YZ03-258、YZ01-1413、YT96-86和LC05-136)中受黑穗病菌诱导上调表达, 但在中感(GT02-467和FN39)和感病(FN40)品种中的基因表达量基本维持不变或略有降低; 此外,积极应答水杨酸、脱落酸、聚乙二醇及氯化钠的胁迫。通过农杆菌介导法在本氏烟叶片上瞬时表达, 结果显示出较深的DAB染色, 且过表达后本氏烟中的目标基因()及过敏性反应(HR)标记基因(和)和乙烯合成依赖基因(和)均上调表达。以上研究结果显示,具有参与甘蔗免疫应答及抗旱和抗盐害的潜在功能。
甘蔗:; 基因克隆; 生物和非生物胁迫; 基因表达量; 原核表达分析; 瞬时表达分析
甘蔗(spp.)是最主要的糖料作物, 蔗糖分别约占世界食糖和中国食糖总产的80%和92%[1-3]。由黑粉菌()引起的甘蔗黑穗病是甘蔗生产上最重要的气传真菌性病害,造成蔗茎产量损失和蔗糖分降低[4-5]。各国普遍重视该病的防控, 主要通过疫区控制和抗病育种来实现[6]。该病在中国大陆蔗区广泛流行, 主栽品种新台糖22 (ROC22)黑穗病发病严重。培育抗黑穗病甘蔗品种是防治该病害最为经济、有效的措施[6-7]。研究报道, 病原菌一旦侵染植物, 会破坏植物的细胞结构, 增加胞内活性氧含量, 从而诱导寄主植物体内一系列的生理生化代谢反应, 其中, 防御酶类的变化对病原菌侵入早期的生理防御起着重要的作用[8]。过氧化物酶(POD)是多基因家族编码的酶类, 由于基因结构和功能的差异, POD还可参与多种代谢途径, 如生长素代谢过程、细胞壁的延伸与加厚、活性氧及活性氮的代谢、植物的各种抗逆过程(如机械损伤、抗旱、抗寒、抗盐害)等, 具有多种重要的生理功能[9-11]。迄今, PODs在植物抗病性中的重要作用已在多个物种中得到验证[11-14]。许莉萍等[12]分析了4个不同甘蔗抗/感基因型在伸长期感染黑穗病前后叶片中POD、转化酶、可溶性蛋白质和叶绿素的变化, 邢慧清等[13]检测了60个抗/感丝黑穗病的高粱()基因型在苗期、拔节期、抽穗期和成熟期的4个生理生化指标, 结果均发现POD可以作为潜在的抗性鉴定指标。温琪汾等[14]通过测定不同抗病性谷子()在不同生长期的POD活性, 发现抗病品种POD活性明显高于感病品种, 表明POD可以作为一种抗性评价的遗传标记。
目前, 越来越多的植物基因及其结构功能被挖掘。Tognolli等[9]从拟南芥()基因组中挖掘到了73个。Passardi等[15]在水稻()中发现了138个, 其家族基因数目约为拟南芥的2倍。甘蔗为异源多倍和非整倍体作物, 遗传背景复杂, 全基因组测序工作也尚未完成, 使得挖掘和鉴定甘蔗基因存在困难。研究者早期利用聚丙烯酰氨凝胶电泳(SDS-PAGE)和双向电泳(2DE)等技术分离甘蔗POD同工酶[16-20]。迄今, NCBI数据库中已公布了16条甘蔗核酸序列, 其中KF184818、KF184889、KF184743、KF184852、KF184900和KF184837均来源于BAC文库, 但它们的基因结构、功能、定位等信息尚未清楚。Cesarino等[17]通过2DE和液质联用(LC-MS/MS)技术, 从甘蔗品种IACSP04-529不同发育期的蔗茎中鉴定到3个PODs蛋白SCCCCL3002E11.b、SCCCAD1001C08.g和SCBFRZ 2017C11.g, 进化树分析显示其为单子叶特异基因, 而与双子叶植物拟南芥的POD序列没有明确的直接同源性; 此外, 他们还采用该技术从甘蔗悬浮细胞中鉴定到4个POD蛋白SCCCST3005E08.g、SCCCAD1001C08.g、SCMCSB1113A08.g和CCCCL 4012A01.g, 时空表达分析结果显示SCMCSB1113 A08.g在蔗茎次生细胞壁的形成过程中发挥潜在作用[18]。胡小文等[19]利用同源克隆技术从割手密()中分离到2个氨基酸序列相似度为98.8%的III型等位基因(GenBank登录号为KJ002565)和(GenBank登录号为KJ002566), 其与高粱、玉米()、水稻等禾本科植物的亲缘关系较近, 表明基因起源比较古老且保守。胡小文等[20]还成功克隆了甘蔗、斑茅()和割手密的基因DNA序列(GenBank登录号为KJ001797、KJ001798、KJ001799), 这3个基因在功能位点区域高度保守, 仅有一个氨基酸位点存在差异, 其基因组DNA均包含4个外显子, 与高粱、玉米和水稻同源基因的外显子长度差异较小, 而内含子长度差异较大。LaO等[21]采用cDNA-AFLP技术分析发现一个含有4-外显子的基因在甘蔗抗病品种(M31/45)和感病品种(Ja60-5)中受黑穗病菌诱导差异表达。
目前, 关于甘蔗基因挖掘及其应对逆境胁迫的分子机理研究还未曾报道。本研究从课题组前期甘蔗抗黑穗病品种崖城05-179和感黑穗病品种ROC22接种黑穗病菌后的转录组数据库中挖掘到一条仅在抗病品种中差异表达的基因(Unigene ID: Sugarcane_Unigene_BMK.58108), 以黑穗病菌接种2 d的崖城05-179为试验材料, 利用生物信息学预测编码蛋白的理化性质和结构域等, 并分析其在不同甘蔗基因型与黑穗病菌互作过程及不同非生物胁迫下的基因表达模式和原核表达、瞬时表达情况, 旨在分子水平上对基因在甘蔗抗逆分子机理方面有进一步认识, 从而为甘蔗抗逆育种积累理论基础。
1 材料与方法
1.1 材料处理
1.1.1 生物胁迫取样 9个不同甘蔗基因型均来源于农业部福建甘蔗生物学与遗传育种重点实验室。国家甘蔗产业技术体系植保岗位专家黄应昆前期已采用甘蔗黑穗病菌混合孢子的悬浮液进行蔗茎浸渍接种[22]并开展田间种植调查明确其抗黑穗病性表型, 其中抗病品种4个(YZ03-258、YZ01-1413、YT96-86和LC05-136)、中感病品种3个(GT02-467、ROC22和FN39)、感病品种2个(YZ03-103和FN40)[23]。本试验以采自农业部福建甘蔗生物学与遗传育种重点实验室基地的甘蔗黑粉菌混合冬孢子作为接种源, 晾干后在4℃冰箱保存备用。取各品种表型相对一致的蔗茎, 参考Su等[24]的方法接种: 将蔗茎按双芽切段, 流动清水浸泡1 d后, 置32℃培养箱中, 采用16 h光照和8 h黑暗催芽培养至芽长2 cm。然后, 以浓度为5×106个 mL–1(含0.01%吐温-20, v/v)的黑穗病菌孢子悬浮液针刺接种蔗芽, 对照为接种无菌蒸馏水(含0.01%吐温-20, v/v)替代孢子液所取得的。针刺处理后的材料在28℃下培养(16 h光照、8 h黑暗), 分别于接种后0、1、3和7 d切取蔗芽, 5个蔗芽为一个混样, 以液氮固定后于–80℃冰箱保存备用。
1.1.2 非生物胁迫取样 选取长势一致的4个月叶龄的崖城05-179组培苗, 放入清水中培养炼苗10 d后, 对其叶面分组处理: 第1组分别在叶面喷施5 mmol L–1SA (含0.01%吐温-20, v/v)、100 μmol L–1MeJA (含0.1%乙醇和0.05%吐温-20, v/v)和100 μmol L–1ABA, 分别于0、3、6和12 h取样; 第2组分别在含500 mmol L–1的H2O2, 20%的PEG-8000和250 mmol L–1的NaCl的水溶液中培养, 然后分别于0、6、12和24 h取样[24]。两组试验中均取整株组培苗, 迅速用液氮固定, 于–80℃保存备用。每个处理分别设置3个生物学重复。
1.2 基因组DNA及RNA的提取和cDNA第1链的合成
采用姚伟等[25]的CTAB法提取崖城05-179基因组DNA (含RNase A 100 μg mL–1), 另外借助TRIzol法(Invitrogen, 中国)提取样品总RNA, 分别通过1%琼脂糖凝胶电泳初步判断DNA及总RNA质量, 利用紫外分光光度计(NanoVue plus, GE, USA)测定样品浓度和纯度, –80℃保存备用。取1 μg总RNA利用反转录试剂盒PrimeScript 1st Strand cDNA Synthesis Kit (TaKaRa, 中国大连)合成第1链cDNA, –20℃保存备用。
1.3 甘蔗基因克隆与序列分析
应用Primer Premier 5.0设计克隆引物P2-cDNAF/R (表1), 以崖城05-179接种黑穗病菌2 d的总RNA反转录的cDNA第1链为模板进行RT-PCR扩增。PCR体系(25.0 μL)含cDNA 1.0 μL、ExDNA酶(5 U μL–1) 0.125 μL、10×Ex缓冲液(Mg2+plus) 2.5 μL、dNTPs混合物(2.5 mmol L–1) 2.0 μL、上下游引物(10 μmol L–1)各1.0 μL、ddH2O 17.375 μL。PCR扩增程序为94℃预变性5 min; 94℃变性30 s, 48℃退火30 s, 72℃延伸1 min 30 s, 35个循环; 72℃再延伸10 min。的基因组DNA序列扩增以25 ng的崖城05-179 DNA为模板, 扩增引物及反应体系和反应程序与cDNA克隆相同。上述PCR产物经1%琼脂糖凝胶电泳检测及胶回收纯化后, 与pMD19-T载体连接并转化到大肠杆菌DH5α感受态细胞中, 将PCR检测呈阳性的菌落送上海生工生物工程技术服务有限公司测序分析。
运用ORF Finder (http://www.ncbi.nlm.nih.gov/ gorf/gorf.html)查找基因的开放阅读框; 借助EXPASY工具中的Protparam (http://www.expasy. ch/tools/protparam.html)分析基因编码蛋白的氨基酸序列组成、分子量、等电点; 利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)和Psort (http://psort.hgc.jp/form.html)软件预测编码蛋白的信号肽及亚细胞定位情况; 通过ClustalW对ScPOD02与水稻POD家族基因的氨基酸序列[15]多重比对, 利用MEGA 5.05 (NJ, 1000 BootStrap)构建系统进化树。
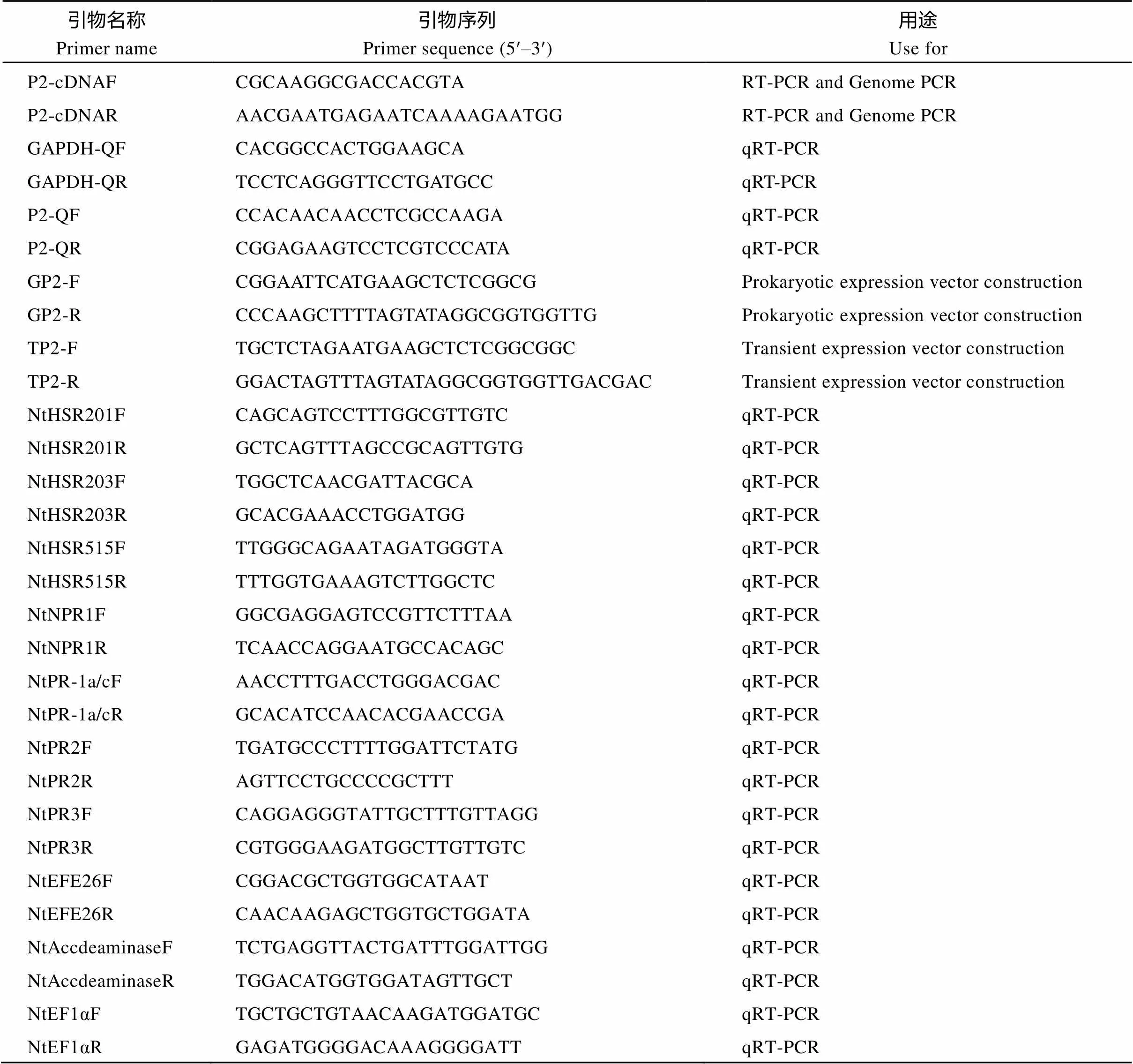
表1 本研究所用引物
1.4基因表达模式分析
利用qRT-PCR (Reverse transcription quantitative real-time polymerase chain reaction)方法, 于ABI 7500 Real-time PCR System (美国)上检测在生物和非生物胁迫下的基因表达情况。应用Primer Premier 5.0设计基因特异性定量引物P2-QF/R (表1), 内标甘油醛-3-磷酸脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase,) (GenBank登录号为CA254672)引物为GAPDH-Q/F (表1)。qRT-PCR反应体系含FastStart Universal SYBR Green Master (ROX) (Roche, China) 10 μL、cDNA (10×稀释液) 1.0 μL、上下游引物(10 μmol L–1)各0.8 μL、ddH2O 7.4 μL。扩增程序为50℃ 2 min; 95℃ 10 min; 95℃ 15 s, 60℃ 1 min, 循环40次。每个样品3次重复, 以无菌水作对照, 采用2–ΔΔCT算法[26]计算基因相对表达量, 借助DPS软件进行数据显著性分析, 应用Origin 8.0软件作图。在黑穗病菌接种材料中, 为消除机械损伤的影响,基因的相对表达量为接菌材料的基因表达水平扣除相应时 间点对照(接种无菌蒸馏水)的基因表达水平。
1.5基因原核表达分析与平板胁迫验证
以含有目标基因的阳性质粒pMD19-T- ScPOD02为模板, 利用引物GP2-F/R (表1)扩增获得带有d III和H Ι酶切位点的基因ORF片段。然后, 对胶回收片段及原核表达质粒pET 32a进行双酶切及T4连接酶连接, 构建重组质粒pET 32a-ScPOD02。将菌液PCR及测序正确的重组阳性质粒转入原核表达菌株BL21感受态细胞中, 涂布于含有80 μg mL–1氨苄青霉素的LB固体培养基上, 经37℃培养过夜, 随后挑取单克隆点进行菌液PCR检测及质粒单、双酶切鉴定。取验证正确的阳性重组菌株BL21 pET 32a-ScPOD02以及空白菌株BL21和空载BL21 pET 32a菌液, 分别加入到20 mL LB液体培养基中, 于37℃下200转 min–1振荡培养至OD600约为0.6后, 加入异丙基硫代半乳糖苷(IPTG)至终浓度为1.0 mmol L–1, 在28℃下200转min–1进行蛋白诱导, 分别于0、0.5、1、2和3 h取样。将上述样品在4℃下8000转 min–1离心10 min收集菌体, 去除上清液后, 加入30 μL 2×蛋白上样缓冲液, 混匀后于100℃水浴5 min进行裂解, 各取10 μL上清液于12%十二烷基磺酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)进行检测, 最后经考马斯亮蓝染色和成像分析[27]。
当BL21 pET 32a和BL21 pET 32a-ScPOD02菌液分别经37℃振荡培养至OD600为0.6时, 加入IPTG至终浓度为1.0 mmol L–1, 经28℃诱导12 h后, 将菌液稀释到OD600为0.6, 然后将其分别稀释1×10–3与1×10–4倍。各取10 μL上述稀释液, 分别点至含有0、15%、30%和45% PEG-8000的LB平板上(含80 μg mL–1氨苄青霉素), 37℃培养过夜后, 收集平板胁迫照片[27]。
1.6过表达载体构建与瞬时表达分析
以含有目标基因的阳性质粒pMD19-T- ScPOD02为模板, 利用引物TP2-F/R (表1)扩增获得带有I和I酶切位点的基因ORF片段。然后, 对胶回收片段及过表达载体质粒pCAMBIA 1301进行双酶切及T4连接酶连接, 构建重组质粒pCAMBIA 1301-ScPOD02。将菌液PCR及测序正确的重组阳性质粒转入根癌农杆菌菌株EHA105感受态细胞中, 涂布于含有卡那霉素(50 μg mL–1)和利福平(35 μg mL–1)的LB固体培养基上, 经28℃培养过夜, 随后挑取单克隆点进行菌液PCR检测及质粒单、双酶切鉴定。将验证正确的阳性重组菌株EHA105 pCAMBIA 1301-ScPOD02以及空载EHA105 pCAMBIA 1301菌液分别加入含50 μg mL–1卡那霉素和35 μg mL–1利福平的LB液体培养基中, 于28℃振荡培养过夜。离心收集菌体后, 用含有200 μmol L–1乙酰丁香酮的MS液体培养基重悬菌体至OD600为0.8, 然后将农杆菌菌液针刺注射到6~8片叶龄的本氏烟叶片上。参考Su等[28]的方法分析DAB染色及本氏烟相关免疫标记基因(表1)的表达情况。所有处理均3次生物学重复。
2 结果与分析
2.1 甘蔗基因克隆与序列分析
克隆到甘蔗基因的cDNA (GenBank登录号为KU593507)全长为1434 bp, ORF区为1047 bp, 编码348个氨基酸(图1-A)。该基因的基因组DNA (GenBank登录号为KU593508)全长1558 bp, 含有2个外显子和1个内含子, 内含子长度为124 bp, 其边界符合“GT-AG”的内含子法则(图1-B)。蛋白一级结构预测分析表明,推导的编码蛋白分子质量为38.12 kD, 理论等电点为6.67。SignalP和Psort软件预测结果显示, ScPOD02含有信号肽, 其剪切位点处于第28和第29位氨基酸处, 定位于细胞外(含细胞壁)的概率最大(66.7%)。蛋白结构域预测显示, ScPOD02具有完整的POD保守结构域。Blast分析表明, ScPOD02与高粱POD (GenBank登录号为XP_002457709.1)的氨基酸序列同源性高达93%。将基因推导的编码蛋白与部分水稻PODs家族基因的氨基酸序列进行系统进化树构建显示, ScPOD02与水稻OsPrx11 (GenBank登录号为gi|55700889)在进化上属于同一个进化分支(图2)。综上,可能为酸性胞外分泌/细胞壁类型的I.1型过氧化物酶家族成员。
2.2 甘蔗黑穗病菌胁迫下的基因表达
受黑穗病菌侵染后, 甘蔗抗病品种LC05-136中基因的表达量在胁迫初期(1 d)即达到峰值, 约为对照的1.15倍, 3 d和7 d后基因表达量下降且低于对照水平; 而YZ03-258、YZ01-1413和YT96-86中基因表达水平呈现先下降后上升的趋势, 在3 d或7 d时达到峰值, 分别为对照的1.28、1.47和1.59倍。在甘蔗中感和感病品种中,基因的表达模式在ROC22和YZ03-103中分别与在LC05-136和YZ03-258/YZ01- 1413/ YT96-86中的表达模式相同, 而其余3个材料中基因表达量基本维持不变(FN40)或出现小幅下降(GT02-467和FN39)。总体而言, 除ROC22和YZ03-103外,基因在甘蔗抗病品种中受黑穗病菌诱导上调表达, 而在中感和感病品种中的基因表达量基本维持不变或略有降低。
A:方框代表起始密码子, 椭圆代表终止密码子; B: 方框表示外显子, 横线表示内含子; 内含子的初始碱基为GT, 结束碱基为AG; 数字代表相应的序列长度。
A: initiation and termination codons are highlighted in box and oval, respectively; B: box and line represent extron and intron, respectively. The starting and ending bases of the intron were GT and AG, respectively. The numbers stand for the length of the corresponding sequence.
通过ClustalW进行序列推导蛋白的多重比对后, 利用MEGA 5.05进行系统进化树的构建。GenBank登录号如图。
The phylogenetic tree of PODs was constructed by MEGA 5.05 after making a multiple alignment of coding protein sequences with ClustalW. GenBank accession numbers were shown in the tree.
甘蔗抗黑穗病品种: YZ03-258、YZ01-1413、YT96-86和LC05-136; 甘蔗中感黑穗病品种: GT02-467、ROC22和FN39; 甘蔗感黑穗病品种: YZ03-103和FN40。数据以的表达量为参照标准进行归一化处理。为消除机械损伤的影响,基因的相对表达量为接菌材料的基因表达水平扣除相应时间点对照(接种无菌蒸馏水)的基因表达水平。所有的时间点的数据为平均值±标准误 (= 3)。柱上不同的字母代表显著性的差异(-value ≤ 0.05)。
Sugarcane smut-resistant cultivars were YZ03-258, YZ01-1413, YT96-86, and LC05-136. Sugarcane smut-middle-susceptible cultivars were GT02-467, ROC22, and FN39. Sugarcane smut-susceptible cultivars were YZ03-103 and FN40. Data was normalized to theexpression level.To eliminate the influence of mechanical damage, the relative expression of thegene under smut pathogen stress was calculated by the expression level of the inoculated sample minus the level of the mock at each corresponding time point. All data points were the means the average value ± SE (= 3). Bars superscripted by different lowercase letters are significantly different (-value ≤ 0.05).
2.3基因在不同非生物胁迫下的表达
图4所示,基因在不同非生物胁迫下的表达模式呈多样化。其转录本在SA和ABA胁迫初期(3 h)即达到峰值, 分别为对照的6.17倍和5.60倍, 处理6~12 h后,基因表达量均恢复到对照水平。在PEG处理下,基因的表达水平总体显著高于对照, 且在12 h达到峰值, 为对照的6.75倍。在NaCl胁迫下,在各时间点间的表达量差异显著, 基因表达模式为“下降—上升—下降”的趋势, 其转录本在12 h时为对照的1.91倍。在MeJA和H2O2胁迫下, 相比于对照, 随着胁迫时间的延长,基因的表达量略有下降或基本保持不变。因此,基因能够积极应答SA、ABA、PEG和NaCl胁迫。
数据以的表达量为参照标准进行归一化处理。所有的数据均为扣除对照后的平均值±标准误(= 3)。柱上不同的字母代表显著性的差异(-value ≤0.05)。SA: 水杨酸; MeJA: 茉莉酸甲酯; ABA: 脱落酸; PEG: 聚乙二醇(模拟干旱); H2O2: 过氧化氢; NaCl: 氯化钠。
Data was normalized to theexpression level.All data points (with the deduction of their mocks) were the means the average value ± SE (= 3). Bars superscripted by different lowercase letters are significantly different (-value ≤0.05). SA: salicylic acid; MeJA: methyl jasmonate; ABA: abscisic acid; PEG: polyethylene glycol (simulate drought treatment); H2O2: hydrogen peroxide; NaCl: sodium chloride.
(A) M1: DNA marker 100 bp; M2: DNA marker 15000+2000 bp; 1: BL21 pET 32a/H I的单酶切产物; 2:ORF PCR产物; 3: BL21 pET 32a-ScPOD02/R I的单酶切产物; 4: BL21 pET 32a-ScPOD01/R I+dIII的双酶切产物。箭头表示目的基因。(B) M3: 蛋白marker; 1~5: BL21 pET 32a-ScPOD02分别诱导3、2、1、0.5和0 h; 6:BL21 pET 32a诱导3 h; 7: 未经诱导的BL21 pET 32a; 8:BL21诱导3 h; 9: 未经诱导的BL21。箭头表示目标蛋白ScPOD02。
(A)M1: DNA marker 100 bp; M2: DNA marker 15000+2000 bp; 1: BL21 pET 32a/H I; 2:ORF PCR product; 3: BL21 pET 32a-ScPOD02/R I; 4: BL21 pET 32a-ScPOD02/R I+dIII; The arrow indicates the targeted fragment of. (B) M3: Protein marker; 1–5:BL21 pET 32a-ScPOD02induction for 3, 2, 1, 0.5, and 0 h, respectively; 6:BL21 pET 32a induction for 3 h; 7:BL21 pET 32a without induction; 8:BL21 induction for 3 h;9:BL21 without induction. The arrow indicates the inducted protein of ScPOD02.
BL21 pET 32a和BL21 pET 32a-ScPOD02菌液经IPTG诱导表达后稀释至OD600为0.6, 然后分别稀释1×10–3倍与1×10–4倍。各取10 μL 1×10–3(LB平板红线左边区域)和1×10–4(LB平板红线右边区域)菌液点至含0、15%、30%和45% PEG的LB平板培养基上。
After induction by IPTG, the cultures of BL21 pET 32a and BL21 pET 32a-ScPOD02 were adjusted to OD600=0.6. Then 10 μL cultures from 1×10–3(left side of red line on LB plate) and 1×10–4(right side of red line on LB plate) dilutions were spotted onto LB plates with 0, 15%, 30%, and 45% PEG, respectively
2.4基因的原核表达分析与平板胁迫验证
酶切验证结果(图5-A)表明, 本试验成功构建了原核表达载体pET 32a-ScPOD02。将该质粒转化原核表达菌株BL21后, 观察不同时间点目标蛋白的诱导表达情况。SDS-PAGE分析显示, 经IPTG诱导0.5 h后, 重组菌BL21 pET 32a-ScPOD02在约60 kD处出现目标蛋白条带, 且融合蛋白累积量随着IPTG诱导时间的延长(0.5~3.0 h)而增多(图5-B)。鉴于在甘蔗中积极响应PEG胁迫(图4), 我们通过原核平板胁迫进一步观察比较BL21 pET 32a和BL21 pET 32a-ScPOD02在外源胁迫下的菌落长势。结果(图6)显示, 重组菌BL21 pET 32a-ScPOD02在添加PEG的LB平板培养基上的菌落长势相比于对照稍多, 表明ScPOD02蛋白可以提高PEG胁迫(模拟干旱)条件下重组菌细胞的生长。
2.5基因的瞬时表达
将携带有目标基因的过表达载体pCAMBIA 1301ScPOD02 (图7-A)转化EHA105菌株, 借助农杆菌介导法侵染本氏烟叶片中后, 48 h时被侵染叶片的DAB染色结果较对照颜色略深(图7-B), 表明其叶片中H2O2含量增多, 叶片内出现过氧化现象。定量检测发现, 过表达基因24 h后, 本氏烟叶片中的目标基因(图8-A)及过敏性反应(HR)相关基因、和ET合成依赖基因、(图8-B)均出现明显上调表达。
(A) M1: DNA marker 15000+2000 bp; M2: DNA marker 100 bp; 1: pCAMBIA 1301/I的单酶切产物; 2:ORF PCR产物: 3: pCAMBIA 1301-/I的单酶切产物; 4: pCAMBIA 1301-/I+I的双酶切产物。箭头表示目的基因。(B)农杆菌侵染本氏烟叶片48 h后的DAB染色情况。
(A) M1: DNA marker 15000+2000 bp; M2, DNA marker 100 bp; 1: pCAMBIA 1301/I; 2,ORF PCR product; 3: pCAMBIA 1301-/I; 4: pCAMBIA 1301-/I+I. The arrow indicates the targeted fragment of. (B) DAB staining inleaves at 48 h afterstrain infiltration.
本氏烟免疫相关记基因包括过敏反应相关基因、和, 水杨酸相关基因, 茉莉酸相关基因、和, 乙烯合成依赖相关基因和。以作为内参。以携带空载体pCAMBIA 1301的农杆菌为对照。所有数据均为平均值±标准误(= 3)。柱上不同的字母代表显著性的差异(-value ≤0.05)。Mock: 35S::00。
The immunity related marker genes in theincluding the hypersensitive response marker genes,, and, the salicylic acid related gene, the jasmonate associated genes, and, the ethylene synthesis depended genesand.was used to normalize the transcript levels. Mock:strain carrying pCAMBIA 1301. All data points are means the average value ± SE (= 3). Bars superscribed by different lowercase letters are significantly different (-value ≤0.05). Mock: 35S::00.
3 讨论
POD作为植物体内抗氧化系统中的关键酶之一, 在1955年被首次报道[11]。植物是多基因家族组成的酶类, 包含多种同工酶, 基因结构和功能多样, 广泛参与植物体内多种代谢活动[15]。Passardi等[15]将水稻的138个过氧化物酶基因分成8类(Ι~VIII),其中某些又分成几个亚类, 比如Ι类中包括Ι.1~Ι.5亚类; IV类中包括IV.1~IV.4亚类; V类中包括V.1亚类。如今, 随着测序费用的大幅度下降, 极大地推进了基因组和转录组测序工作, 越来越多的基因被克隆或筛选出来[9-10]。甘蔗倍性复杂导致其至今仍然归入无参考基因组的物种, 因此, 甘蔗基因分离尤其是基因结构及功能的研究进展相对缓慢[29-30]。本研究根据课题组前期转录组测序结果, 以崖城05-179为研究材料, 克隆得到1条甘蔗I.1型过氧化物酶家族成员基因, 序列分析发现,基因组含有2个外显子和1个内含子。然而胡小文等[20]研究显示甘蔗、斑茅和割手密中3个III型(GenBank登录号为KJ001797、KJ001798、KJ001799)的基因组DNA均包含4个外显子。Tognolli等[9]综合拟南芥中基因的结构特点, 提出四外显子、三内含子的典型基因组结构, 但并不是所有的单子叶植物基因都具有该基因组结构特点, 这可能与该基因的功能多样性有关。
前人研究显示, 真核细胞中家族基因的亚细胞定位的不同与其功能有关[31]。Ren等[31]通过对10个重组PRX在本氏烟表皮细胞中的亚细胞定位分析表明, 8个PRX (PRX2、3、4、7、20、21、22和23)定位在液泡中, 另外2个PRX (PRX6和PRX24)定位在细胞外围, 即这些细胞被分别定位在细胞膜和/或细胞壁上, 说明该类基因属于细胞壁类型的PRX。本研究亚细胞定位预测结果显示, ScPOD02定位于细胞外(含细胞壁)的概率最大, 暗示ScPOD02可能为胞外分泌/细胞壁类型的POD家族成员, 这与Ren等[31]从杨树所克隆的和基因的定位结果相似, 表明其可能行使相似的功能, 参与细胞壁的新陈代谢, 如木质素聚合反应等。
在植物的免疫防御机制中起重要作用, 其表达受细菌、真菌、病毒和类病毒的诱导[32-33]。Esh等[34]的研究显示, 受黑穗病菌侵染能够导致甘蔗体内POD酶活性变化。许莉萍等[12]研究发现, 黑穗病菌侵染后抗、感甘蔗品种的POD酶活性均升高, 但感病品种酶活性增加程度远远高于抗病品种, 这表明POD酶活性与品种抗性有一定的关联, 但是这一现象是否在更多不同遗传背景的其他甘蔗基因型上也能重演, 目前还尚未可知。温琪汾等[14]通过对4个抗病品种、3个感病品种谷子不同生长期的POD活性测定也发现, 不同种质资源的黑穗病抗性存在明显差异, 抗病品种POD活性明显高于感病品种, 表明POD有望作为一种遗传标记, 并具有开发为功能标记的潜力。Zhang等[35]对玉米中筛选出的18个基因研究发现, 其表达量在感病品种中下调表达, 在抗病品种中则相反。LaO等[21]对甘蔗中具有4-外显子典型基因组结构的基因及其同系物研究, 发现其表达量在接种后的感黑穗病品种中仅在24 h出现轻微下调, 而在抗病品种中72 h则出现强烈的上调表达。这种病原菌诱导特性与甘蔗基因的表达特性是一致的, 即接种黑穗病菌后,基因的表达量在甘蔗抗病品种中受黑穗病菌诱导上调表达, 而在中感和感病品种中的基因表达量基本维持不变或略有降低, 暗示可能在甘蔗防御黑穗病菌的侵染中发挥潜在作用。
病菌的侵染会导致植物细胞过氧化加剧, 引起植物免疫应答反应, 其中过氧化物含量升高、膜脂过氧化等现象是细胞应答外源侵染的主要表现[33]。本试验表明, 带有重组质粒的农杆菌侵染本氏烟后, 叶片H2O2含量增加, DAB染色加深(图7-B), 且HR相关基因、及ET合成依赖基因、均出现明显上调表达(图8-B), 提示可能参与甘蔗HR与免疫应答。
前人研究表明,基因不仅能够被植物生长激素, 如SA、ABA、茉莉酸(JA), 乙烯(ET)调节, 也能够被多种非生物逆境(盐碱、干旱、低温等)调节, 说明基因在植物生长过程中发挥重要作用[36]。SA是植物系统获得性抗性(SAR)的主要诱导因子, 同时也是病原菌侵染后植物活化一系列植物防卫反应的信号传导途径中的重要组分[36]。本研究中, SA胁迫初期(3 h)诱导基因显著上调表达(图4), 表明可能参与SAR。Wang等[37]研究番茄基因在不同外源激素胁迫下的表达情况显示, 受SA、JA和ABA胁迫后,基因表达量同样增加。ABA是调控植物适应逆境胁迫的重要植物激素之一[38], 极端温度、干旱、盐害等胁迫能增加植物体内ABA的含量从而进一步诱发ABA响应基因的表达[39]。本研究中, 携带的重组原核表达菌株在含PEG添加剂的培养基中的菌落长势较对照快(图6), 此外, 该基因在ABA、PEG及NaCl胁迫下表达量增加(图4), 表明ABA可能在干旱及盐胁迫中发挥信号因子作用, 以诱导转录本累积。这一研究结果与Novo-Uzal等[40]研究的银杏()基因在NaCl胁迫下表达量提高的结果类似。
4 结论
从甘蔗中分离到了一个基因(GenBank登录号为KU593507), 其cDNA全长为1434 bp, 基因组全长1558 bp, 含有2个外显子和1个内含子, ORF区为1047 bp, 编码348个氨基酸。ScPOD02属于酸性胞外分泌/细胞壁类型的I.1型过氧化物酶家族成员。ScPOD02原核诱导蛋白大小约为60 kD。在PEG胁迫下, 重组菌BL21 pET 32a-相比对照表现出较强的耐受能力。在9个不同甘蔗基因型与黑穗病菌互作过程中,基因在抗病品种中受该病原菌诱导上调表达, 但在中感及感病品种中的表达量基本不变或略微下调, 且的瞬时表达能够诱发本氏烟的防御反应。此外,积极应答SA、ABA、PEG和NaCl胁迫, 推测该基因在甘蔗免疫应答及抗旱和抗盐害反应中发挥一定作用。
[1] 陈如凯, 许莉萍, 林彦铨, 邓祖湖, 张木清, 罗俊, 张华, 高三基, 徐景升, 徐良年, 阙友雄, 陈平华, 袁照年, 林国栋. 现代甘蔗遗传育种. 北京: 中国农业出版社, 2011. pp 1–3 Chen R K, Xu L P, Lin Y Q, Deng Z H, Zhang M Q, Luo J, Zhang H, Gao S J, Xu J S, Xu N L, Que Y X, Chen P H, Yuan Z N, Lin G D. Modern Sugarcane Genetic Breeding. Beijing: China Agriculture Press, 2011. pp 1–3 (in Chinese)
[2] 昝逢刚, 应雄美, 吴才文, 赵培方, 陈学宽, 马丽, 苏火生, 刘家勇. 98份甘蔗种质资源遗传多样性的AFLP分析. 中国农业科学, 2015, 48: 1002–1010 Zan F G, Ying X M, Wu C W, Zhao P F, Chen X K, Ma L, Su H S, Liu J Y. Genetic diversity analysis of 98 collections of sugarcane germplasm with AFLP markers., 2015, 48: 1002–1010 (in Chinese with English abstract)
[3] Ye J, Que Y X, Li Y R, Xu L P. Evaluating sugarcane productivity in China over different periods using data envelopment analysis and the malmquist index., 2016: 1–10
[4] 许莉萍, 陈如凯. 甘蔗黑穗病及其抗病育种的现状与展望. 福建农业学报, 2000, 15(2): 26–31 Xu L P, Chen R K. Current status and prospects of smut and smut resistance breeding in sugarcane., 2000, 15(2): 26–31 (in Chinese with English abstract)
[5] Que Y X, Xu L P, Wu Q B, Liu Y F, Ling H, Liu Y H, Zhang Y Y, Guo J L, Su Y C, Chen J B, Wang S S, Zhang C G. Genome sequencing ofprovides insights into the pathogenic mechanisms of sugarcane smut., 2014, 15: 996
[6] Sundar A R, Barnabas E L, Malathi P, Viswanathan R. A Mini- review on Smut Disease of Sugarcane Caused by. Croatia: InTech, 2012. pp 109–128
[7] Scortecci K C, Creste S, Calsa T J, Xavier M A, Landell M G A, Figueira A, Benedito V A. Challenges, opportunities and recent advances in sugarcane breeding., 2012: 267–296
[8] Blokhina O, Virolainen E, Fagerstedt K V. Antioxidants, oxidative damage and oxygen deprivation stress: a review., 2003, 91: 179–194
[9] Tognolli M, Penel C, Greppin H, Simon P. Analysis and expression of the class III peroxidase large gene family in., 2002, 288: 129–138
[10] Hiraga S, Yamamoto K, Ito H, Sasaki K, Matsui H, Honma M, Nagamura Y, Sasaki T, Ohashi Y. Diverse expression profiles of 21 rice peroxidase genes., 2000, 471: 245–250
[11] Hiraga S, Sasaki K, Ito H, Ohashi Y, Matsui H. A large family of class III plant peroxidases., 2001, 42: 462–468
[12] 许莉萍, 王建南, 陈如凯. 甘蔗对黑穗病的生化反应及其与抗病性的关系. 甘蔗, 1994, 1(3): 13–16 Xu L P, Wang J N, Chen R K. Biochemical reaction of sugarcane to smut and its relation to resistance., 1994, 1(3): 13–16 (in Chinese)
[13] 邢慧清. 高粱丝黑穗病群体生理指标测定与抗病基因分子标记分析. 沈阳师范大学硕士学位论文, 辽宁沈阳, 2013 Xing H Q. Physiological Index Determination of Sorghum Head Smut Group and Molecular Markers Analysis of Disease Resistance Genes. MS Thesis of Shenyang Normal University, Shenyang, China, 2013 (in Chinese with English abstract)
[14] 温琪汾, 刘润堂, 王纶, 王星玉, 师颖. 谷子种质资源抗黑穗病鉴定与过氧化物酶研究. 植物遗传资源学报, 2006, 7: 349–351 Wen Q F, Liu R T, Wang L, Wang X Y, Shi Y. Screening of foxtail millet germplasm for resistance to grain smut and related peroxidase study., 2006, 7: 349–351 (in Chinese with English abstract)
[15] Passardi F, Longet D, Penel C, Dunand C. The class III peroxidase multigenic family in rice and its evolution in land plants., 2004, 65: 1879–1893
[16] Cesarino I, Araújo P, Leme A F P, Creste S, Mazzafera P. Suspension cell culture as a tool for the characterization of class III peroxidases in sugarcane., 2013, 62: 1–10
[17] Cesarino I, Araujo P, Mayer J L S, Leme A F P, Mazzafera P. Enzymatic activity and proteomic profile of class III peroxidases during sugarcane stem development., 2012, 55: 66–76
[18] Cesarino I, Araujo P, Leme A F P, Creste S, Mazzafera P. Suspension cell culture as a tool for the characterization of class III peroxidases in sugarcane., 2013, 62: 1–10
[19] 胡小文, 姚艳丽, 邢淑莲, 徐磊, 刘洋. 割手密过氧化物酶基因() cDNA克隆与功能分析. 热带作物学报, 2015, 36: 1290–1296 Hu X W, Yao Y L, Xing S L, Lei L, Liu Y. Isolation and characterization of peroxidases gene () cDNA inL., 2015, 36: 1290–1296 (in Chinese with English abstract)
[20] 胡小文, 姚艳丽, 刑淑莲, 徐磊, 刘洋. 甘蔗、斑茅及割手密III型过氧化物酶基因克隆及比较分析. 分子植物育种, 2015, 13: 2340–2347 Hu X W, Yao Y L, Xing S L, Xu L, Liu Y. Isolation and comparative analysis of class III peroxidases gene DNA on,and., 2015, 13: 2340–2347 (in Chinese with English abstract)
[21] LaO M, Arencibia A D, Carmona E R, Acevedo R, Rodríguez E, León O, Santana I. Differential expression analysis by cDNA- AFLP ofspp. after inoculation with the host pathogen., 2008, 27: 1103–1111
[22] 许莉萍, 陈如凯, 潘大仁, 林胜杰. 甘蔗分离群体的分析及抗感黑穗病池的构建. 福建农业大学学报, 2001, 30: 153–157 Xu L P, Chen R K, Pan D R, Lin S J. Analysis of sugarcane segregating population and construction of pools resistant or sensitive to smut., 2001, 30: 153–157 (in Chinese with English abstract)
[23] Su Y C, Wang Z Q, Xu L P, Peng Q, Liu F, Li Z, Que Y. Early selection for smut resistance in sugarcane using pathogen proliferation and changes in physiological and biochemical indices., 2016, 7: 1133
[24] Su Y C, Guo J L, Ling H, Chen S S, Wang S S, Xu L P, Allan A C, Que Y X. Isolation of a novel peroxisomal catalase gene from sugarcane, which is responsive to biotic and abiotic stresses., 2014, 9: e84426
[25] 姚伟, 余爱丽, 徐景升, 周会, 张木清, 陈如凯. 甘蔗基因组DNA简单和快速提取方法. 农业生物技术学报, 2005, 13: 121–122 Yao W, Yu A L, Xu J S, Zhou H, Zhang M Q, Chen R K. A simple and quick method for extracting sugarcane genomic DNA., 2005, 13: 121–122 (in Chinese)
[26] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod., 2001, 25: 402–408
[27] Su Y C, Xu L P, Xue B T, Wu Q B, Guo J L, Wu L G, Que Y X. Molecular cloning and characterization of two pathogenesis-related β-1,3-glucanase genesandfrom sugarcane infected by., 2013, 32: 1503–1519
[28] Su Y C, Xu L P, Fu Z W, Yang Y T, Guo J L, Wang S S, Que Y X., encoding an acidic class III chitinase of sugarcane, confers positive responses to biotic and abiotic stresses in sugarcane., 2014, 15: 2738–2760
[29] Grivet L, Arruda P. Sugarcane genomics: depicting the complex genome of an important tropical crop., 2002, 5: 122–127
[30] 阙友雄, 杨志霞, 许莉萍, 陈如凯. 对甘蔗受黑穗病菌侵染后差异表达基因的分离与鉴定. 作物学报, 2009, 35: 452–458 Que Y X, Yang Z X, Xu L P, Chen R K. Isolation and identification of differentially expressed genes in sugarcane infected by., 2009, 35: 452–458 (in Chinese with English abstract)
[31] Ren L L, Liu Y J, Liu H J, Qian T T, Qi L W, Wang X R, Zeng Q Y. Subcellular relocalization and positive selection play key roles in the retention of duplicate genes of populus class III peroxidase family., 2014, 26: 2404–2419
[32] Blokhina O, Virolainen E, Fagerstedt K V. Antioxidants, oxidative damage and oxygen deprivation stress: a review., 2003, 91: 179–194
[33] Dı́Az J, Bernal A, Pomar F, Merino F. Induction of shikimate dehydrogenase and peroxidase in pepper (L.) seedlings in response to copper stress and its relation to lignification., 2001, 161: 179–188
[34] Esh A, Guirgis A, El-kholi M, El-Absawy E, Nasr M, Hassanien E. The activity of pathogenesis related proteins in smut resistant and susceptible sugarcane (GT54-9) mutants induced by gamma radiation., 2014, 1: 00024
[35] Zhang S P, Xiao Y N, Zhao J R, Wang F G, Zheng Y L. Digital gene expression analysis of early root infection resistance tof. sp.in maize., 2013, 288: 21–37
[36] Liu B, Xue X D, Cui S, Zhang X Y, Han Q M, Zhu L, Liang X F, Wang X J, Huang L L, Chen X M, Kang Z S. Cloning and characterization of a wheat β-1,3-glucanase gene induced by the stripe rust pathogenf. sp.., 2010, 37: 1045–1052
[37] Wang C J, Chan Y L, Shien C H, Yeh K W. Molecular characterization of fruit-specific class III peroxidase genes in tomato ()., 2015, 177: 83–92
[38] 姚璇. 植物逆境胁迫相关基因的研究-和基因的功能分析. 武汉大学博士学位论文, 湖北武汉, 2011 Yao X. The Characterization of Plant Stress-related Genes Functional Analyses onandGenes. PhD Dissertation of Wuhan University, Wuhan, China, 2011 (in Chinese with English abstract)
[39] Anderberg R J, Walker-Simmons M K. Isolation of a wheat cDNA clone for an abscisic acid-inducible transcript with homology to protein kinases., 1992, 89: 10183–10187
[40] Novo-Uzal E, Gutiérrez J, Martínez-Cortés T, Pomar F. Molecular cloning of two novel peroxidases and their response to salt stress and salicylic acid in the living fossil., 2014, 114: 923–936
Molecular Cloning and Functional Identification of Peroxidase Genein Sugarcane
SU Ya-Chun, WANG Zhu-Qing, LI Zhu, LIU Feng, XU Li-Ping*, QUE You-Xiong, DAI Ming-Jian, and Chen Yun-Hao
Key Laboratory of Sugarcane Biology and Genetic Breeding (Fujian), Ministry of Agriculture / Fujian Agriculture and Forestry University / Sugarcane Research & Development Center, China Agricultural Technology System, Fuzhou 350002, China
Peroxidases (PODs), widely existing in various plant organs and different development stages, play a vital role in plant growth and development, and also respond to adverse stresses. Based on the previous transcriptome data, we isolated a cDNA (GenBank accession number KU593507) and genomic DNA (GenBank accession number KU593508) sequences offrom smut resistant genotype Yacheng 05-179 infected byfor two days. Sequence analysis showed that the full length cDNA ofis 1434 bp with an ORF of 1047 bp in length, encoding 348 amino acids. Its genomic DNA length is 1558 bp containing two exons and one intron. Phylogenetic tree analysis demonstrated that ScPOD02 and rice OsPrx11 (GenBank accession number gi|55700889) were clustered into the same evolutionary branch, suggesting that ScPOD02 belongs to one of the acidic exocytosis/cell wall type of class I.1 peroxidase family members.was further ligated with a prokaryotic expression vector of pET 32a and then transformed intoBL21. An approximately 60 kD fusion protein was obtained by isopropyl-β-d-thiogalactoside induction. Compared with the control, the growth of recombinant BL21 cells was enhanced under the stress of polyethylene glycol, indicating its high tolerance to drought stress. qRT-PCR analysis showed that the transcripts ofwere up-regulated in sugarcane smut-resistant cultivars (YZ03-258, YZ01-1413, YT96-86, and LC05-136) byexcept for ROC22 and YZ03-103, but remained or slightly decreased in the middle-susceptible (FN39 and GT02-467) and susceptible (FN40) cultivars. In addition,positively responded to salicylic acid, abscisic acid, polyethylene glycol and sodium chloride stresses. The transient expression ofinwas performed usingmediated method. A deeper DAB staining color inleaves was observed after overexpressing. Furthermore, the target geneand thehypersensitive reaction (HR) marker genes (and) and ethylene synthesis dependent genes (and) were all up-regulated. These reach a conclusion that thehas potential roles in the immune response and in protecting sugarcane from drought and salt stresses.
Sugarcane;; Gene cloning; Biotic and abiotic stresses; Gene expression level; Prokaryotic expression analysis; Transient expression analysis
10.3724/SP.J.1006.2017.00510
本研究由福建省杰出青年科学基金项目(2015J06006), 福建农林大学杰出青年基金项目(xjq201630)和国家现代农业产业技术体系建设专项(CARS-20)资助。
This study was supported by the Fujian Natural Science Funds for Distinguished Young Scholar (2015J06006), the Research Funds for Distinguished Young Scientists in Fujian Agriculture and Forestry University (xjq201630), and the China Agriculture Research System (CARS-20).
许莉萍, E-mail: xlpmail@126.com
E-mail: syc2009mail@163.com
2016-07-04;
Accepted(接受日期): 2016-11-02;
Published online(网络出版日期): 2016-12-14.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20161214.1605.006.html

