芍药花多酚的纯化及其抗氧化活性研究
俞憬,陈冠林,杨璐齐,王煜坤,高永清,傅南琳
(1.广东药科大学食品科学学院,广东中山528458;2.佛山市职业病防治所,广东佛山528000;3.广东药科大学附属第一医院,广东广州510008)
芍药花多酚的纯化及其抗氧化活性研究
俞憬1,陈冠林2,杨璐齐1,王煜坤1,高永清1,傅南琳3,*
(1.广东药科大学食品科学学院,广东中山528458;2.佛山市职业病防治所,广东佛山528000;3.广东药科大学附属第一医院,广东广州510008)
研究大孔吸附树脂纯化芍药花多酚的条件和纯化后多酚的抗氧化能力。采用静态试验和动态试验确定纯化条件,计算纯化后多酚的含量。在供试的9种大孔吸附树脂中,HPD100树脂的吸附和洗脱效果最好。在室温下,以50%乙醇为洗脱剂,吸附流速和洗脱流速均为10mL/min时,纯化的芍药花多酚含量为721.72mgGAE/gDW,是未纯化前的1.57倍。通过DPPH、FRAP和ABTS三种方法测得纯化后芍药花多酚的抗氧化能力是未纯化前粗提物的1.35、1.44、1.62倍。
纯化;抗氧化;多酚;芍药花;大孔树脂
芍药(Paeonia lactiflora Pall.),为芍药科(Paenoiaeeae)芍药属(Paeonia)的著名草本花卉,在中国、日本以及韩国应用广泛[1-2]。芍药具有补虚、镇痛、解痉、抗炎以及抗氧化等作用[3-8]。芍药花富含亚麻酸、亚油酸、棕榈酸、多酚、黄酮、甾体以及蒽醌等有机化合物[9-10]。王爱晶[11]等研究发现,芍药色素耐热不耐光,对氧化剂和还原剂敏感;在碱性条件下芍药花色素不稳定,而在酸性条件下,其色素则较稳定。金英善[10]等研究发现,芍药花甲醇提取物的总酚含量最高而70%甲醇提取物的总酚含量最低。金英善[10]等应用DPPH法测定了芍药花提取物的抗氧化活性,结果显示芍药花提取物有较强的自由基清除能力,其中芍药花甲醇和水的提取物对自由基的清除能力较槲皮素强。何玲[12]等对芍药花色素提取工艺进行了研究,其优化工艺条件为提取温度75℃,pH2.2的75%乙醇,提取时间70min,在该条件下色素的得率为6.45%。除此之外,还有人对芍药花提取物的微量元素、黄酮、多糖以及抗氧化活性进行了研究[10,13-15]。从目前掌握的文献来看,虽有不少文章对芍药花进行了相关的研究,但应用大孔吸附树脂对芍药花多酚的纯化以及对纯化后芍药花多酚的抗氧化性进行系统的研究较少。本研究以芍药花为原料,应用不同型号的大孔吸附树脂对芍药花多酚进行纯化,并系统地测定纯化后芍药花多酚的抗氧化性,为开发芍药花多酚提供依据。
1 材料
1.1 材料与试剂
1.1.1 材料
芍药花购于广东省佛山市超市,干燥后用粉碎机粉碎,过20目筛,备用。
1.1.2 试剂
乙腈(色谱纯):德国Merck公司;乙醇(色谱纯):上海安谱科学仪器有限公司;水溶性维生素E、2,2'-联氨-双-3-乙基-苯并噻唑啉-6-磺酸、福林-酚试剂:美国Sigma公司;三吡啶三吖嗪和1,1-二苯基-2-三硝基苯肼:阿拉丁公司;三氯化铁、盐酸、乙酸钠、过硫酸钾、没食子酸、乙醇(分析纯):由天津化学试剂厂生产。
1.2 仪器与设备
UV-9600紫外/可见分光光度计:北京瑞利分析仪器有限公司;LEO-150S超声清洗仪:昆山力波超声波设备有限公司;ACQUITY UPLCH-CLASS超高效液相色谱仪:美国Waters公司。
2 方法
2.1 芍药花多酚的提取
准确称取1.0g芍药花粉末,加入50mL 40%乙醇,40℃下超声10min后抽滤,减压浓缩后,滤液备用。
2.2 树脂预处理
参照陈冠林等[16-17]的方法。
2.3 最佳树脂的选择
吸附率与解吸率的测定参照CHEN等[18]的方法。
2.4 静态试验
最佳吸附与洗脱条件的确定参照陈冠林等[16-17]的方法。
2.5 动态试验
2.5.1 最佳吸附流速的确定
参考火龙果色素吸附和洗脱流速[16-17],吸附和洗脱流速为10mL/min。
2.5.2 最佳洗脱剂用量的确定
参照陈冠林等[16-17]的方法。
2.5.3 多酚粗提物及其纯化物
按2.1提取后,滤液减压浓缩至干,得芍药花多酚粗提物;按2.5.2将纯化后的多酚滤液减压浓缩至干,得芍药花纯化物。将芍药花多酚粗提物以及纯化物溶于50%甲醇中,得待测物。
2.6 总酚含量的测定
参照Singleton等[19]的方法,结果以没食子酸当量(gallic acid equivalents,GAE)表示,单位为mg GAE/g DW(dryweight)。
2.7 FRAP法测定抗氧化活性
参照Ozgen以及Benzie等[20-21]的方法。以Trolox溶液为标样作标准曲线,样品的抗氧化活性用Trolox当量表示,单位为μmol Trolox/g。
2.8 DPPH法测定抗氧化活性
参照Cai等[22]的方法,以Trolox溶液为标样作标准曲线,样品的抗氧化活性用Trolox当量表示,单位为μmol Trolox/g。
2.9 ABTS法测定抗氧化能力
参照Ozgen[20]等方法。以Trolox溶液为标样作标准曲线,样品的抗氧化活性用TEAC(trolox equivalent antioxidantcapacity)表示[20],单位为μmol Trolox/g。
2.10 超高效液相色谱条件(Ultra Performance Liquid Chromatography,UPLC)
参照Chen等[15]的方法。
3 结果与分析
3.1 树脂的选择结果
大孔树脂对多酚的吸附和解吸能力结果见表1。

表1 大孔树脂对多酚的吸附和解吸能力Table1 Adsorp tion and desorption propertiesofmacroporous resins for polyphenols

续表1 大孔树脂对多酚的吸附和解吸能力Continue table1 Adsorption and desorption propertiesofmacroporous resins for polyphenols
由表1可见,在吸附试验中,ADS-7的吸附量和吸附率最高,其次依次分别是HPD100、HPD400、HPD700和D101,HPD-BTQH的吸附量和吸附率最差。以往的研究发现,大孔树脂的比表面和平均孔径对大孔树脂的吸附力有明显的影响[23-24],然而在本研究中,HPD100、HPD400、HPD700以及D101的比表面和平均孔径不同,但其吸附力是相近的,结果表明大孔树脂的比表面和平均孔径对芍药花多酚的吸附影响不大,这与以往的研究是一致的[25]。在解吸试验中,HPD100的解吸率和解吸量最高,其次分别是HPD700、D101和HPD450,ADS-7的解吸率和解吸量最低。树脂的极性对其吸附效率有明显的影响,极性越高,其解吸效率越差[26],对于弱极性的化合物则应选用极性弱且比表面大的树脂进行吸附[27]。综上所述,HPD100的吸附以及解吸性能高于其他8种树脂,这与火龙果色素的吸附和解吸结果是一致的[16-17],因此采用HPD100进行后续试验。
3.2 吸附条件的确定
3.2.1 pH值对吸附率的影响
pH值对吸附率的影响结果见图1。

图1 pH值对吸附率的影响Fig.1 Effectof pH on adsorption rate
从图1可见,pH值对吸附率的影响较大,在pH2~4的范围内,pH值的增大吸附率变化不大,pH值为4时吸附率最高,但随着pH值的增大其吸附率有所下降,这与大孔树脂吸附牡荆苷(vitexin)和异牡荆苷(isovitexin)是一致的[28]。多酚是酸性和弱极性的分子,因此对pH值敏感。在较低的pH值时,多酚容易被大孔树脂吸附,与此相反,在较高的pH值时,由于电离反应,多酚以离子形式存在使其更难被吸附[29],而以往的研究也发现,植物类多酚在pH值在3~5之间是比较稳定的[30],因此试验芍药花多酚溶液确定为pH4。
3.2.2 时间对吸附率的影响
时间对吸附率的影响结果见图2。
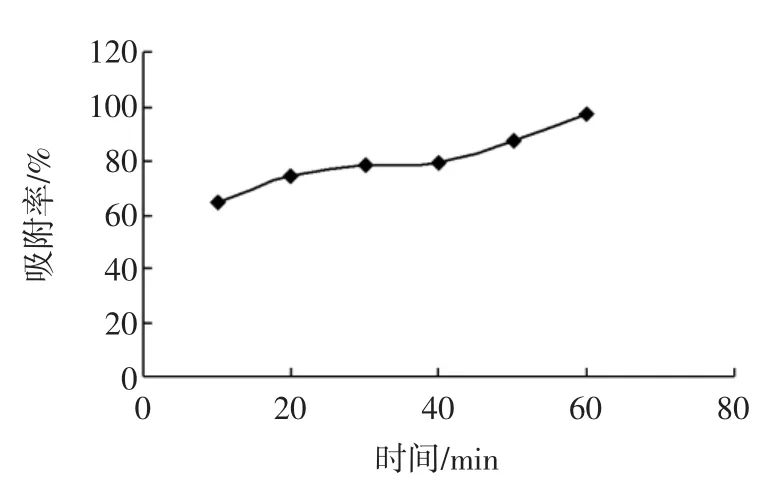
图2 时间对吸附率的影响Fig.2 Effectof timeon adsorption rate
由图2可知,在60min内,吸附率上升趋势明显,60min时吸附率达97%,溶液中大部分的多酚已被大孔树脂吸附,因此确定吸附时间为60min。
3.3 解吸条件的确定
3.3.1 乙醇浓度对解吸量的影响
乙醇浓度对解吸量的影响结果见图3。
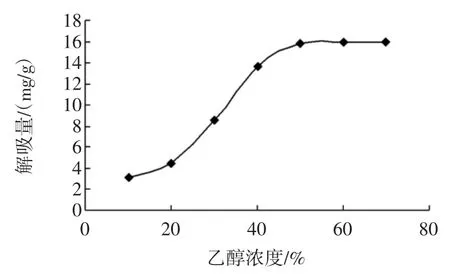
图3 乙醇浓度对解吸量的影响Fig.3 Effectof ethanol concentration on desorption capacity
从图3可以看出,乙醇浓度在50%时其洗脱量趋于平衡,乙醇浓度增加其解吸量也不会有明显的增加,这与以往的研究是一致的[31-32]。因此选择50%乙醇作为洗脱剂。
3.3.2 pH值对解吸量的影响
pH值对解吸量的影响结果见图4。

图4 pH值对解吸量的影响Fig.4 Effectof pH on desorption capacity
从图4可以看出,在pH值为2~8的范围内,解吸量呈波浪形,解吸效果最好的是pH值为3时。因此确定试验多酚解吸溶液的pH值为3。以往的研究发现,解吸液pH值对多酚的解吸有明显的影响,随着解吸液pH值的增加,其解吸效果下降,当解吸液pH值超过6时,其解吸率明显下降[28-29]。
3.3.3 时间对解吸率的影响
时间对解吸率的影响结果见图5。
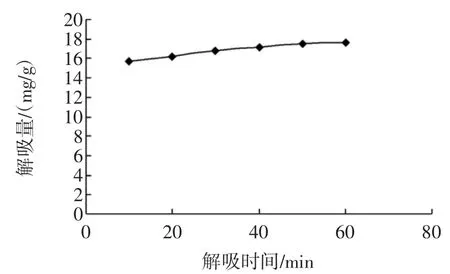
图5 时间对解吸量的影响Fig.5 Effectof timeon desorption capacity
从图5可以看出,60min时解吸量趋于平衡,增加解吸时间也不能明显提高解吸量。因此选择解吸时间为60min。
3.3.4 洗脱曲线
洗脱曲线结果见图6。
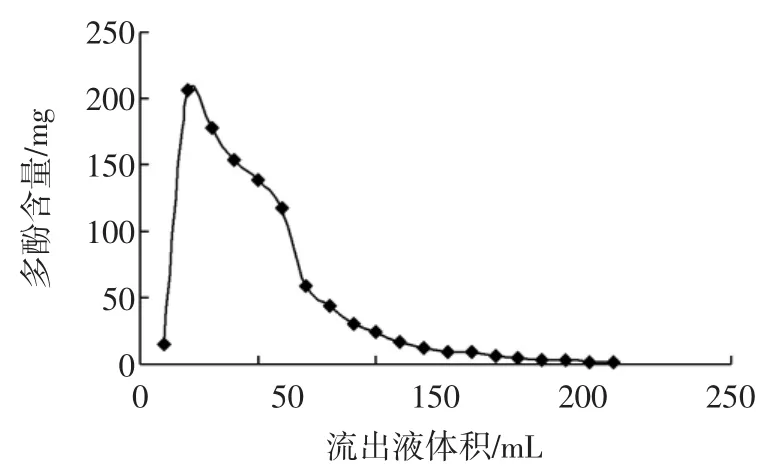
图6 芍药花多酚洗脱曲线Fig.6 Desorp tion curvesof polyphenolsobtained from the flower of Paeonia lactiflora Palls
由图6可知,洗脱剂为200mL时,芍药花多酚基本上全部被洗脱出来。故洗脱剂的最佳用量为200mL。
3.4 多酚含量及其抗氧化能力
多酚含量及其抗氧化能力结果见表2。
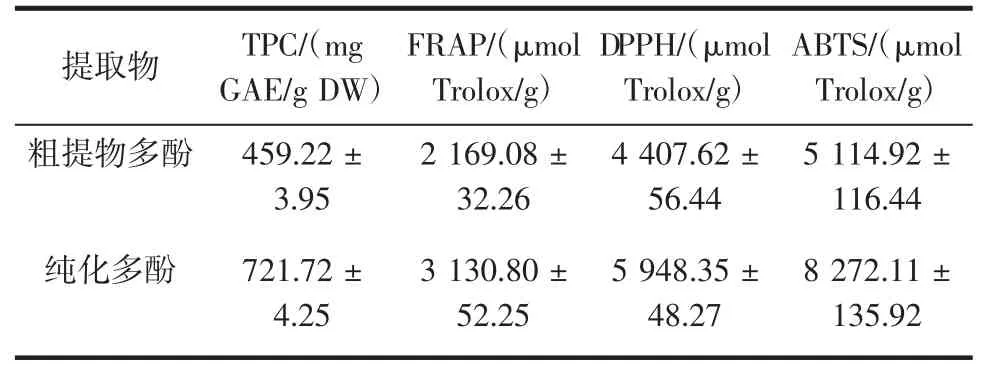
表2 芍药花的总酚含量及其抗氧化能力Table2 Totalphenolic contentand antioxidant capacity of extracts from the flower of Paeonia lactifora Palls
在优化条件下获得的纯化的多酚为721.72mg GAE/g DW,是未纯化的1.57倍,多酚含量明显增高。从表2可以看出,纯化后多酚的抗氧化能力明显增高,分别是未纯化的1.44(FRAP)、1.35(DPPH)以及1.62(ABTS)倍。
3.5 UPLC分析结果
UPLC法测得的每克芍药花中多酚的质量分数结果见表3,其色谱图见图7。

表3 纯化以及未纯化芍药花多酚的含量Table3 Concentrationsof phenolic com pounds in purification and unpurified phenolicsof the flower from Paeonia lactiflora Pall μg/g DW

图7 检测波长280 nm下多酚的超高效液相色谱图Fig.7 UPLC chrom atogram sof phenolicsdetected at thewavelength of 280 nm
未纯化前芍药花中异槲皮苷的含量最高,其含量为9 9811.79μg/g DW;其次是槲皮苷,其含量为73 989.69μg/g DW,芍药花中未检测到原儿茶酸、咖啡酸、丁香酸、异鼠李素以及槲皮素。纯化后芍药花多酚中异槲皮苷的含量明显增高,其含量为242791.14μg/gDW,是未纯化的2.43倍。槲皮苷的含量为150 564.44μg/g DW,是未纯化的2.03倍。芍药花中还含有没食子酸、(+)-儿茶素、香草酸、表儿茶素、对香豆酸、阿魏酸以及芦丁,其含量也较高。HE等[33]应用DPPH法测定相同浓度下槲皮素-3-O-葡萄糖苷、芦丁以及槲皮素的抗氧化活性,结果显示上述物质对自由基的清除能力大致相同,但对DNA的切割活性则有所不同,对DNA切割活性能力强弱的顺序为槲皮素、芦丁、香豆酸、阿魏酸以及槲皮素-3-O-葡萄糖苷。而在促氧化活性研究中,促氧化活性最强的是槲皮素-3-O-葡萄糖苷,其次是对香豆酸、阿魏酸的促氧化活性最弱[33]。WEN等[34]用DPPH法测定了荔枝叶提取物的抗氧化活性,结果显示原花青素A2和表儿茶素对自由基的清除能力最强;在ORAC试验中,其抗氧化能力的强弱顺序为原花青素A2、槲皮素、表儿茶素、芦丁、山奈酚-3-O-β-葡萄糖苷、山奈酚-3-O-α-鼠李糖苷以及木樨草素。木樨草素对苏云金芽孢杆菌、志贺氏痢疾杆菌、金黄色葡萄球菌、大肠杆菌以及沙门氏菌的抗菌活性较强,而芦丁、原花青素A2和表儿茶素的抗菌活性较弱[34]。另一项研究发现,芦丁可抑制人白血病肿瘤的生长[35]。没食子酸、儿茶素、咖啡酸、表儿茶素、对香豆酸等对低密度脂蛋白胆固醇的氧化有很好的抑制作用[36-38],且混合酚类对低密度脂蛋白胆固醇氧化的抑制作用更强[39]。
4 结语
在9种大孔树脂中,HPD100对芍药花多酚的分离纯化效果较好。室温下,以50%乙醇为洗脱剂,吸附和洗脱流速为10mL/min,分离纯化芍药花多酚,纯化后的多酚含量为(721.72±4.25)GAE/g DW,是未纯化前的1.57倍。纯化后芍药花多酚的抗氧化能力是未纯化的1.35、1.44和1.62倍。纯化后芍药花中(+)-儿茶素、香草酸、表儿茶素、对香豆酸、阿魏酸、芦丁、异槲皮苷以及槲皮苷等的含量明显增高。
[1]LEE,SJ,LEE,H K,JUNGM K,et al.In vitro antiviral activity of 1,2,3,4,6-penta-O-galloyl-beta-D-glucose against hepatitis B virus[J].Biol Pharm Bull.,2006,29(10):2131-2134
[2]SHU X,DUANW,LIU F,et al.Preparative separation of polyphenols from the flowers of Paeonia lactiflora Pall.by high-speed counter-current chromatography[J].JChromatogr B Analyt Technol Biomed Life Sci,2014,947-948(2):62-67
[3]YANGHO,KOWK,KIM JY,etal.Paeoniflorin:an antihyperlipidemic agent from Paeonia lactiflora[J].Fitoterapia,2004,75(1):45-49
[4]CHOU TC.Anti-inflammatory and analgesic effects of paeonol in carrageenan-evoked thermalhyperalgesia[J].Br JPharmacol,2003, 139(6):1146-1152
[5]KHAN T,AHMADM,NISARM,etal.Enzyme inhibition and radical scavenging activities of aerial parts of Paeonia emodi Wall. (Paeoniaceae)[J].JEnzyme Inhib Med Chem,2005,20(3):245-249
[6]XIAO L,WANG Y Z,LIU J,et al.Effects of paeoniflorin on the cerebral infarction,behavioral and cognitive impairments at the chronic stageof transientmiddle cerebralartery occlusion in rats[J]. Life Sci,2005,78(4):413-420
[7]MIX J,CHEN SW,WANGWJ,et al.Anxiolytic-like effect of paeonol in mice[J].Pharmacol Biochem Behav,2005,81(3):683-687
[8]HSIEH C L,CHENG CY,TSAITH,etal.Paeonol reduced cerebral infarction involving the superoxide anion andmicroglia activation in ischemia-reperfusion injured rats[J].JEthnopharmacol, 2006,106(2):208-215
[9]王荣花,刘雅丽.牡丹和芍药花瓣中高级脂肪酸组分及含量的测定[J].中国农学通报,2004,20(6):212-214
[10]金英善,陈曼丽,金银哲,等.芍药花活性成分分析及体外清除自由基活性研究[J].扬州大学学报(农业与生命科学版),2012, 33(3):86-90
[11]王爱晶.芍药花红色素稳定性研究及应用[D].哈尔滨:东北林业大学,2010
[12]何玲,王荣,花罗佳,等.芍药花红色素提取工艺的研究[J].西北农林科技大学学报(自然科学版),2006,34(12):204-208
[13]胡喜兰,尹福军,程青芳,等.不同花期芍药花中活性成分的研究[J].食品科学,2008,29(9):511-514
[14]舒希凯.芍药花抗氧化活性成分的分离和鉴定[D].济南:山东师范大学,2013
[15]CHENG,CHEN S,XIE Y,etal.Total phenolic,flavonoid and antioxidantactivity of 23 edible flowers subjected to in vitro digestion [J].JFunctFoods,2015,17:243-259
[16]陈冠林,胡坤,邓晓婷,等.紫红肉火龙果果肉色素的纯化及稳定性研究[J].广东农业科学,2012,39(7):120-123
[17]陈冠林,胡坤,邓晓婷,等.红肉火龙果果皮色素的纯化及稳定性的研究[J].中国农学通报,2012,28(27):277-282
[18]CHEN Y,ZHANG W,ZHAO T,et al.Adsorption properties of macroporous adsorbent resins for separation of anthocyanins from mulberry[J].Food Chem,2016,194:712-722
[19]SINGLETON V L,ROSSIJA.Colorimetry of total phenolics with phosphomolybdic-phosphotungsticacid reagents[J].Am JEnolViticult,1965,16(3):144-158
[20]OZGENM,REESERN,TULIO A Z Jr,etal.Modified 2,2-azinobis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS)method to measureantioxidantcapacity ofselected small fruitsand comparison to ferric reducing antioxidantpower(FRAP)and 2,2’-diphenyl-1-picrylhydrazyl(DPPH)methods[J].JAgric Food Chem,2006,54(4):1151-1157
[21]BENZIE I F,STRAIN J J.The ferric reducing ability of plasma (FRAP)as ameasure of“antioxidant power”:The FRAP assay[J]. Anal Biochem,1996,239(1):70-76
[22]CAIY,SUN M,CORKE H.Antioxidant activity of betalains from plants of the amaranthaceae[J].JAgric Food Chem,2003,51(8):2288-2294
[23]CHANDRASEKHAR J,MADHUSUDHANM C,RAGHAVARAOK SM S.Extraction ofanthocyanins from red cabbageand purification usingadsorption[J].Food Bioprod Process,2012,90(4):615-623
[24]SCORDINOM,DIMAURO A,PASSERINIA,et al.Adsorption of flavonoidson resins:hesperidin[J].JAgric Food Chem,2003,51(24):6998-7004
[25]WUS,WANGY,GONGG,etal.Adsorption and desorption propertiesofmacroporous resins for flavonoids from the extractof Chinese wolfberry(Lycium barbarum L.)[J].Food Bioprod Process,2013,93:148-155
[26]BURANTJ,SANDHUA K,LIZ,etal.Adsorption/desorption characteristics and separation of anthocyanins and polyphenols from blueberries using macroporous adsorbent resins[J].J Food Eng, 2014,128(1):167-173
[27]ZHAO Z,DONG L,WU Y,etal.Preliminary separation and purificationof rutinand quercetin from Euonymusalatus(Thunb.)Siebold extracts bymacroporous resins[J].Food Bioprod Process,2011,89 (4):266-272
[28]FU Y,ZUY,LIUW,etal.Preparative separation ofvitexin and isovitexin from pigeonpeaextractswithmacroporous resins[J].JChromatogr A,2007,1139(2):206-213
[29]WANG C,SHIL,FAN L,et al.Optimization of extraction and enrichmentofphenolics from pomegranate(Punicagranatum L.)leaves [J].Ind Crop Prod,2013,42(1):587-594
[30]ZHANGB,YANGR,ZHAOY,etal.Separation of chlorogenic acid from honeysuckle crude extracts bymacroporous resins[J].JChromatogr BAnalyt Technol Biomed Life Sci,2008,867(2):253-258
[31]HE Z,XIAW.Preparative separation and purification of phenolic compounds from Canarium album L.bymacroporous resins[J].JSci Food Agric,2008,88(3):493-498
[32]XIL,MU T,SUN H.Preparative purification of polyphenols from sweet potato(Ipomoea batatas L.)leaves by AB-8 macroporous resins[J].Food Chem,2015,172:166-174
[33]YANGB,CHEN F,HUA Y,etal.Prooxidantactivitiesofquercetin, p-courmaric acid and their derivatives analysed by quantitative structure-activity relationship[J].Food Chem,2012,131(2):508-512
[34]WEN L,WUD,JIANG Y,etal.Identification of flavonoids in litchi (Litchi chinensis Sonn.)leaf and evaluation of anticancer activities [J].JFunct Foods,2014,6(1):555-563
[35]LIN JP,YANG JS,LIN JJ,et al.Rutin inhibits human leukemia tumor growth in amurine xenograftmodel in vivo[J].Environ Toxicol,2012,27(8):480-484
[36]MEYER A S,HEINONENM,FRANKELEN.Antioxidant interactionsof catechin,cyanidin,caffeic acid,quercetin,and ellagic acid on human LDLoxidation[J].Food Chem,1998,61(1/2):71-75
[37]DECAMARGOA C,REGITANO-D ARCEM A,BIASOTOA C,et al.LoWMolecularWeight Phenolicsof Grape Juice and Winemaking Byproducts:Antioxidant Activities and Inhibition of Oxidation of Human Low-Density Lipoprotein Cholesterol and DNA Strand Breakage[J].JAgric Food Chem,2014,62(50):12159-12171
[38]AYOUB M,DE CAMARGO A C,SHAHIDIF.Antioxidants and bioactivities of free,esterified and insoluble-bound phenolics from berry seedmeals[J].Food Chemistry,2016,197(PtA):221-232
[39]NARDINIM,D'AQUINOM,TOMASSIG,etal.Inhibition ofhuman low-density lipoprotein oxidation by caffeic acid and other hydroxycinnamicacid derivatives[J].FreeRadic BiolMed,1995,19(5):541-552
Study on Purification and Antioxidant Activity of Polyphenols from the Flower of Paeonia lactiflora Palla
YU Jing1,CHENGuan-lin2,YANGLu-qi1,WANGYu-kun1,GAOYong-qing1,FUNan-lin3,*
(1.Schoolof Food Science,Guangdong PharmaceuticalUniversity,Zhongshan 528458,Guangdong,China;2.Foshan InstituteofOccupationalDisease Prevention and Control,Foshan 528000,Guangdong,China;3.The FirstAffiliated HospitalofGuangdong PharmaceuticalUniversity,Guangzhou 510008,Guangdong,China)
Using themacroporousadsorptive resins,the purification conditions for totalphenolic content(TPC)from the flowerof Paeonia lactiflora Pallaand theantioxidantcapacity of the TPCwere studied afterpurification. Static and dynamic experimentalmethodswere performed to determine the purification conditions,and the contentsof thepurified TPCwere calculated.Among the9macroporous resins tested,HPD100 resinwas thebest in adsorption effectand desorption effect.At room temperature,when 50%ofethanolwasused as desorption solution,adsorption and desorption floWvelocitieswere both 10mL/min,the content of the TPC purified from the flower of Paeonia lactiflora Pallawas721.72mg GAE/g dryweight,and itwas 1.57 timeshigher compared with thatbefore purification.The antioxidantactivities of purified extractsmeasured by 2,2-diphenyl-1-picrylhydrazyl radicalscavenging activity assay(DPPH),ferric reducing antioxidantpower assay(FRAP),and ABTS+radicalscavengingactivity(ABTS)assaywere1.35,1.44,1.62 timeshigher than thoseofcrudeextractsbefore purification,respectively.
purification;antioxidant;polyphenol;Paeonia lactiflora Palla;macroporousresins
10.3969/j.issn.1005-6521.2017.07.009
2016-07-26
广东省医学科学技术研究基金项目(A2015617);中医药强省建设专项资金第二批名中医师承项目(粤中医办函[2015]93号)
俞憬(1992—),男(汉),在读硕士,研究方向:营养与健康。
*通信作者:傅南琳(1964—),女(汉),主任医师,研究方向:中药天然产物与健康关系的研究。

