阿尼芬净合成前体棘白菌素B发酵条件优化
牛 坤,吴 豪,毛 健,邹树平
(浙江工业大学 生物工程研究所,浙江 杭州 310014)
阿尼芬净合成前体棘白菌素B发酵条件优化
牛 坤,吴 豪,毛 健,邹树平
(浙江工业大学 生物工程研究所,浙江 杭州 310014)
阿尼芬净为新一代棘白菌素类抗生素,其前体物质棘白菌素B(ECB)发酵单位的高低将直接影响阿尼芬净的市场前景.利用构巢曲霉发酵合成ECB,采用单因素实验考察不同参数对ECB产量的影响.结果显示:低温培养有利于ECB的合成,选择前3天37 ℃培养,后9天25 ℃培养,ECB产量可达1 237 mg/L,比25 ℃恒温培养提高了69.9%;最佳的初始pH为6.5;添加0.6 g/L ZnCl2可使ECB产量达到1 100 mg/L,比初始发酵培养基提高了69.2%;前体物质脯氨酸及鸟氨酸的添加可以显著提高ECB产量,在第6天添加2 g/L脯氨酸或在第3天添加2 g/L鸟氨酸可使ECB产量分别提高57.4%和55.2%.
棘白菌素B;构巢曲霉;发酵;条件优化
棘白菌素类抗生素是20世纪70年代发现的一组天然产物,具有类似的环状多肽核心和不同的脂肪酸侧链,能够非竞争性地抑制真菌细胞壁β-1,3-葡聚糖合成酶的活性,从而达到抗真菌的目的[1].FDA已批准上市的这类药物包括卡泊芬净(Caspofungin)、米卡芬净(Micafungin)和阿尼芬净(Anidulafungin),其中前两者已在国内上市,阿尼芬净已在国内临床中[2-3].阿尼芬净是由前体化合物棘白菌素B(ECB)经犹他游动放线菌产生的酰化酶作用脱去侧链亚油酰基,然后在DMF中与活性中间体4″-戊氧基-[1,1′,4′,1″]三苯基-4-甲酸-2,4,5-三氯-苯基酯反应制得.ECB与阿尼芬净的化学结构式[4]分别为ECB是合成阿尼芬净的主要前体化合物,其发酵单位的高低将直接影响阿尼芬净的市场前景.根据文献和专利报道,目前国内外ECB均是利用微生物发酵制备,其中主要是以构巢曲霉(Aspergillusnidulans)进行发酵[5-6].Papagianni等[7]综述了发酵过程中接种量、碳氮源种类及浓度、pH、温度和搅拌速率等因素对构巢曲霉生长的影响,当温度从23 ℃提高至37 ℃后,构巢曲霉的比生长速率从1.54 h-1增加至3.24 h-1,菌体生长加快,可见提高温度有利于构巢曲霉的生长.Benz等[8]通过红外、核磁共振等方法确定了ECB的分子结构,且发现其水解成分中包括了亚油酸、4-羟基-L-脯氨酸、4-羰基-L-脯氨酸、L-苏氨酸、(2S,3S,4S)-4-甲基-3-羟脯氨酸等,并且发酵培养基中添加碳酸盐、磷酸盐、硫酸盐及硝酸盐等组分对ECB产量的提高均有促进作用.目前,关于ECB发酵的文献报道较少,国内尚无企业生产阿尼芬净,导致其市场垄断、价格高.因此,现阶段对阿尼芬净的高效生产技术进行研发,实现其国产化,将有助于打破国际制药企业的垄断,为患者提供价廉质优的抗真菌药物,具有重要的经济和社会效益.笔者采用单因素实验,初步考察了发酵温度、初始pH、金属离子和前体等对ECB发酵过程的影响,以确定最优发酵条件,为阿尼芬净的工业化生产奠定坚实的数据基础.
1 材料与方法
1.1 菌 种
构巢曲霉AspergillusnidulansZJB09223,由本实验保藏.
1.2 培养基
斜面培养基:PDA培养基.
种子培养基(g/L):葡萄糖10,甘油10,棉籽粉25,pH 6.8~7.0,121 ℃灭菌20 min.
初始发酵培养基(g/L):花生油20,甘油10,蛋白胨10,L-脯氨酸1,甘露醇90,豆粉40,K2HPO4·3H2O 8,MgSO4·7H2O 0.5,MnSO4·H2O 0.1,FeSO4·7H2O 0.05,CaCl20.3,pH 7.0,121 ℃灭菌20 min.
1.3 主要仪器与设备
恒温调速摇床(上海杜科自动化设备有限公司DKY-1);高效液相色谱(日本SHIMADZU);高压蒸汽灭菌锅(日本SANYO,MLS-3780);电子分析天平(上海精密仪器仪表有限公司FA2004);高速冷冻离心机(美国Bechman Coulter,X-22).
1.4 培养方法
1.4.1 斜面培养
将传好种的斜面置于25 ℃培养箱中培养8~16 d,菌落表面呈现墨绿色后取出置于15~20 ℃室温,继续培养,一般5~20 d都可接种用于种子培养.
1.4.2 种子液培养
接种后的种子培养基在220 r/min,25 ℃条件下培养2 d.
1.4.3 摇瓶发酵培养
发酵温度、初始pH、金属离子及前体物质添加等实验均在摇瓶中进行.按照10%接种量进行接种,接种后在220 r/min,25 ℃条件下培养12 d,第6天起定时取样测定ECB产量.每个条件做3个平行样,最终结果取平均值.
1.5 分析方法
发酵液预处理:取1 mL发酵液12 000 r/min离心8 min,弃上清.所得菌体加入1 mL甲醇,25 ℃振荡萃取30 min,12 000 r/min离心8 min,留上清液备用.残留菌体中再加入1 mL甲醇重复萃取,25 ℃振荡摇匀30 min,12 000 r/min离心8 min,所得上清液与前一步上清液合并,12 000 r/min离心2 min,上清液用0.45 μm水膜过滤,进行检测.
高效液相色谱(HPLC)检测:产物ECB采用HPLC进行检测,色谱柱为ODS-C18柱(大连依利特,4.6 mm×250 mm,5 μm),流动相为V(乙腈)∶V(甲醇)∶V(水)=2∶7∶1,流速为1.0 mL/min,紫外检测波长为222 nm,进样量20 μm,柱温40 ℃.
2 结果与分析
2.1 发酵温度对ECB产量的影响
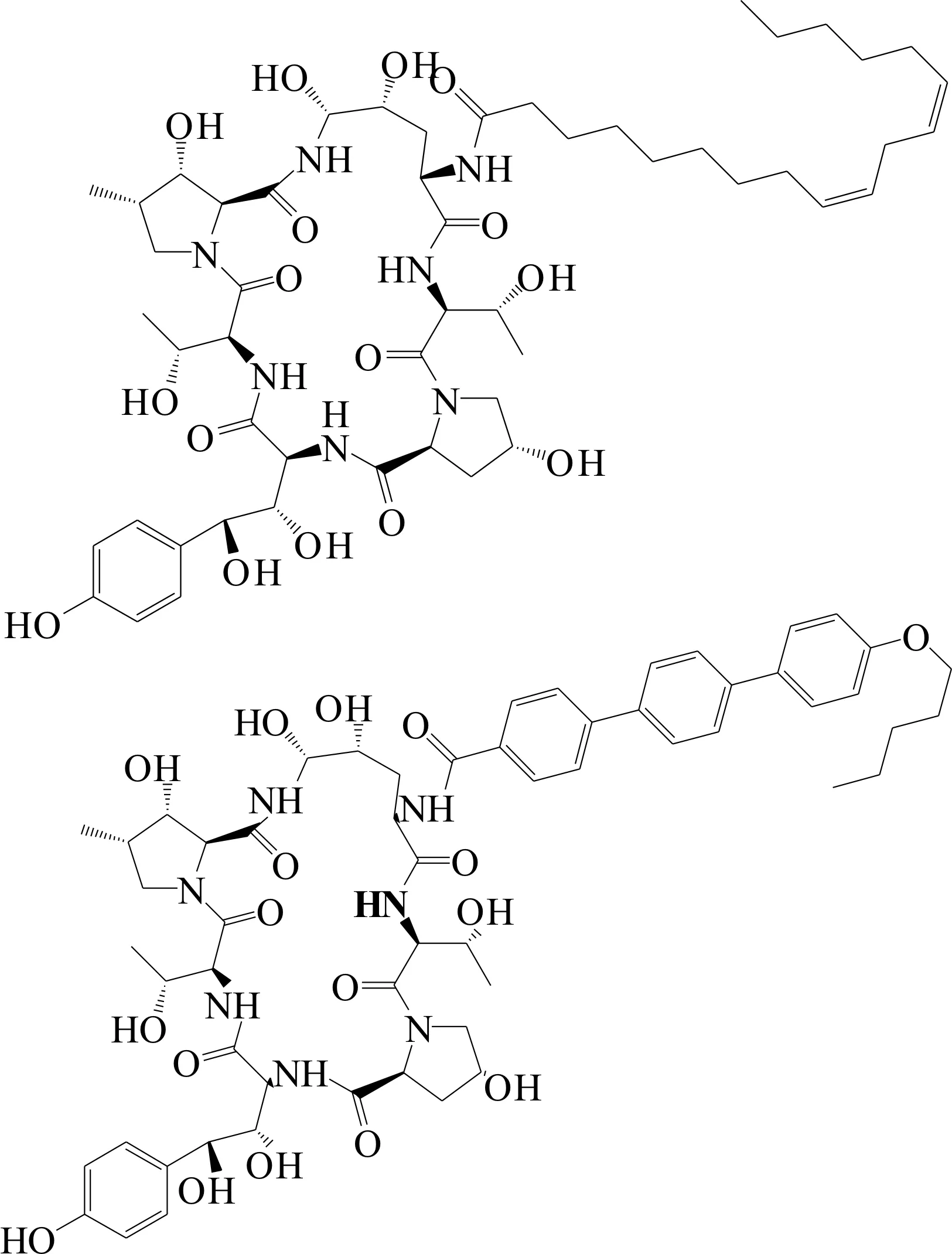
发酵温度是影响菌体生长和代谢的关键因素,本实验着重考察了温度对产物ECB的影响.图1结果表明:发酵温度由25 ℃提高至37 ℃的过程中,ECB的质量浓度随温度的升高呈现降低的趋势;最佳发酵温度为25 ℃,此时ECB最高质量浓度为728 mg/L;而当温度提高至37 ℃后,基本无ECB产生,由此可知低温有利于ECB的合成.
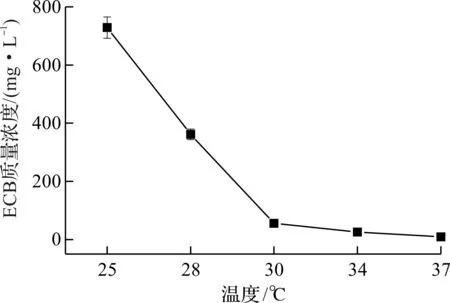
图1 发酵温度对ECB产量的影响Fig.1 Effect of temperature on the production of ECB
实验过程中发现温度过低不利于菌体生长,因此本实验考虑在培养过程中进行温度的调节,以得到最佳的温度控制方式.实验开始(第0天)在25,28,37 ℃条件下进行发酵培养,然后分别在第3天、第6天和第9天进行温度调节,具体调节方式为:由28 ℃和37 ℃调节至25 ℃,培养至发酵结束;由25 ℃调节至28 ℃,培养至发酵结束.分别测定ECB质量浓度,结果如表1所示.从表1可以看出:前3天采用较高温度(28~37 ℃)培养,后续采用低温(25 ℃)培养,ECB质量浓度有较大的提高;前3天采用37 ℃培养,之后降低温度至25 ℃培养,ECB发酵质量浓度由728 mg/L提高至1 237 mg/L,比25 ℃恒温培养提高了69.9%.这可能是由于ECB的发酵过程为生长非偶联型,在发酵前3天采用37 ℃培养可以使菌体大量快速生长,而3天后ECB开始合成,此时降低温度则有利于ECB的产生.研究也表明构巢曲霉比生长速率会随温度的升高而升高,但是温度升高后菌体出现失水加剧的现象,最终会导致目标化合物的合成量降低,这与本实验的结果一致,而实验结果表明通过这种温度调节方式可以使ECB的质量浓度显著增加[7].
表1 不同温度调节方式及调节时间对ECB产量的影响
Table 1 Effect of temperature regulation on the production of ECB

温度调节方式ECB质量浓度/(mg·L-1)第3天调节第6天调节第9天调节28℃调至25℃1221±29644±17353±1037℃调至25℃1237±76622±14280±1525℃调至28℃664±19768±121062±68
2.2 初始pH值对ECB产量的影响
pH值也是影响微生物生长和代谢的重要因素.由文献可知:中性pH值有利于构巢曲霉菌体生长和孢子生成,而当pH小于3时则不利于菌体生长,不同初始pH值对产物的合成也具有重要影响[7].本实验着重考察了初始pH值对ECB产量的影响.由图2可知:在初始pH值4.5~9.5范围内,ECB的质量浓度呈现先上升后下降的趋势,最佳的初始pH值为6.5,此时,ECB的发酵产量为1 116 mg/L;而当pH小于6或者大于7时,ECB质量浓度会降低至500 mg/L以下.因此过酸或过碱性的环境均不适合ECB的合成.

图2 初始pH值对ECB产量的影响Fig.2 Effect of initial pH on the production of ECB
2.3 金属离子对ECB产量的影响
文献报道,金属离子对卡泊芬净合成前体Pneumocandin B0的发酵具有重要影响,因此本实验考察了金属离子对ECB产量的影响[9].图3为最佳金属离子浓度下ECB的发酵情况,从结果可以看出:金属离子对ECB发酵产量也有重要影响,在初始发酵培养基中,ECB质量浓度约为640 mg/L,Cu2+和Zn2+的添加可以使ECB的质量浓度提高,当添加0.6 g/L ZnCl2时,ECB质量浓度可以达到1 100 mg/L,比初始培养基的结果提高了69.2%,而Co2+对ECB质量浓度的影响不大.
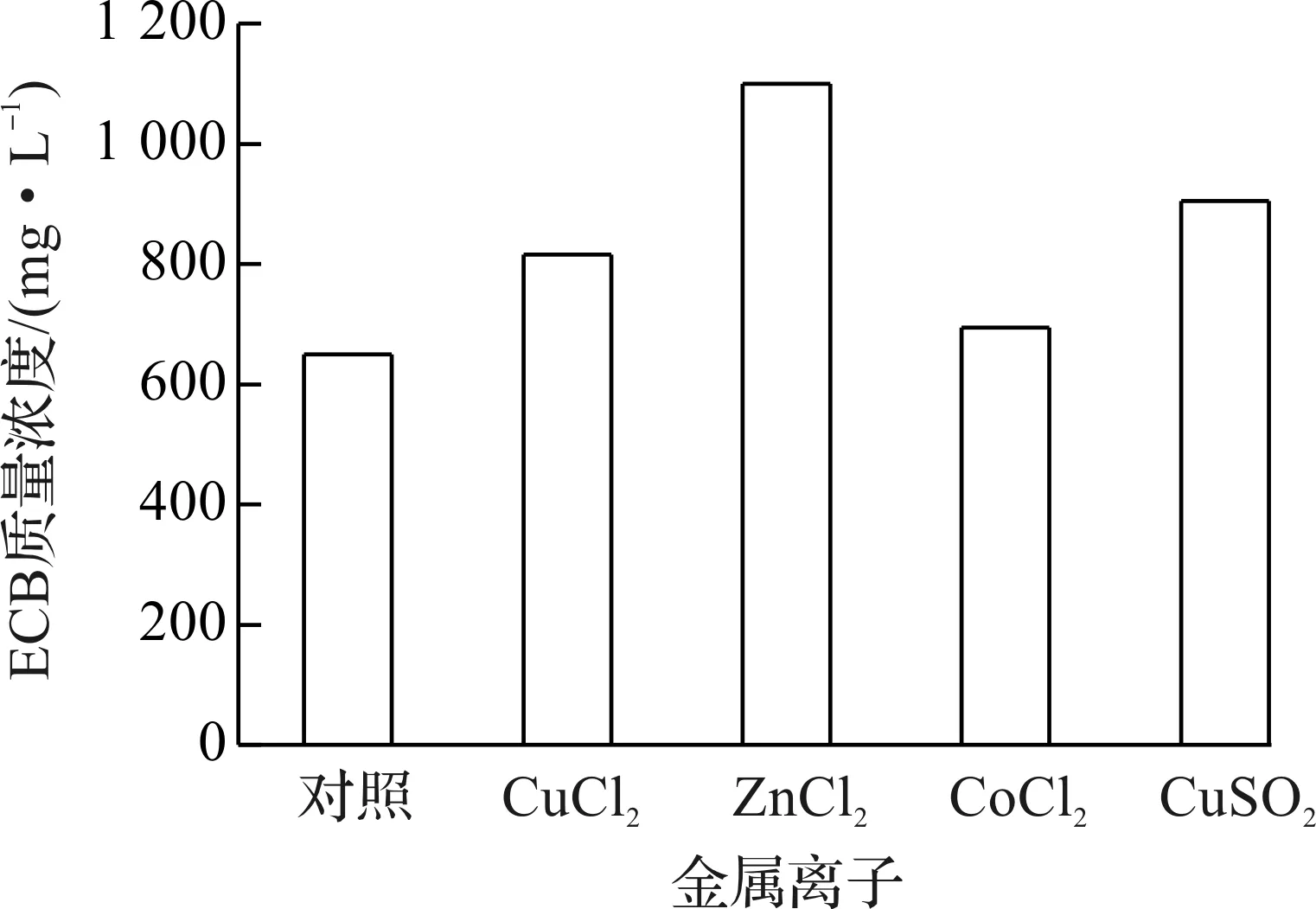
图3 金属离子对ECB产量的影响Fig.3 Effect of metal ion on the production of ECB
2.4 前体浓度及添加时间对ECB产量的影响
2.4.1 脯氨酸对ECB产量的影响
相关文献中报道脯氨酸对真菌类微生物的生长与代谢有着重要的作用[10-11].实验考查了不同脯氨酸质量浓度及添加时间对ECB发酵结果的影响.以初始发酵培养基为对照,在不同时间向发酵液中添加脯氨酸,使其最终质量浓度分别为2,5,8 g/L,结果如表2所示.
表2 脯氨酸浓度和添加时间对ECB产量的影响
Table 2 Effect of concentration and addition time of proline on the production of ECB
添加时间ECB质量浓度/(mg·L-1)对照2g/L脯氨酸5g/L脯氨酸8g/L脯氨酸第0天540±18776±4679±24607±7第3天540±18687±27653±37573±19第6天540±18886±18796±27694±49第9天540±18840±37797±12708±7
由表2可知:第0天添加1 g/L脯氨酸的对照组,ECB质量浓度为540 mg/L左右,而在不同添加时间下,2 g/L的脯氨酸添加量均表现出较好的效果;在第0天添加2 g/L脯氨酸,ECB质量浓度最终达到780 mg/L左右,并且随着脯氨酸质量浓度的上升而下降;在第3天添加2 g/L脯氨酸,ECB质量浓度最终达到700 mg/L左右;第6天添加2 g/L脯氨酸,ECB质量浓度达到886 mg/L左右;第9天添加2 g/L脯氨酸,ECB质量浓度则为840 mg/L左右.由上述结果可知:在第6天添加2 g/L的脯氨酸效果最佳,ECB质量浓度比初始培养基提高57.4%.
2.4.2 苏氨酸对ECB产量的影响
除脯氨酸之外,本实验还考查了不同苏氨酸质量浓度及添加时间对ECB发酵结果的影响.以初始发酵培养基为对照,在不同时间向发酵液中添加苏氨酸,使其最终质量浓度分别为2,5,8 g/L,结果如表3所示.由表3可知:苏氨酸对ECB产量的影响较小,而且苏氨酸质量浓度过高(8 g/L)会抑制ECB的合成,不同时间添加苏氨酸均使ECB的质量浓度降低,因此选择苏氨酸的最终添加质量浓度2 g/L;由添加时间看出,选择在第0天(发酵初始)添加苏氨酸,可使ECB质量浓度由524 mg/L提高至639 mg/L左右,产量提高了21.9%.
表3 苏氨酸浓度和添加时间对ECB产量的影响
Table 3 Effect of concentration and addition time of threonine on the production of ECB
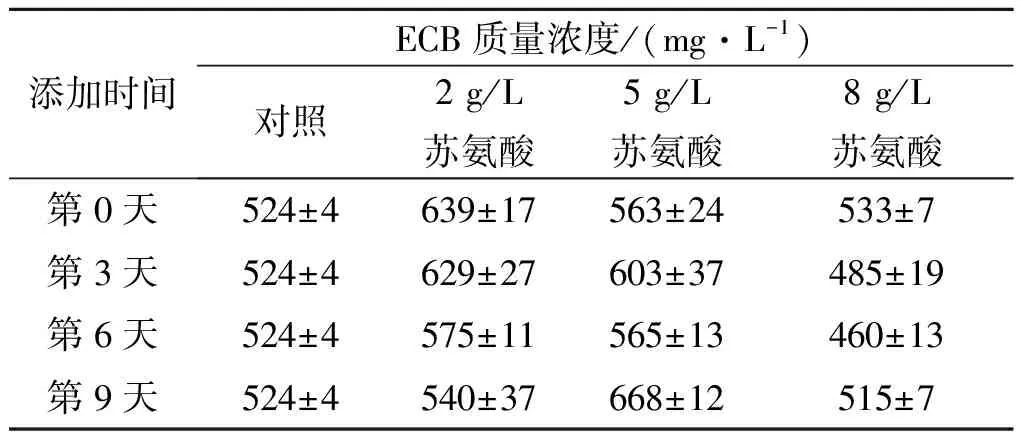
添加时间ECB质量浓度/(mg·L-1)对照2g/L苏氨酸5g/L苏氨酸8g/L苏氨酸第0天524±4639±17563±24533±7第3天524±4629±27603±37485±19第6天524±4575±11565±13460±13第9天524±4540±37668±12515±7
2.4.3 鸟氨酸对ECB产量的影响
本实验还考查了不同鸟氨酸质量浓度及添加时间对ECB发酵结果的影响.以初始添加2 g/L脯氨酸的发酵培养基为对照,在不同时间向发酵液中添加鸟氨酸,使其最终质量浓度分别为2,5,8 g/L,结果如表4所示.表4表明:在第3天添加2 g/L鸟氨酸时,ECB质量浓度会有大幅度提高,最终质量浓度达到1 204 mg/L左右,比对照组提高了55.2%;在发酵第6天添加鸟氨酸时,ECB质量浓度会随鸟氨酸质量浓度的增加而增加,添加8 g/L鸟氨酸可以使ECB质量浓度提高至1 173 mg/L左右,而在第9天添加鸟氨酸则对ECB的质量浓度影响不大.因此,分析实验结果本实验选择在发酵第3天添加2 g/L鸟氨酸.
表4 鸟氨酸浓度和添加时间对ECB产量的影响
Table 4 Effect of concentration and addition time of ornithine on the production of ECB
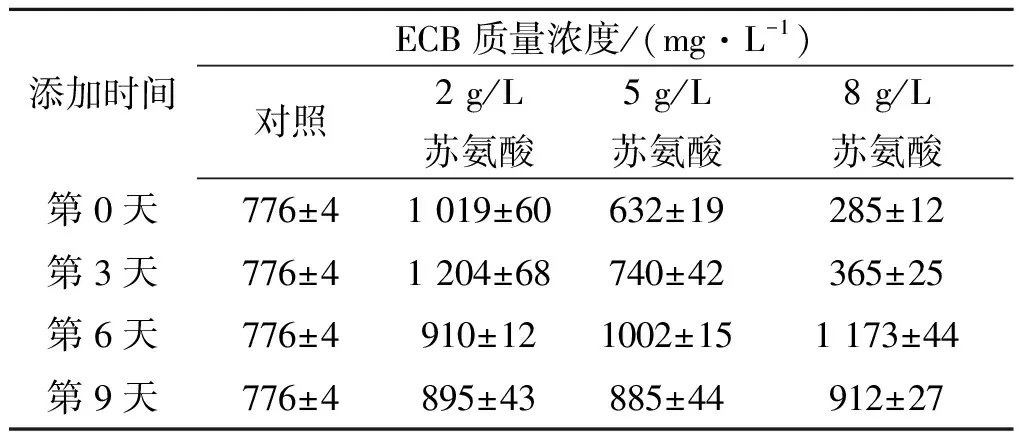
添加时间ECB质量浓度/(mg·L-1)对照2g/L苏氨酸5g/L苏氨酸8g/L苏氨酸第0天776±41019±60632±19285±12第3天776±41204±68740±42365±25第6天776±4910±121002±151173±44第9天776±4895±43885±44912±27
3 结 论
采用单因素实验对抗真菌药物阿尼芬净的前体物质ECB的发酵条件进行了优化,得到结果如下:高温有利于菌体生长,低温培养有利于ECB的合成,选择在前3天37 ℃培养,后9天25 ℃培养,可以使ECB的最终质量浓度达到1 237 mg/L,比25 ℃恒温培养提高了69.9%;最佳初始pH为6.5,pH小于6或大于7均不利于ECB的合成;金属离子Cu2+和Zn2+有利于ECB的合成,而Co2+对ECB合成的促进作用不大,添加0.6 g/L ZnCl2可以使ECB的质量浓度提高69.2%;最佳前体物质为脯氨酸与鸟氨酸,选择在发酵第6天和第3天添加2 g/L脯氨酸和鸟氨酸,ECB发酵产量分别达到850,1 204 mg/L.在上述最优发酵条件,ECB发酵单位可以达到1 200 mg/L以上.通过对ECB发酵过程中基本培养条件的优化,提高了ECB的发酵产量,为阿尼芬净的工业化提供了一定的实验基础,当然笔者所涉及的只是初步工作,今后还有许多工作需要进行,例如发酵罐实验的优化与放大,而本实验也为今后工作的展开提供参考.
[1] 曹国颖,傅得兴.新型棘白菌素类抗真菌药阿尼芬净[J].中国新药杂志,2005,14(11):1358-1361.
[2] 李岷,沈永年,吕桂霞,等.棘白菌素类抗真菌药[J].中国真菌学杂志,2009,4(4):249-256.
[3] BERGOGNE-BÉRÉZIN E. Anidulafungin, a new antifungal drug[J].Antibiotiques,2007,9(3):212-215.
[4] 王海燕,李晓露,蒋沁,等.Echinocandin B的分离纯化工艺研究[J].中国抗生素杂志,2012,37(3):216-219.
[5] COCKSHOTT A R, SULLIVAN G R. Improving the fermentation medium for Echinocandin B production. Part I: sequential statistical experimental design[J].Process biochemistry,2001,36(7):647-660.
[6] COCKSHOTT A R, HARTMAN B E. Improving the fermentation medium for Echinocandin B production. Part II: Particle swarm optimization[J].Process biochemistry,2001,36(7):661-669.
[7] PAPAGIANNI M. Fungal morphology and metabolite production in submerged mycelial processes[J].Biotechnology advances,2012,22(3):189-259.
[8] BENZ F, KNÜSEL F, NÜESCH J, et al. Metabolic products of microorganism 143. Echinocandin B, a new polypeptide antibiotic fromAspergillusnidulansvarechinulatus: isolation and building units[J].Helvetica chimica acta,1974,57(8):2459-2477.
[9] TKACZ J S, GIACOBBE R A, MONAGHAN R L. Improvement in the titer of echinocandin-type antibiotics: a magnesium-limited medium supporting the biphasic production of pneumocandins A0and B0[J].Journal of industrial microbiology,1993,11(2):95-103.
[10] PETERSEN L A, HUGHES D L, HUGHES R, et al. Effects of amino acid and trace element supplementation on pneumocandin production byGlarealozoyensis: impact on titer, analogue levels, and the identification of new analogues of pneumocandin B0[J].Journal of industrial microbiology and biotechnology,2001,26(4):216-221.
[11] 刘靓,娄忻,张莉,等.卡泊芬净合成前体Pneumocandin B0的发酵工艺研究[J].化学与生物工程,2011,28(9):80-82.
(责任编辑:朱小惠)
Optimization of fermentation conditions for Echinocandin B
NIU Kun, WU Hao, MAO Jian, ZOU Shuping
(Institute of Bioengineering, Zhejiang University of Technology, Hangzhou 310014, China)
Anidulafungin is a new echinocandin antifungal agent, and its market prospect is greatly impacted by the fermentation yield of its precursor Echinocandin B (ECB). ECB was produced byAspergillusnidulans, and the effect of fermentation conditions on ECB production was investigated by single factor experiment in this paper. The results indicated that lower temperature was in favor of ECB production, and whenA.nidulanswas cultured at 37 °C for the first three days and 25 °C for the following nine days, yield of ECB reached 1 237 mg/L, which was 69.9% higher than that cultured at 25 °C. The optimal initial pH was 6.5. And the yield of ECB reached 1 100 mg/L by adding 0.6 g/L ZnCl2, which was 69.2% higher than control. The yield of ECB was enhanced remarkably by addition of proline and ornithine, and it could be improved by 57.4% and 55.2% through the addition of 2 g/L proline at the 6thdays or 2 g/L ornithine at the 3rddays.
Echinocandin B;Aspergillusnidulans; fermentation; optimization of culture conditions
2016-03-29
国家科技重大专项项目(2012YQ15008713)
牛 坤(1982—),女,山东新泰人,副教授,博士,研究方向为微生物发酵代谢调控,E-mail:niukun@zjut.edu.cn.
Q92
A
1674-2214(2017)01-0011-05

