精确病理诊断在甲状腺癌精准医疗中的意义
陈健 综述 江亮 审校
·综 述·
精确病理诊断在甲状腺癌精准医疗中的意义
陈健 综述 江亮 审校
甲状腺癌是近年来发病率上升最快的实体恶性肿瘤,其中绝大多数为滤泡细胞来源,以分化型甲状腺癌为主,包括甲状腺乳头状癌(papillary thyroid cancer,PTC)和滤泡癌(follicular thyroid cancer,FTC)。为实现甲状腺癌的精准预防、诊断和治疗,需要以精确病理诊断作为基础。本文分别从评估并降低甲状腺癌发生风险、术前精确诊断、预后和复发风险分层,以及指导晚期患者分子靶向治疗等方面来阐述精确病理诊断在甲状腺癌精准医疗中的意义。
精确病理诊断 甲状腺癌 精准医疗
甲状腺癌是内分泌系统最常见的恶性肿瘤,由于精确诊断技术的普及和环境风险因素的流行,近年来全球甲状腺癌发病率呈急剧上升趋势[1];有资料显示,我国2003年至2011年期间发病年均增长率高达20.1%[2]。精准医学的内涵是通过认识患者的个体特点,量体裁衣的制定个体化诊治方案[3];对肿瘤而言,实现精准医疗的前提是精确的病理诊断,随着新的分子检测技术包括组学技术和大数据分析技术在病理实践中的推广应用,病理学已从形态学诊断时代进展到形态学诊断和分子病理诊断有机融合的时代[4]。本文旨在分析精确病理诊断在甲状腺癌预防、诊断和治疗中的潜在价值,分别从评估并降低甲状腺癌发生风险、术前精确诊断、预后和复发风险分层和指导晚期患者分子靶向治疗4个方面予以综述。
1 甲状腺癌形态学和分子病理基础
1.1 甲状腺癌形态学基础
从组织起源上分析,超过95%的甲状腺恶性肿瘤来源于滤泡上皮细胞[5],其中乳头状癌(papillary thyroid cancer,PTC)占据绝大多数,与滤泡癌(follicular thyroid cancer,FTC)一起称之为分化型甲状腺癌(differentiated thyroid cancer,DTC);其他少见类型包含低分化癌(poorly differentiated thyroid cancer,PDTC)、未分化癌(anaplastic thyroid cancer,ATC)和滤泡旁C细胞来源的髓样癌(medullary thyroid cancer,MTC)等(表1)。
1.2 甲状腺癌分子病理基础
与其他肿瘤一样,甲状腺癌的发生、发展与基因突变和基因表达调控异常相关,常见的基因突变事件包括BRAF、端粒酶逆转录酶(telomerase reverse transcriptase,TERT)启动子、RAS等基因点突变和RET-PTC、PAX8/PPARγ等基因重排等[5-6](表1)。上述基因突变、基因表达及调控异常是甲状腺癌分子病理诊断和靶向治疗的分子基础,部分分子指标还有预测发病风险及预后的价值。
2 甲状腺癌发病风险评估及对策
通过检测易感基因来预测肿瘤发病风险是近几年的研究热点。RET基因突变与家族性MTC(famil⁃ial MTC,FMTC)之间关系密切,根据其突变位点的不同,美国甲状腺学会(American Thyroid Association,ATA)2015版指南,将MTC发生风险重新分类,并分别给出处置建议(表2)[7]。
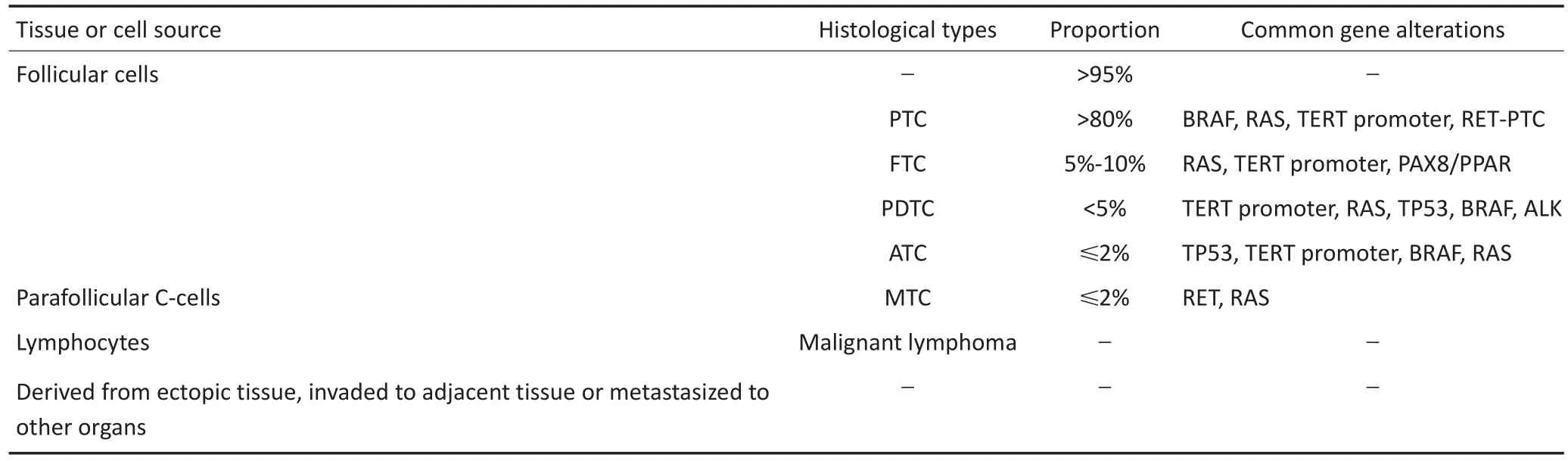
表1 甲状腺恶性肿瘤的组织来源、病理类型、占比及常见的基因突变情况[5-6]Table 1 Origin,histological types,respective proportion and common gene alterations of thyroid malignancy[5-6]

表2 FMTC患儿风险分层及处理建议[7]Table 2 Risk categories and recommendations for the management of children with FNMC according to the 2015 ATA guidelines[7]
家族性非MTC(familial non-MTC,FNMTC)具有家族聚集倾向,在非MTC(non-MTC,NMTC)中占3%~10%,当前研究并未发现FNMTC与散发NMTC之间存在显著的基因突变或基因表达差异[8]。近年来,逐渐认识到一些特定的遗传综合征,如Cowden综合征和家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)患者,罹患甲状腺癌的风险增加,且可能与特定的基因表达相关(表3)[8]。
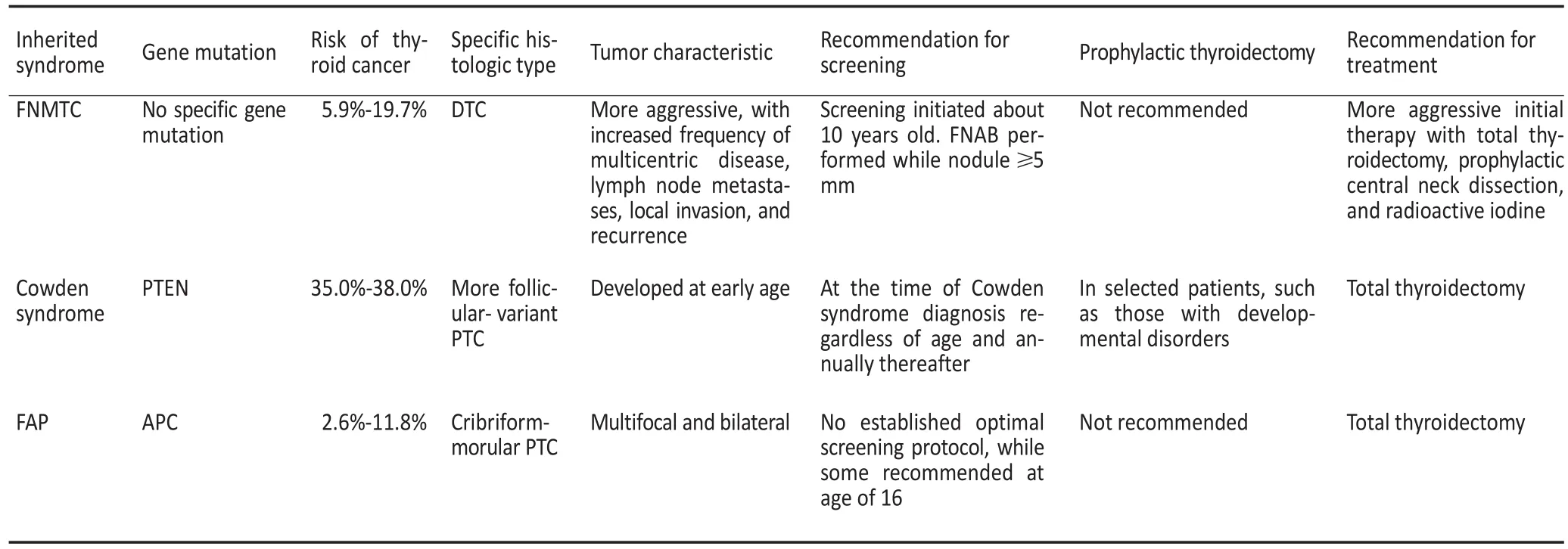
表3 遗传综合征和非髓样甲状腺癌[8]Table 3 Inherited cancer syndromes and nonmedullary thyroid cancer[8]
3 甲状腺癌术前精确病理诊断
临床上仅约5%~15%的甲状腺结节被最终诊断为恶性[9]。一般情况下,良性的甲状腺结节不建议行手术治疗[9-10]。国内某大型三甲医院的回顾性研究表明[11],术后确诊为恶性肿瘤患者仅占34.33%,提示可能约一半以上的患者行不必要的手术治疗。因此,判定良恶性是甲状腺结节评估的重点。
彩超等检查虽有助于鉴别良恶性,但细针穿刺抽吸活检(fine needle aspiration biopsy,FNAB)是当前敏感性和特异性最高的方法,超声引导下FNAB可进一步提高活检成功率和诊断准确率[9-10]。目前,推荐采用Bethesda甲状腺细胞学报告系统(the Bethesda system for reporting thyroid cytopathology,TBSRTC)以指导临床诊治[12]。FNAB得出诊断不明确结果(TB⁃SRTCⅠ、Ⅲ、Ⅳ、Ⅴ类)的比例较高[10,12],有学者认为,粗针穿刺活检(core-needle biopsy,CNB)可较大程度降低诊断不明的比例和非必要手术率[13];但与FNAB相比,CNB需实施麻醉、创伤较大、患者耐受性差、操作复杂,且对结节有一定要求等,临床常规实施存在困难。
对诊断不明确的FNAB样本行分子标记物检测可以提高确诊率,从而避免不必要的手术或手术并发症给患者带来永久性的损害[9-10]。部分指标如BRAF、TERT启动子突变等具有很高的诊断特异性[10]。最常见的BRAF点突变为15号外显子T1799A碱基颠换导致V600E错义突变(BRAF V600E),仅见于PTC或由PTC间变的ATC,诊断特异性高达100%[14]。2013年Liu等[15]首次发现甲状腺癌中TERT启动子区域C228T和C250T突变,其特异性存在于滤泡来源的甲状腺癌中,尤其是高侵袭亚型PTC、PDTC和ATC中;一项Meta分析也证实上述结果[16]。
单一分子指标诊断甲状腺癌的特异性虽高,但敏感性低。因此,需要联合检测多个指标。目前,关注度较高为:1)基因表达分类法(gene expression clas⁃sifier,GEC)检测;2)多基因突变分析检测。Veracyte公司推出的Afirma GEC可同时检测167个基因表达情况,一项前瞻性多中心研究结果表明[17],Afirma GEC检测具有较高的敏感性及阴性预测值。换言之,该诊断结果为良性时基本上可排除甲状腺癌诊断;但该检测的特异性和阳性预测值低,仍有大量被诊断为可疑恶性的患者行不必要的手术。Nikiforov团队设计出含7个常见突变基因的panel,检测敏感性可达61%[18]。随着对甲状腺癌基因突变认识的深入和第二代测序技术的发展,该团队又设计出可同时检测12个基因突变的ThyroSeq v1,验证结果表明,其可进一步提高检测的敏感性[19]。随后改进设计出ThyroSeq v2[20]和ThyroSeq v2.1等产品[21],检测敏感性和特异性均超过90%;其特异性和阳性预测值虽有轻度降低,但可结合特定基因突变(如BRAF、TERT启动子等)分析提高诊断准确性;此外,还可结合细胞来源相关基因表达情况与甲状旁腺等疾病鉴别。目前,国内尚无商品化的产品上市,而上述进口产品价格昂贵,仍存在误诊风险,其性价比有待商榷。
4 精确的术后病理诊断是进行DTC预后和复发风险分层的基础
DTC是一类总体预后良好的疾病,但仍有部分患者预后欠佳[5,9-10]。目前有研究提示,准确的风险分层有助于指导选择合理的治疗随访方案和评估预后[9-10]。常用的风险分层系统包括TNM分期系统和ATA复发风险分层。
准确分层需要以精确的病理诊断为基础,2015版ATA指南对甲状腺癌术后病理报告提出明确具体的要求[10]:除TNM分期所需的肿瘤大小、包膜外侵犯和淋巴结转移等基本信息外,还需要提供有助于复发风险分层的额外信息。这些额外信息包括[10]:有无血管侵犯及受侵血管的数量、检测淋巴结及阳性淋巴结数目、淋巴结最大转移灶的大小及结外受侵情况、病理亚型及与家族性综合征相关的特殊类型等。其中,无侵袭性的包裹性滤泡型PTC亚型复发和转移风险极低,多名病理学专家达成共识,将其重新定义为具有乳头状细胞核特征的非侵袭性滤泡型甲状腺肿瘤[22-23]。
有研究表明,BRAF突变与PTC患者的甲状腺包膜外侵犯、淋巴结转移、远处转移、高TNM分期、复发及复发后对放射性碘亲和力缺失等呈正相关;还发现BRAF突变的PTC患者死亡风险增加[14]。TERT启动子突变与高侵袭的病理亚型和BRAF突变呈正相关[15];进一步研究发现,该突变与患者年龄、性别、肿瘤大小、远处转移、肿瘤分期以及复发死亡具有相关性,其中TERT启动子和BRAF双重突变的PTC患者复发和死亡风险更高[16]。因此,基因突变检测虽未常规推荐用于初始复发和死亡风险评估[10],但随着甲状腺癌基因组学研究的发展[24],甲状腺癌分子分型已初具雏形,可与现有风险分层系统有机结合,以更加准确的评估复发和死亡风险,进而优化患者的诊治随访方案。
5 晚期甲状腺癌患者的分子靶向治疗
对于传统手术、放射性碘、甲状腺素抑制治疗及外照射治疗无效,且处于进展期的甲状腺癌患者,行分子靶向治疗已成新的选择[5-7,9-10]。当前,甲状腺癌尤其是DTC的靶向药物,包括针对血管内皮生长因子受体在内的多靶点激酶抑制剂(multi-targeted ki⁃nase inhibitors,MKI)和针对BRAF的特异性抑制剂等[5-6,10]。
治疗甲状腺癌的MKI代表药物包括索拉菲尼和乐伐替尼等[6]。应用乐伐替尼的Ⅲ期Select试验结果显示[25],乐伐替尼组中位无进展生存期(median pro⁃gression free survival,mPFS)达到18.3个月,显著优于安慰剂组的3.6个月,所有亚组分析也显示出生存获益;而且,乐伐替尼组肿瘤缓解率高达64.8%,远高于安慰剂组的1.5%,其中完全缓解率(complete re⁃sponse,CS)为1.5%。应用索拉非尼的Ⅲ期Decision试验结果表明[26],索拉非尼组mPFS为10.8个月,显著优于安慰剂组的5.8个月。
维罗非尼是一种BRAF V600E的特异性抑制剂[27],应用维罗非尼治疗BRAF V600E突变阳性PTC患者的Ⅱ期试验研究结果显示[27],与既往接受过MKI药物治疗的患者相比,未接受过MKI治疗的患者具有较高的疾病缓解率(response rate,RR)、疾病控制率(disease control rate,DCR)及更长的无进展生存期(progression free survival,PFS)。此外,由于BRAF突变与复发PTC患者的放射性碘亲和力存在相关性[14],理论上BRAF抑制剂还可促进放射性碘摄取,从而逆转放射性碘治疗的效果。
靶向免疫检查点的肿瘤免疫治疗是当今研究的热点之一,其中T细胞表面的程序性死亡蛋白-1(pro⁃grammed death-1,PD-1)受体与肿瘤组织高表达的PD-1配体-1/2(PD-1 ligand-1/2,PD-L1/2)结合,抑制T细胞活化和增殖,使肿瘤细胞逃避免疫系统的杀伤[28]。有研究发现,甲状腺癌细胞及浸润细胞中高表达PD-1和PD-L1,其中PD-L1在pN1、PDTC和ATC中表达水平更高[29];Chowdhury等[30]研究发现高表达PD-L1的PTC患者复发和死亡风险更高。靶向PD-1的派姆单抗通过与PD-1受体结合而阻断PD-1与PD-L1/2之间的相互作用,在多种肿瘤治疗中显示出较好的疗效和安全性[28]。应用派姆单抗治疗PDL1表达阳性的晚期PTC、FTC患者的Ⅰ期研究结果显示,该药物治疗耐受性好,客观缓解率(objective re⁃sponse rate,ORR)为9.1%(2/22),另有54.5%的患者得到有效控制,6个月时PFS率为58.7%,表现出较好的治疗前景[31]。Brauner等[32]研究发现PTC患者及细胞株中PD-L1表达与BRAF突变之间存在相关性,在小鼠ATC模型中,联合应用靶向PD-L1单抗与BRAF抑制剂较单药展现出更好的抑瘤效应。
6 结语
综上所述,甲状腺癌的精准预防、诊断和治疗具有迫切的现实意义,其实现需要以精确病理诊断作为基础。随着甲状腺癌病理,尤其是分子病理的发展,有望做到:1)准确评估甲状腺癌高危人群发生风险,必要时采取有效措施降低风险;2)在准确诊断和分型的同时,协助提供预后和复发风险分层信息,优化患者的治疗、观察和随访方案;3)检测晚期患者的治疗靶点并预测疗效及预后,指导进行分子靶向治疗。
[1]Kitahara CM,Sosa JA.The changing incidence of thyroid cancer[J]. Nat Rev Endocrinol,2016,12(11):646-653.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015 [J].CA Cancer J Clin,2016,66(2):115-132.
[3]Collins FS,Varmus H.A new initiative on precision medicine[J].N Engl J Med,2015,372(9):793-795.
[4]Zhu XZ.The precise diagnosis in the era of precision medicine[J]. Chin J Pathol,2015,44(7):442-443.[朱雄增.精准医学时代下的精准诊断[J].中华病理学杂志,2015,44(7):442-443.]
[5]Dralle H,Machens A,Basa J,et al.Follicular cell-derived thyroid cancer[J].Nat Rev Dis Primers,2015,1:15077.
[6]Liu M,Ruan M,Chen L.Update on the molecular diagnosis and targeted therapy of thyroid cancer[J].Med Oncol,2014,31(6):973.
[7]Wells SA,Asa SL,Dralle H,et al.Revised American thyroid association guidelines for the management of medullary thyroid carcinoma[J].Thyroid,2015,25(6):567-610.
[8]Metzger R,Milas M.Inherited cancer syndromes and the thyroid: an update[J].Curr Opin Oncol,2014,26(1):51-61.
[9]Chinese society of endocrinology,Chinese society of general surgery endocrinology group,China anti-cancer association head and neck tumor professional committee,et al.Guidelines on the diagnosis and treatment of thyroid nodules and differentiated thyroid carcinomas[J].Chin J Nucl Med Mol Imaging,2013,33(2):96-115. [中华医学会内分泌学分会,中华医学会外科学分会内分泌学组,中国抗癌协会头颈肿瘤专业委员会,等.甲状腺结节和分化型甲状腺癌诊治指南[J].中华核医学与分子影像杂志,2013,33(2):96-115.]
[10]Haugen BR,Alexander EK,Bible KC,et al.2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer:the American thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J].Thyroid,2016,26(1):1-133.
[11]Huan Q,Wang K,Lou F,et al.Epidemiological characteristics of thyroid nodules and risk factors for malignant nodules:a retrospective study from 6 304 surgical cases[J].Chin Med J(Engl),2014,127(12): 2286-2292.
[12]Cibas ES,Ali SZ.The bethesda system for reporting thyroid cytopathology[J].Am J Clin Pathol,2009,132(5):658-665.
[13]Suh CH,Baek JH,Lee JH,et al.The role of core-needle biopsy as a first-line diagnostic tool for initially detected thyroid nodules[J]. Thyroid,2016,26(3):395-403.
[14]Xing M.BRAF mutation in thyroid cancer[J].Endocr Relat Cancer, 2005,12(2):245-262.
[15]Liu X,Bishop J,Shan Y,et al.Highly prevalent TERT promoter mutations in aggressive thyroid cancers[J].Endocr Relat Cancer,2013,20 (4):603-610.
[16]Liu R,Xing M.TERT promoter mutations in thyroid cancer[J].Endocr Relat Cancer,2016,23(3):R143-155.
[17]Alexander EK,Kennedy GC,Baloch ZW,et al.Preoperative diagnosis of benign thyroid nodules with indeterminate cytology[J].N Engl J Med,2012,367(8):705-715.
[18]Nikiforov YE,Ohori NP,Hodak SP,et al.Impact of mutational testing on the diagnosis and management of patients with cytologically indeterminate thyroid nodules:a prospective analysis of 1 056 FNA samples[J].J Clin Endocrinol Metab,2011,96(11):3390-3397.
[19]Nikiforova MN,Wald AI,Roy S,et al.Targeted next-generation sequencing panel(ThyroSeq)for detection of mutations in thyroid cancer[J].J Clin Endocrinol Metab,2013,98(11):E1852-1860.
[20]Nikiforov YE,Carty SE,Chiosea SI,et al.Highly accurate diagnosis of cancer in thyroid nodules with follicular neoplasm/suspicious for a follicular neoplasm cytology by ThyroSeq v2 next-generation sequencing assay[J].Cancer,2014,120(23):3627-3634.
[21]Nikiforov YE,Carty SE,Chiosea SI,et al.Impact of the multi-gene thyroseq next-generation sequencing assay on cancer diagnosis in thyroid nodules with atypia of undetermined significance/follicular lesion of undetermined significance cytology[J].Thyroid,2015,25 (11):1217-1223.
[22]Nikiforov YE,Seethala RR,Tallini G,et al.Nomenclature revision for encapsulated follicular variant of papillary thyroid carcinoma:A paradigm shift to reduce overtreatment of indolent tumors[J].JAMA Oncol,2016,2(8):1023-1029.
[23]Xing M,Alzahrani AS,Carson KA,et al.Association between BRAF V600E mutation and mortality in patients with papillary thyroid cancer[J].JAMA,2013,309(14):1493-1501.
[24]The Cancer Genome Atlas Research Network.Integrated genomic characterization of papillary thyroid carcinoma[J].Cell,2014,159 (3):676-690.
[25]Schlumberger M,Tahara M,Wirth LJ,et al.Lenvatinib versus placebo in radioiodine-refractory thyroid cancer[J].N Engl J Med,2015, 372(7):621-630.
[26]Brose MS,Nutting CM,Jarzab B,et al.Sorafenib in radioactive iodine-refractory,locally advanced or metastatic differentiated thyroid cancer:a randomised,double-blind,phase 3 trial[J].Lancet, 2014,384(9940):319-328.
[27]Brose MS,Cabanillas ME,Cohen EE,et al.Vemurafenib in patients with BRAF(V600E)-positive metastatic or unresectable papillary thyroid cancer refractory to radioactive iodine:a non-randomised, multicentre,open-label,phase 2 trial[J].Lancet Oncol,2016,17(9): 1272-1282.
[28]Li JH,Zhu Y,Yang J.The progress in tumor immune checkpoint-targeted immunotherapy[J].Fudan Univ J Medi Sci,2016,43(1):110-114.[李建华,朱 迎,杨 菁.肿瘤免疫检查点靶向治疗的研究进展[J].复旦学报(医学版),2016,43(1):110-114.]
[29]Bastman JJ,Serracino HS,Zhu Y,et al.Tumor-infiltrating T cells and the PD-1 checkpoint pathway in advanced differentiated and anaplastic thyroid cancer[J].J Clin Endocrinol Metab,2016,101(7): 2863-2873.
[30]Chowdhury S,Veyhl J,Jessa F,et al.Programmed death-ligand 1 overexpression is a prognostic marker for aggressive papillary thyroid cancer and its variants[J].Oncotarget,2016,7(22):32318-32328.
[31]Mehnert JM,Varga A,Brose M,et al.Pembrolizumab for advanced papillary or follicular thyroid cancer:preliminary results from the phase 1b KEYNOTE-028 study[J].J Clin Oncol,2016,34(Suppl):6091.
[32]Brauner E,Gunda V,Vanden BP,et al.Combining BRAF inhibitor and anti PD-L1 antibody dramatically improves tumor regression and anti tumor immunity in an immunocompetent murine model of anaplastic thyroid cancer[J].Oncotarget,2016,7(13):17194-17211.
(2016-12-01收稿)
(2017-01-04修回)
(编辑:孙喜佳 校对:周晓颖)
Accurate pathological diagnosis of thyroid cancer in the era of precision medicine
Jian CHEN,Liang JIANG
Liang JIANG;E-mail:jiangliang2015@aliyun.com
Department of Head and Neck Surgery,Hubei Cancer Hospital,Wuhan 430079,China
Thyroid cancer is the malignant tumor with the most rapidly increasing incidence in recent years,the overwhelming majority of which are derived from follicular cells.The most common tumor entity is differentiated thyroid cancer,which could be divided into papillary thyroid cancer and follicular thyroid cancer.The accurate pathological diagnosis of thyroid cancer is the cornerstone in the process of precision medicine which includes prevention,diagnosis and treatment.This review discusses the significance of accurate pathological diagnosis in the precision medicine of thyroid cancer based on the following four aspects:1)the risk evaluation of thyroid cancer,2)preoperative accurate diagnosis of thyroid nodules,3)the risk stratification of prognosis and recurrence,and 4)the guidance of molecular targeted therapy in advanced patients.
accurate pathological diagnosis,thyroid cancer,precision medicine
10.3969/j.issn.1000-8179.2017.04.389

湖北省肿瘤医院头颈外科(武汉市430079)
江亮 jiangliang2015@aliyun.com
陈健 专业方向为头颈部肿瘤基础和临床研究。
E-mail:chenjian2003@aliyun.com

