合成生物学助力应急疫苗研制
袁盛凌,王艳春,刘纯杰
军事医学科学院 生物工程研究所,北京 100071
综述
合成生物学助力应急疫苗研制
袁盛凌,王艳春,刘纯杰
军事医学科学院 生物工程研究所,北京 100071
合成生物学具有系统性思维和工程学理念的特点,致力于创造新的生命或新的系统。合成生物学为疫苗研发人员提供了新的思路,不断开发出新疫苗研制的技术平台。通过抗原重构技术,合成的强抗原能够很好地激活VRC0-1种系的B细胞;利用合成生物学合成自组装的纳米颗粒疫苗,能够有效地暴露保守抗原;通过合成生物学完成流感疫苗基因组的快速组装,大大缩短了疫苗的研制周期;通过系统性地改造,重组沙门菌再一次成为疫苗开发的重要工具。合成生物学在应急疫苗研发过程中疫苗研制平台搭建及快速合成新发传染病抗原方面发挥着突出作用。
合成生物学;疫苗;流感疫情;重组沙门菌;递送系统
合成生物学研究建立在分子生物学、遗传工程、代谢工程、生物信息学、系统生物学及各种组学研究的基础之上,其定义是:利用工程理念理性合成复杂的、具有生物意义的不同层次系统——从单个生物分子到整个细胞、组织、器官、个体乃至群体,执行自然界中没有的功能。
合成生物学作为最新的思维工具和技术手段,帮助研究人员不断拓展新的研究领域。比如在疫苗研发过程中,合成生物学帮助人们设计制造更有效、更通用、更及时的疫苗。在病毒肆虐的今天,严重急性呼吸综合征冠状病毒(SARS-CoV)、中东呼吸综合征冠状病毒(MERS-CoV)、埃博拉病毒(Ebola virus)、寨卡病毒(Zika virus)等病原微生物,正在不断威胁着人类的健康。随着全球人群的流动性越来越大,疫情传播速度极快,疫情防控迫在眉睫。研制有效的应急疫苗是科研人员义不容辞的责任。合成生物学的研究方法能够更好地为科研人员搭建疫苗研制平台,锻炼应急疫苗研制的技术能力,在真正疫情到来之时,将平台上的抗原组件进行替换,通过平台技术衔接,在最短的时间内生产出适应疫情的疫苗,让科研力量成为保护人类健康、维护社会稳定的坚强后盾。
1 合成生物学帮助设计HIV强抗原
如果天然病毒的免疫原性比较弱,可以利用合成生物学合成模拟病毒颗粒的强免疫原。一直以来,人免疫缺陷病毒(HIV)的包膜糖蛋白虽然可以激发机体产生中和抗体,但人体产生的中和抗体却极少,主要原因是:①天然的包膜糖蛋白的免疫原性弱;②免疫原具有高度变异性;③免疫原被最外层的糖苷类物质包裹。以上三个原因使得天然病毒不能有效刺激人体的免疫系统,产生的有效中和抗体少之又少。所以,设计强免疫原是研制有效的艾滋病疫苗的关键。
VRC01类广谱中和抗体,可以特异性地针对HIV gp120上的CD4结合位点,所以被认为是对抗病毒的有效抗体。然而天然的HIV蛋白无法结合或刺激VRC01的种系B细胞,因此无法启动抗体反应过程。研究者着手设计一种能够实现这一过程的人工免疫原[1]。他们利用蛋白质建模软件,改善了VRC01种系B细胞抗体与HIV包膜蛋白结合能力;随后生成了包含所有可能的有益突变组合的文库,获得了数以百万计的突变体,利用酵母表面展示技术和FACS对它们进行筛查,结合计算机预测和定向演化,生成了几个对种系VRC01类抗体具有高亲和力的突变包膜蛋白,利用eOD软件确定了优化的eOD-GT6免疫原。采用X线晶体学确定了这种免疫原的3D原子结构、VRC01抗体的晶体结构,以及免疫原与抗体结合在一起的结构。在此基础上,研究人员设计合成了纳米级自组装的模拟病毒颗粒(图1),其由60个拷贝的单体聚合而成,每一个单体由二氧四氢蝶啶合成酶融合包膜糖蛋白eOD-GT6而构成,eOD-GT6上糖苷的位置完全不会遮蔽免疫原。这个模拟的纳米病毒颗粒极好地激活了培养皿中的VRC01种系B细胞,甚至成熟B细胞,而单拷贝eODGT6则不能。这充分说明通过重构免疫原的结构和组装形式,可以获得很好的免疫效果。

图1 60聚体的eOD-GT6纳米颗粒
2 合成生物学帮助设计通用流感疫苗
与HIV包膜蛋白类似,流感病毒血凝素抗原总是隐藏在分子内部,天然病毒结构不能很好地暴露这些保守的抗原表位。利用合成生物学的方法,可以将HA抗原被遮蔽的部分进行有效暴露,更有利于机体产生针对保守区段的广谱的中和抗体[2]。血凝素HA是流感病毒衣壳上的主要抗原性蛋白,而铁蛋白(ferritin)是来自幽门螺杆菌的能够自然形成球状簇的离子转运蛋白。研究人员将这2种蛋白融合起来,生成能够自动装配的HA-ferritin复合体。该复合体从铁蛋白核心伸出由HA组成的8个突起,模拟流感病毒衣壳上的天然HA突起。这种设计能使血球凝集素上的HA分子变得疏散,不会被其他衣壳蛋白遮蔽,能让免疫系统获取更全面的信息,靶向不同流感菌株的通用HA位点,包括识别宿主细胞特定受体的头部和帮助病毒入侵的茎部(图2)。

图2 自组装的纳米颗粒流感通用疫苗的设计
3 合成生物学帮助应急流感疫苗的研发
传统的流感疫苗从研制到上市最快需要几个月的时间,如2009年H1N1甲型流感病毒疫苗,在没有合成生物学技术支持的情况下,虽然以前所未有的速度进行研制和生产,但疫苗上市时仍然遗憾地错过了H1N1流感病毒肆虐的高峰期,错过了人群的最大需求时期,没有发挥应有的作用。
2013年,当新型流感病毒毒株H7N9在中国出现的时候,一个重要问题摆到人们面前:一旦这种流感病毒或其他病毒大规模来袭,人们是否能足够快地生产出足量疫苗应对疫情?应急流感疫苗的研制技术将决定在疫情防控大战中人类是否能够掌握主动。利用合成生物学的方法,J.Craig Venter的合成基因组公司与疫苗制造商瑞士诺华公司联合设计了合成流感疫苗基因组的快速研发方式[3]。这种合成方式分为两步:第一步是变异的HA和NA基因的全基因人工合成,第二步是新合成的变异基因与流感病毒的主干基因融合,制造杂合基因组,快速完成病毒拯救。
在变异的HA和NA基因的全基因人工合成中,文特尔研究所的研究人员用不到1天的时间即可将新发流感病毒的序列从网上下载、设计序列片段、人工拼接、获得病毒的HA和NA基因的正确序列。在这项应急疫苗研制项目中,文特尔研究团队创建了一种恒温一步法组装技术,称作“Gibson恒温组装法”,即利用5'核酸外切酶、高保真DNA聚合酶及连接酶的协调作用,在体外将多个带有重叠区的DNA片段组装起来,再利用error correct ErrASE商业纠错试剂盒纠正序列中的错误匹配,快速而准确地合成HA和NA基因(图3A),仅仅这项技术就比其他基因合成公司的合成时间缩短了3~5天。
随后由诺华公司负责,将人工合成的HA和NA基因拼接到PR8基因组中,合成流感病毒杂合基因组,进行病毒拯救。他们选用的主干基因是改进型的,尽量保证病毒基因间的组配达到最佳;选用的宿主细胞是疫苗工业生产许可的狗肾细胞(MDCK),在病毒拯救过程中,直接用这种细胞筛选病毒滴度高的病毒株。在严谨设计下,从拿到流行毒株序列,到合成出种子病毒,仅仅需要5天时间(图3B),将疫苗生产时间至少缩短了4周。
2013年3月31日,中国疾控中心宣布了人类H7N9传染病,并在在线数据库中储存了该病毒的基因组序列。次日,美国圣迭戈市文特尔研究所的科学家就合成了该病毒的HA和NA基因,之后他们立即将合成物送到诺华公司实验室,并与PR8融合,4月6日即制成了首个种子病毒。合成生物学助力的流感病毒疫苗的快速研制技术,成为人类战胜疫情的重要武器。
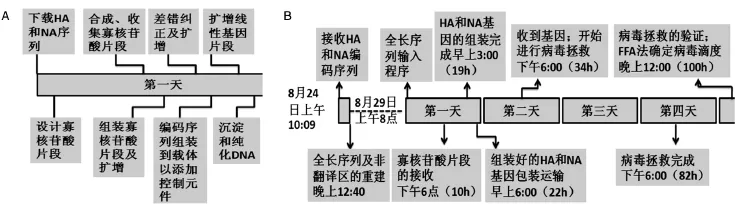
图3 流感应急疫苗合成时间表
4 合成生物学让活菌载体疫苗重新焕发新的生命
减毒沙门菌作为递送载体,已经研究了近30年。沙门菌能够侵入组织和细胞,全面激发机体的体液免疫、黏膜免疫和细胞免疫,免疫原性强,维持时间长。限制该活菌载体广泛应用的原因之一是毒性和免疫原性的平衡问题。如果减毒充分,此活菌载体的侵入性将变弱,免疫原性变差;而如果要保持其免疫原性,其残留的毒力又是疫苗安全性的一大障碍。利用合成生物学的原理,亚利桑那州立大学Roy CurtissⅢ实验室设计了重组减毒沙门菌疫苗(recombi⁃nantattenuated Salmonella vaccine,RASV)递送系统,该载体以可调节的延迟裂解为特色,保持了载体的侵入、定植能力,具备出色的免疫效果;同时,巧妙设计基因的表达,使其侵入组织后自行裂解,充分减毒[4]。它的设计原理主要是根据体外-肠道-淋巴组织中必需营养物质(如甘露糖或阿拉伯糖)逐渐匮乏的原理,构建营养缺陷菌株,毒力和功能受到环境营养物质浓度严格控制。体外培养时,阿拉伯糖来源充分,负责细菌细胞壁、脂多糖合成的基因如asd、murA在体外表达,负责细菌代谢的基因如fur、crp也在体外表达;口服入肠道后,阿拉伯糖来源减少,但asd、murA、fur、crp能继续表达,保持侵入淋巴组织的毒力;入侵淋巴组织后,由于缺乏阿拉伯糖,上述4种基因表达关闭,细菌裂解,毒力丧失;与此同时,受阿拉伯糖调控表达的阻遏蛋白不再产生,使保护性抗原表达解除抑制,在淋巴组织中大量表达,使抗原得到有效递送。他们利用RASV构建了肺炎球菌疫苗,取得了非常好的免疫效果和保护效果[5]。在此基础上,研究团队还设计合成了递送WSN流感病毒HA基因的DNA疫苗。此递送系统含有真核转录元件,当RASV侵入宿主细胞后,启动裂解行动,释放DNA载体。DNA载体入核后,开始表达相关抗原,激发宿主系统性的免疫应答。为了更好地呈现递送载体的优势,他们通过删除基因或增添新的元件,使新的递送体系具备如下特征:具有更好的侵入能力;最大限度地内在化,避免其在胞质中释放DNA疫苗;降低入侵造成的细胞凋亡或程序性死亡;增加DNA对宿主核酸酶的抗性;添加DNA核靶向序列(DTS)和核定位序列,以便DNA疫苗能够入核,有效地合成编码的保护性抗原。如此精心设计合成的流感疫苗,可以达到对小鼠100%的免疫保护[6]。此DNA疫苗可以快速制备,随病原的不同而随时改变DNA序列,比如可以将WSN流感病毒HA基因替换为其他型别的HA基因,或替换为埃博拉病毒的包膜糖蛋白GP基因。基于全新的RASV递送系统的DNA疫苗有望成为应对未知或新型生物威胁的有效防御手段。
5 应急疫苗研制过程中合成生物学的助力点
合成生物学正在蓬勃发展,它的最大特点就是创造:从创造新的生命、新的代谢通路到创造新的分子、新的递送工具……,合成生物学在疫苗研制方面为研究人员提供了更广的空间,更自由的设计。在新疫苗开发上,可以根据中和性抗体来设计并合成与之相对应的保护性抗原,为疫苗的设计提供了全新的角度;在疫苗的形式方面,可以设计成纳米颗粒,充分有效地暴露免疫原,并以聚体的形式增强其免疫原性;在疫苗递送方面,从系统的角度改进旧有的递送载体,让其呈现出最理想递送效果和绝对的安全性;从疫苗的研制效率方面,极大地缩短疫苗研发生产的时间,使人们面对流感疫情时不再束手无策。
因此,合成生物学为疫苗研制提供了全新的技术平台和技术路线。从工程的角度考虑,这些技术平台和技术路线就像模块一样,方便组装和替换,利用不同的元件,可以组装成不同的疫苗。而不同病原微生物的保护性抗原,则是技术平台中的一个个可变模块,它们与对应模块之间的相互替换,在原则上并不会改变整个技术平台的稳定性和有效性。比如每一次流感大流行可能会遭遇到不同的流感病毒,而在科研人员看来,不同的流感病毒只是换了HA和NA抗原蛋白的老朋友,因此,将新的HA和NA序列与已有的流感疫苗研制平台衔接,就可以快速制造适应新疫情的流感疫苗。
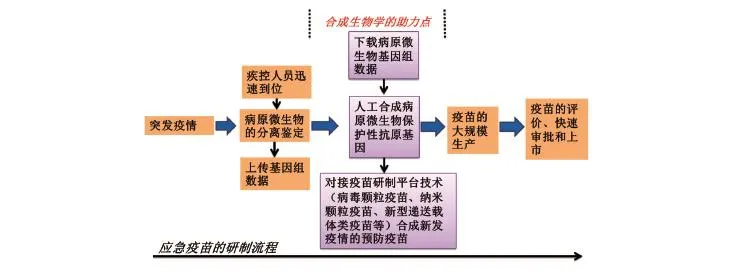
图4 应急疫苗的研制流程
其次,合成生物学技术可以保证在突发疫情来临时,可以根据病原基因组序列进行迅速分析和保护性抗原基因的快速人工合成,并且在这一点上速度可以做到极致(1天之内),有效地节约了异地甚至异国采样的路途奔波时间或样品邮寄过程所耽误的时间。
可以想见,当新的疫情悄然来袭时,疾控人员迅速到位,采集样品进行病原分析鉴定,其基因组数据在第一时间上传至联网数据库;疫苗研制人员则在第一时间下载数据,进行保护性抗原基因的人工合成并对接平台技术,合成对应疫情的新疫苗,比如病毒颗粒疫苗、纳米颗粒疫苗、新型递送载体类疫苗等;之后,疫苗的生产迅速启动,在最短的时间内拿到新发传染病的人群接种疫苗。这是多么令人盼望的一刻,但也是现有技术通过整合完全能够做到的事。合成生物学在应急疫苗的构建和平台建立方面均起到了很好的支持作用,为疫情防控打下了坚实的基础。
[1]Jardine J,Julien J P,Menis S,et al.Rational HIV immunogen design to target specific germline B cell receptors[J].Science,2013,340(6133):711-716.
[2]Kanekiyo M,Wei C J,Yassine H M,et al.Self-as⁃sembling influenza nanoparticle vaccines elicit broad⁃lyneutralizingH1N1 antibodies[J].Nature,2013,499 (7456):102-106.
[3]Dormitzer P R,Suphaphiphat P,Gibson D G,et al.Synthetic generation of influenza vaccine viruses for rapid response to pandemics[J].Sci Transl Med, 2013,5(185):185ra68.
[4]Curtiss R 3rd,Wanda S Y,Gunn B M,et al.Sal⁃monella enterica serovar Typhimurium strains with regulated delayed attenuation in vivo[J].InfectIm⁃mun,2009,77(3):1071-1082.
[5]Li Y H,Wang S F,Scarpellini G,et al.Evalua⁃tion ofnew generation Salmonella enterica serovar Typhimurium vaccines with regulated delayed attenua⁃tion to induce immune responses againstPspA[J].Proc Natl Acad Sci USA,2009,106(2):593-598.
[6]Kong W,Brovold M,Koeneman B A,et al.Turn⁃ing self-destructing Salmonella into a universal DNA vaccine delivery platform[J].Proc Natl Acad Sci USA,2012,109(47):19414-19419.
Synthetic Biology Contributes to Rapid Production of Vac⁃cine for Emergency Use
YUAN Sheng-Ling,WANG Yan-Chun,LIU Chun-Jie*
Beijing Institute of Biotechnology,Beijing 100071,China
*Corresponding author,E-mail:Liucj@nic.bmi.ac.cn
Synthetic biology,the engineering of biology,aims to synthesis of complex,biologically based systems to display functions that do not exist in nature.In this review,we focused on new ideas and new technology plat⁃forms provided by synthetic biology for the vaccine development.Through the technology of antigen reconstruction, a more effective immunogen was synthesized and could activated germline and mature VRC01-class B cells;selfassembling influenza nanoparticle vaccine induces antibodies targeting conservative regions of both the HA stem and the HA head,and produce antibodies against a wider range of flu strains than traditional vaccines;synthetic vaccine seeds will be assembled and rescued rapidly,which would accelerate responses to influenza pandemics;by systematic reconstruction,recombinant attenuated Salmonella vaccine(RASV)strains exhibiting both hyperinvasive phenotype and delayed lysis phenotype becomes a universal DNA vaccine-delivery vehicle.In all,synthetic biolo⁃gy plays an important role in new technology platforms and rapid assembly of the pathogenic microorganism anti⁃gens during vaccine development against emerging infectious diseases.
synthetic biology;vaccine;influenza pandemics;recombinant attenuated Salmonella vaccine;delivery vector
Q-3;R392
A
1009-0002(2017)01-0044-06
10.3969/j.issn.1009-0002.2017.01.008
2017-01-02
袁盛凌(1973-),女,副研究员
刘纯杰,(E-mail)Liucj@nic.bmi.ac.cn

