绿头野鸭蛋品质研究及蛋壳强度相关基因的筛选
梁素芸,闻治国,谢 明,黄 苇,侯水生*,李复煌
(1.中国农业科学院北京畜牧兽医研究所,北京 100193 2. 北京市畜牧总站,北京 100107)
绿头野鸭蛋品质研究及蛋壳强度相关基因的筛选
梁素芸1,闻治国1,谢 明1,黄 苇1,侯水生1*,李复煌2
(1.中国农业科学院北京畜牧兽医研究所,北京 100193 2. 北京市畜牧总站,北京 100107)
本试验选取体重、周龄一致的100只绿头野鸭,对其蛋品质进行测定并进行相关分析,测定指标包括蛋壳颜色、蛋壳强度、蛋壳厚度、蛋形指数、蛋白高度、哈氏单位和蛋黄颜色,同时通过转录组测序筛选了与蛋壳强度相关的候选基因。结果表明:不同蛋壳颜色的鸭蛋之间蛋形指数、蛋壳强度、蛋壳厚度、蛋白高度和哈氏单位有显著差异(P<0.05);绿头鸭大部分蛋品质性状之间相关性显著,其中蛋壳厚度与蛋壳强度呈显著正相关,相关系数为0.8742,而蛋壳颜色作为蛋壳强度的衡量指标时,白壳组强度最大,绿壳组次之,黄绿壳组最小(P<0.01);通过转录组测序对蛋壳强度进行差异表达模式对比分析,共找到差异表达基因325个,其中149个基因表达量上调, 176个基因表达量下调,与蛋壳强度相关的基因有CACNA1I、CACNB4、CALN、CACNA1S、LOC101801793等17个基因,这些基因主要参与了钙离子跨膜转运、钙离子结合、钙离子释放等生物学过程,本研究结果为进一步研究蛋壳强度差异的分子机理提供了基础。
绿头野鸭;蛋品质;转录组测序;基因筛选
禽蛋品质直接关系到禽蛋产业的发展和人类的健康生活,蛋壳的破损会给禽蛋产业造成巨大的损失[1],因此蛋壳质量在整个蛋品质中至关重要。禽类的品种和产蛋年龄[2-4]、摄入的营养[5]、产蛋环境[6]以及蛋在子宫中的时间长短都会对蛋壳强度造成影响[7],而蛋壳的结构属性(蛋壳厚度)和物质属性(超微结构)可能是蛋壳强度出现差异的主要原因[8]。蛋壳颜色一直作为衡量蛋壳强度的一种重要指标[9],研究发现绿壳蛋的蛋壳主要由胆绿素和胆绿素锌螯合物2种色素组成[10-11],绿壳蛋的蓝绿色度与蛋壳中胆绿素的浓度呈显著相关[12-13]。同时有研究发现,在鸡产蛋过程中,子宫部位基因的表达会影响蛋壳质量,禽类卵清蛋白基因(OVAL)、钙离子转运ATP酶基因家族(ATP2家族)[14]、钙离子通道上皮亚基家族(SCNN1家族)[15]等基因均被发现与蛋壳强度的差异形成有关。而水禽子宫组织基因表达是否影响蛋壳质量,目前未见报道。因此,本实验以绿头鸭为研究对象,对蛋品质性状进行相关性分析,并对蛋壳强度相关基因进行筛选,为蛋鸭分子育种提供一定的理论基础。
1 材料与方法
1.1 实验动物 实验所用的绿头野鸭均来自中国农业科学院北京畜牧兽医研究所试验基地。选取健康、体重、周龄大小一致的母鸭100只,每只鸭均单笼饲养,营养水平一致,自由采食,最后收集300枚蛋用于测定蛋品质。挑选高低2个蛋壳强度组的蛋鸭各2只,采集子宫组织样品,迅速置于液氮中冷却,保存于-80℃超低温冰箱,用于总RNA的提取。
1.2 蛋品质测定指标与方法 利用 QCR测色仪进行蛋壳颜色测定,以纯黑色为0,纯白色为81.2进行校正,数据越大表示蛋壳颜色越浅。蛋壳反射率(L* value)进行三点(蛋壳的锐端、顿端和中间)测定,结果取其平均值。蛋壳强度用蛋壳强度测定仪( ROBOT-MATION MODEL-Ⅲ)将鸭蛋尖端向上、垂直竖放测定;蛋壳厚度用蛋壳厚度测定仪(PEACOCK)测定,每个蛋测定钝端、锐端和中间三点,结果取其平均值;蛋形指数用蛋形指数测定仪测定,量取短轴和长轴长度,结果取长轴与短轴的比值。蛋黄高度、哈氏单位、蛋黄颜色均由EMT5200多功能蛋品分析仪测定。
1.3 转录组测序及差异基因筛选 样品总RNA提取步骤按照Trizol法进行,使用 Oligotex mRNA Midi试剂盒(Qiagen,德国)进行纯化提取的mRNA样品。RNA 的质量通过使用1.0%琼脂糖凝胶电泳和核酸分光光度计(Nanodrop ND-1000®)检测260 nm吸光度,当260/280 nm下测定值大于1.8时,RNA质量较好。RNA完整性通过Agilent Technologies 2100 Bioanalyzer 检 测 RIN值, 当RIN值大于8时被认为RNA比较完整。所有RNA样品均送到北京贝瑞和康生物技术有限公司进行mRNA分离、cDNA文库构建和测序。测序平台为 Illumina HiSeqTM2500。下机数据经过质控,对原始数据进行评估和可信度的分析,通过质量控制得到质量较高的序列,利用Tophat将数据映射到基因组上,然后进行碱基并鉴别遗传变异。筛选差异表达基因的过滤条件为Probability ≥ 80%,SD = 2.0,筛选显著差异基因的过滤条件为logFC > 2 或logFC < -2; P ≤ 0.05。根据基因的差异表达进行功能注释和富集分析。
1.4 统计分析 实验数据采用SAS 8.0中One Way ANOVA进行统计分析,各处理间平均值比较采用Duncan氏多重比较进行差异显著性检验,结果以平均值±标准差(Mean ± SD) 表示,以P <0.05作为差异显著性判断标准。
2 实验结果
2.1 蛋品质性状及其相关分析 蛋品质间的表型性状相关分析见表1。由表1可以看出,不同颜色蛋壳具有显著的蛋壳反射率(P<0.05);绿头野鸭群体中,白壳组的蛋壳强度大于绿壳组和黄绿壳组(P<0.01),而白壳组的蛋壳厚度极显著低于绿壳组和黄绿壳组(P<0.01),随着蛋壳颜色的加深,蛋壳强度逐渐降低,说明在绿头野鸭群体中蛋壳颜色可以作为一种衡量蛋壳强度的指标;3组在蛋形指数上呈现显著差异(P<0.05);白壳组在蛋白高度与哈氏单位上均优于绿壳组和黄绿壳组,3组蛋黄颜色无显著差异。
对7个蛋品质进行相关性分析(表2)发现,蛋壳强度与蛋壳厚度的相关系数为0.8742,具有较强相关性;蛋壳强度与蛋壳颜色、蛋形指数、蛋白高度、哈氏单位属于中等相关水平;蛋壳颜色与蛋壳强度、蛋壳厚度、蛋白高度、哈氏单位属于中等相关水平。
2.2 蛋壳强度相关差异基因的分析 本试验中,高低蛋壳强度组强度大小分别为3.968 kg/cm2、3.693kg/cm2,呈极显著差异。对不同蛋壳强度的个体进行转录组测序,分析差异表达基因,共筛选出325条差异表达基因。与低蛋壳强度组相比,高蛋壳强度组表达量显著上调的基因有149个,表达量显著下调的基因有176个。
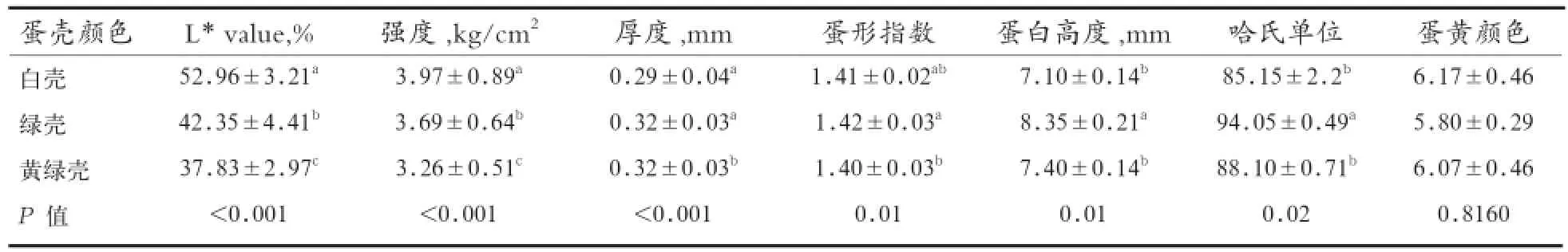
表1 绿头野鸭不同颜色(L* value)蛋的蛋品质比较
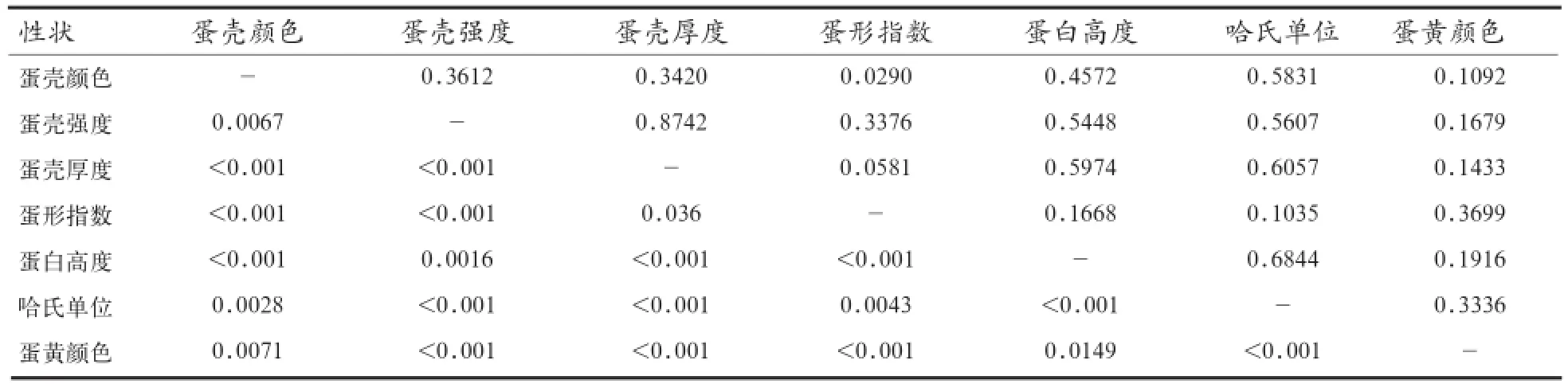
表2 蛋品质性状间的相关系数

表3 与蛋壳强度相关的差异表达基因
2.3 与蛋壳强度相关基因的筛选 本研究从325个显著差异基因中筛选了17个与绿头鸭蛋壳强度相关的重要基因,包括CACNA1S、CACNB4、LOC101801793、CAMK2A、CALN1等,如表3所示。 这些差异基因大部分与钙离子代谢相关,主要参与钙离子跨膜转运、钙离子结合、钙离子的释放等,表明钙离子在蛋壳强度形成过程中具有重要的作用。
3 讨 论
3.1 蛋品质性状及相关分析 鸟类蛋壳颜色的变化多种多样,而这种颜色的变化主要取决于胆绿素与原卟啉的含量,胆绿素浓度越高,蛋壳颜色越深,随之蛋壳反射率越低。Daniel Hanley等[16]为了更好地解释蛋壳颜色的变化而建立了蛋壳颜色的混合模型,模型基于胆绿素与原卟啉浓度的多少,利用蛋壳碳酸钙的反射率进行模型的校正,结果发现蛋壳颜色的变化与胆绿素浓度直接相关,尤其是与蛋壳的反射率结合起来测定结果更加可靠,这说明L* value对蛋壳颜色的测定具有一定的可靠性。本实验利用L* value对各品种(系)蛋壳颜色进行分组且结果呈极显著差异,证明L* value对蛋壳颜色的测定具有一定的可靠性,这与Reynolds[17]等的结论一致。
本实验发现随着蛋壳颜色的加深,蛋壳强度逐渐降低,说明在绿头野鸭群体中蛋壳颜色可以作为一种衡量蛋壳强度的指标。Campo等[18]最早提出在未受到人工选择的群体中,蛋壳颜色与蛋壳的强度存在显著的正相关,随着蛋壳颜色的变深,蛋壳质量越好,而人工选择会根据不同的选择指标而改变蛋壳强度的这一趋势。这同时也意味着,在每个群体中,随着蛋壳颜色的变化,强度也会呈现不同的变化。Ingram等[4]认为若只用蛋壳颜色去衡量蛋壳质量,结果并不准确。Carter等[19]也提出蛋壳颜色作为衡量蛋壳质量的指标并不适用于所有的品系,本研究结果只适用绿头野鸭。因此,育种工作者在蛋鸭育种工作中应先进行颜色与强度的分析,再根据不同的情况进行选择。
3.2 与蛋壳强度相关的差异基因筛选 与蛋壳矿化过程有关的子宫部基因可能是导致蛋壳质量变异的关键因素,因此,研究蛋壳矿化时期影响碳酸钙沉积的关键候选基因及其遗传变异是新的研究方向。为了寻找蛋壳强度差异形成的分子机制,本研究采用RNA-seq技术对不同强度差异组的鸭子宫进行转录组学测序及对比分析。在本研究筛选到的325个差异表达的基因中,共找到17个与钙离子转运有关的基因,主要参与钙离子跨膜转运、钙离子结合、钙离子的释放等过程。与钙离子转运有关的基因如ATP家族、SCNN1家族与OPN等基因位于其中,这些家族基因通过钠、钙等阳离子通道的改变而改变蛋壳质量。除了上述出现的基因之外,本研究发现了包括了CA家族(CALN、CAMK、CALM、CACNB4等)与手钙结合蛋白(NECAB2)等一系列新的差异基因,这些基因也是通过控制钙电压门控通道进而改变蛋壳中钙离子的转运,说明钙离子通道的改变在蛋壳强度差异形成的分子机制中占据重要地位。这些基因的筛选为鸭蛋壳强度的分子选育提供了理论基础。
4 结 论
本实验通过比较绿头野鸭群体蛋壳颜色与质量之间的关系,发现蛋壳颜色可作为绿头野鸭蛋壳强度的衡量指标,其中白壳鸭蛋的蛋壳强度最大。采用高通量转录组测序找到17个与蛋壳强度相关的差异基因,这些基因主要参与了钙离子跨膜转运、钙离子结合、钙离子释放等生物学过程,本研究结果为进一步研究蛋壳强度差异的分子机理提供了基础。
[1] Roberts, Juliet R. Factors affecting egg internal quality and egg shell quality in laying hens [J]. J Food Prot, 2004, 41(3): 161-177.
[2] Silversides F , Scott T. Effect of storage and layer age on quality of eggs from two lines of hens [J]. Poult Sci, 2001,80(8): 1240-1245.
[3] Scott T, Silversides F .The ef f ect of storage and strain of hen on egg quality[J]. Poult Sci, 2000, 79(12): 1725-1729.
[4] Ingram D, Hatten L, Homan K. A study on the relationship between eggshell color and eggshell quality in commercial broiler breeders[J]. Poult Sci, 2008, 7: 700-703.
[5] Franchini A, Sirri F,Tallarico N, et al. Oxidative stability and sensory and functional properties of eggs from laying hens fed supranutritional doses of vitamins E and C [J]. Poult Sci, 2002, 81(11): 1744-1750.
[6] Altan A, Altan Ö,Özkan S, et al. Ef f ects of dietary sodium bicarbonate on egg production and egg quality of laying hens during high summer temperature [J]. Archiv für Gef l ügelkunde, 2000,64(6): 269-272.
[7] Potts P L, Washburn K. Shell evaluation of white and brown egg strains by deformation, breaking strength, shell thickness and specif i c gravity [J]. Poult Sci, 1974, 53(3): 1123-1128.
[8] Parsons A. Structure of the eggshell [J]. Poult Sci, 1982, 61(10): 2013-2021.
[9] Godfrey G F. Shell color as a measure of egg shell quality [J]. Poult Sci, 1949, 28(1): 150-151.
[10] Kennedy G, Vevers H. A survey of avian eggshell pigments [J]. Comp Biochem Physiol B: Biochem Mol Biol, 1976, 55(1): 117-123.
[11] Schwartz S, Raux W A, Schacter B A, et al. Loss of hereditary uterine protoporphyria through chromosomal rearrangement in mutant Rhode Island Red hens [J]. Int J Biochem, 1980, 12(5): 935-940.
[12] Moreno J, Lobato E, Morales J, et al. Experimental evidence that egg color indicates female condition at laying in a songbird[J]. Behavi Ecol, 2006, 17(4): 651-655.
[13] Morales J, Ruuskanen S, Laaksonen T, et al. Variation in eggshell traits between geographically distant populations of pied f l ycatchers Ficedula hypoleuca [J]. J Avian Bioly, 2013, 44(2): 111-120.
[14] Duan Z, Chen S, Sun C, et al. Polymorphisms in ion transport genes are associated with eggshell mechanical property[J]. PloS one, 2015, 10(6): e0130160.
[15] Fan Y F, HOU Z C, YI G Q, et al.The sodium channle gene family is specially expressed in henuterus and associted with eggshell quality traits[J]. BMC Genet,2013,14:90
[16] Hanley D, Grim T, Cassey P, et al. Not so colourful after all: eggshell pigments constrain avian eggshell colour space[J]. Biol lett, 2015,11(5): 20150087.
[17] Reynolds S J, Martin G R, Cassey P. Is sexual selection blurring the functional signif i cance of eggshell coloration hypotheses? [J].Animal Behaviour, 2009,78(1): 209-215.
[18] Campo J, Escudero J. Relationship between egg‐shell colour and two measurements of shell strength in the Vasca breed [J].Brit Poult Sci, 1984, 25(4): 467-476.
[19] Carter T. The hen's egg: relationships of seven characteristics of the strain of hen to the incidence of cracks and other shell defects [J]. Brit Poult Sci, 1975, 16(3): 289-296.
Study on Quality of Mallard Eggs and Screening of Genes Related to Eggshell Strength
LIANG Su-yun, WEN Zhi-guo, XIE Ming, HUANG Wei, HOU Shui-sheng*, LI Fu-huang2
( 1.Insitite of Animal Science of CAAS, Beijing 100193,China 2.Beijing Animal Husbandry Station, Beijing 1000107, china)
A total of 100 healthy and same age mallard were selected were selected to analysis their eggs quality, including eggshell color, eggshell strength, eggshell thickness, egg shape index, White height, Haugh unit value and egg yolk color, in addition ,candidate genes related to eggshell strength were screened by transcriptome sequencing. The results showed that there were significant differences in egg shape index, eggshell strength, White height and Haugh unit value(P<0.05). The correlation coefficient of eggshell strength and thickness was 0.8742,while the eggshell color can be as a measure of egg quality in mallard, the strength of white shell was largest and yellow-green shell was the smallest(P<0.001).A total of 325 dif f erentially expressed genes were identif i ed, among which 149 genes were up-regulated and 176 genes were down-regulated. The genes related to shell strength were CACNA1I,CACNB4,CALN,CACNA1S,L OC101801793, are involved in the processes of calcium ion binding , calcium ion transmembrane transport and calcium release. The results provide a basis for further study on the molecular mechanism of the dif f erences in eggshell strength.
Mallard; Eggshell strength; Transcriptome sequencing; Gene screening
S834.2
A
10.19556/j.0258-7033.2017-04-028
2016-11-12;
2017-01-10
现代水禽产业技术体系建设专项(CARS-43)
梁素芸(1990-),女,山东滕州人,在读硕士,研究方向为家禽遗传育种,E-mail:liangsu_yun@163.com
* 通讯作者:侯水生(1959-),研究员,博士生导师,研究方向为动物遗传育种与营养,E-mail:houss@263.net

