高温干旱及复水对毛竹实生苗保护酶和脂质过氧化的影响
李 黎,宋帅杰,方小梅,杨丽芝,邵珊璐,应叶青
(1.浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安 311300;2.衢州市衢江区林业局,浙江 衢州324000)
高温干旱及复水对毛竹实生苗保护酶和脂质过氧化的影响
李 黎1,宋帅杰1,方小梅2,杨丽芝1,邵珊璐1,应叶青1
(1.浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安 311300;2.衢州市衢江区林业局,浙江 衢州324000)
为探讨高温、干旱、高温+干旱复合胁迫及复水对毛竹Phyllostachys edulis实生苗保护酶、脂质过氧化的影响,以毛竹实生苗为材料,研究了适温(昼/夜温度为28℃/22℃)正常供水(田间持水量的75%,对照),适温下干旱胁迫(田间持水量的35%),高温(昼/夜温度为40℃/22℃)正常供水,高温下干旱胁迫以及干旱胁迫后复水等4个处理对毛竹实生苗叶片中抗氧化酶、过氧化氢(H2O2)和丙二醛(MDA)的影响。结果表明:①在3种胁迫处理下,超氧化物岐化酶(SOD),过氧化物酶(POD),过氧化氢酶(CAT)活性均显著上升(P<0.05),抗坏血酸过氧化物酶(APX)活性在干旱胁迫、高温干旱复合胁迫下显著上升。其中高温处理毛竹叶片SOD和CAT活性上升幅度最大;干旱处理POD活性上升幅度最大,其次为CAT,同时过氧化氢显著高于其他各处理,达278.7 nmol·g-1;高温干旱复合胁迫下POD和APX活性上升幅度最大,MDA显著高于其他各处理。②复水后,干旱处理下过氧化氢在复水后第1天上升,引起POD和CAT活性上升,APX活性先降后升,复水后第3天毛竹叶片MDA,过氧化氢均恢复至对照水平;高温干旱复合胁迫下SOD,POD和CAT活性持续下降,APX先下降又有回升,同时MDA持续上升,过氧化氢先下降后又升高,在复水后第3天均处于较高水平,且与干旱胁迫相比差异显著(P<0.05)。毛竹实生苗在不同胁迫下有不同的保护机制,CAT和POD分别是毛竹适应高温和干旱的主要抗氧化酶,APX和POD对复合胁迫较为敏感,SOD则在3种胁迫下均对抗膜脂过氧化起到重要作用;在一定的干旱胁迫后复水,保护酶协同作用,表现出较强的恢复能力,而高温加剧了干旱对竹苗的伤害,在高温干旱复合胁迫后复水竹苗并未得到恢复。图6参29
植物生理学;毛竹;高温;干旱;复水;保护酶;过氧化氢;丙二醛
温度、光照和水分是影响竹子生长发育最重要的3个环境因子[1-2]。近年来随着全球温室效应的加剧,夏季高温灾害频发,在自然界中,高温天气常常伴随干旱出现,不同的植物种类的抗逆机制不同,对逆境胁迫的敏感性和适应能力差异较大。高温干旱胁迫下,植物体内活性氧自由基含量增加,植物启动自身的抗氧化防御系统,以避免胁迫伤害;当胁迫超过植物的承受能力时会导致活性氧代谢失调,引起膜脂过氧化,对植株造成不可逆的损伤[3-4]。对金线莲Anoectochilus roxburghii[5],马铃薯Solanum tuberosum[6]等植物的研究表明,植物保护酶活性与其自身的抗热性密切相关;卢琼琼等[7]、谷战英等[8]研究发现,水分胁迫下植物的抗氧化胁迫能力与其体内保护酶活性呈正相关;同时还有研究表明,干旱胁迫会加重高温胁迫对植物的伤害;反之,高温胁迫也会增加干旱胁迫伤害程度,双因子叠加胁迫对植物细胞的伤害远超于单因子造成的影响[9-10]。毛竹Phyllostachys edulis的分布面积很广,具有重要的经济价值和生态价值,在中国的竹产业中占有重要的地位。近年来,夏季的高温干旱天气对毛竹的生长带来严峻的考验,2013年7-9月间大规模的高温干旱天气造成浙江地区竹林大面积受灾,极大地影响竹林经济及生态环境。目前,已有研究探讨了毛竹在高温胁迫下色素[11]、干旱胁迫下保护酶活性变化及渗透调节等[12-13]方面的抗性生理。事实上探讨分析高温干旱复合胁迫处理下毛竹实生苗的生理参数变化,将有助于深入认识氧自由基反应与脂质过氧化反应的失调和紊乱内在关系。本研究以毛竹实生苗为材料,通过设置不同水分梯度、温度梯度的盆栽试验,对毛竹实生苗进行高温、干旱及复水的研究,探讨毛竹叶片抗氧化防御系统在单因子及多因子逆境下的防御机制,为今后进一步研究毛竹抵抗高温干旱及叠加胁迫提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为2014年10月份采于广西桂林的毛竹种子。
1.2 材料栽培
2014年12月22日将毛竹种子播种在上口直径为10.0 cm,下口直径7.0 cm,高8.0 cm的盆中,基质为m(泥炭)∶m(蛭石)∶m(珍珠岩)=1∶1∶1,pH 5.5~6.0,田间持水量为48.75%。播种6~8粒·盆-1,15盆为1组,下面放置塑料托盘,防止水分流失,置于浙江农林大学智能实验楼的栽培室中进行培育,日温/夜温为(23±2)℃/(17±2)℃,湿度为45%~70%。播种2个月后追加3.0 g·L-1的尿素。
培养至2015年10月26日,测得毛竹实生苗株高为25.0~30.0 cm,地径0.2 cm, 6~8株·盆-1。将毛竹实生苗移至三温区培养箱中培育,适应培养箱条件一定时间后,于2015年11月24日开始试验。
1.3 试验设计
试验设2个温度梯度,分别为28℃(T1),40℃(T2);设2个水分梯度,分别为75%田间持水量(W1),35%田间持水量(W2),采用称量法控制土壤水分。采用随机区组试验,共4个处理,分别记作T1W1(ck),T1W2,T2W1,T2W2,设重复3个·处理-1,竹苗4盆·重复-1,共计48盆竹苗。培养箱设置:光照时间为9:00-21:00,适温(T1)2组设置日温/夜温(28℃/22℃),高温(T2)2组9:00-12:00逐渐升温至40℃,15:00-21:00逐渐降温至22℃,夜温22℃。试验处理开始后,每天早、晚观察竹苗生长情况并监测荧光值,于达到萎蔫状态时复水至75%田间持水量。
1.4 测定方法
分别于处理开始后的第7天,及每个处理复水后0(取样后复水),1,3 d上午9:00采集各重复组叶片样品1.0 g。 酶液提取方法:称取0.5 g剪碎的叶片样品(去叶脉)于预冷研钵,加入2 mL预冷的磷酸缓冲液(pH 7.8,0.05 mmol·L-1),冰浴研磨成浆后倒入10 mL离心管,并用磷酸缓冲液冲洗研钵倒入离心管,使最终体积为8 mL,8 500 r·min-14℃下离心20 min,取上清液,储藏于0~4℃冰箱备用。过氧化氢(H2O2)测定采用邹琦[14]的方法;丙二醛(MDA)测定采用硫代巴比妥酸法[14];过氧化物酶(POD)活性测定采用愈创木酚法[15];超氧化物岐化酶(SOD)活性测定采用氮蓝四唑(NBT)法[14];过氧化氢酶(CAT)活性的测定采用紫外吸收法[14];抗坏血酸过氧化物酶(APX)活性的测定参照NAKANO等[16]的方法。
1.5 数据处理
采用Sigmaplot 12.5进行图形绘制,采用DPS对数据进行方差分析。
2 结果与分析
2.1 高温、干旱对毛竹实生苗叶片活性氧物质及膜脂过氧化的影响
如图1所示:毛竹叶片过氧化氢质量摩尔浓度在3种胁迫处理下均呈显著升高变化趋势,各处理的过氧化氢质量摩尔浓度由高到低依次为T1W2>T2W2>T2W1>T1W1, 以T1W2处理过氧化氢质量摩尔浓度最高,达到278.7 nmol·g-1,是对照的173.2%,表明毛竹在水分亏缺情况下积累大量活性氧。
由图2可知:相同的水分条件下,毛竹叶片MDA质量摩尔浓度在T2处理时均大于T1处理,且差异显著(P<0.05),同样,在相同的温度处理下,干旱胁迫处理组的MDA质量摩尔浓度均大于适宜水分处理组,表现为W2>W1。其中MDA质量摩尔浓度的最大值出现在高温+干旱复合胁迫,达68.1 nmol· g-1,是对照的147.5%,表明高温+干旱复合胁迫下毛竹叶片细胞膜脂过氧化较严重。
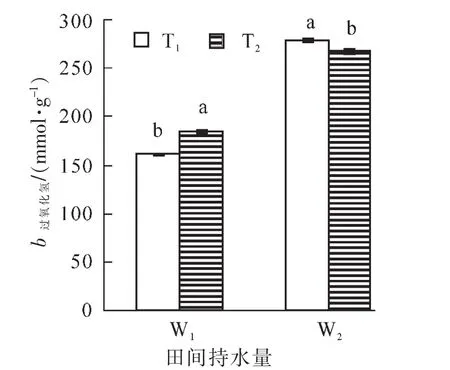
图1 高温干旱胁迫下毛竹叶片过氧化氢质量摩尔浓度的变化Figure 1 Changes of H2O2content of Phyllostachys edulis leaf under heat and drought stress
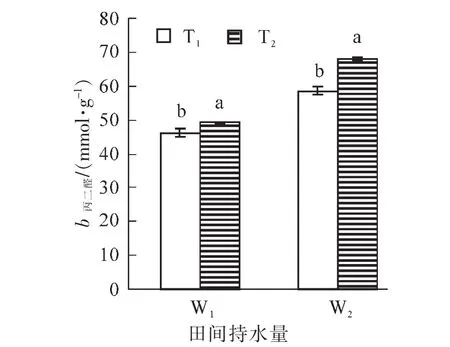
图2 高温干旱胁迫下毛竹叶片丙二醛质量摩尔浓度的变化Figure 2 Changes of MDA content of Ph.edulis leaf under heat and drought stress
2.2 高温、干旱对毛竹实生苗叶片抗氧化防御系统的影响
从图3A可知:在相同的水分条件下,高温胁迫使得SOD活性大幅升高,T2W1是T1W1的196.7%,T2W2是T1W2的151.2%,差异达到极显著水平(P<0.01);适温条件下,干旱处理的SOD活性较对照组高,表现为W2>W1,高温条件下,W1和W2处理的SOD活性无显著差异,SOD活性的最大值出现在T2W1,为7 616.5 nkat·g-1·min-1。表明SOD是防御高温伤害主要的保护酶。由图3B可知:在相同水分处理条件下,高温处理POD活性均显著高于适温,分别表现为T2W1>T1W1,T2W2>T1W2;T1处理下,干旱胁迫使POD活性显著高于正常水分处理,同样,在T2处理下,干旱处理的POD活性较正常水分处理的高,且差异显著,POD活性的最大值为T2W2处理,达8 273.3 nkat·g-1·min-1,分别是T1W1,T1W2,T2W1的150.1%,118.5%,144.9%,表明POD是毛竹适应干旱、高温+干旱复合胁迫的主要抗氧化酶。由图3C可知:适宜水分(W1)处理CAT活性,T2显著高于T1,且在T2W1处理CAT活性出现最大值,是对照的228.0%左右;而在W2处理下,适温和高温处理的CAT活性没有显著差异。高温处理下,W2显著小于W1,这可能是因为毛竹叶片在高温干旱双重胁迫环境下机体受损。表明在一定的范围内,CAT活性受高温胁迫影响显著。从图3D可以看出:W1处理下,适温和高温处理的APX活性没有显著的差异,W2处理下,高温处理APX活性极显著高于适温处理(P<0.01),表现为T2>T1;在相同的温度条件下,干旱处理(W2)的APX活性较适宜水分处理组更高,表现为W2>W1。各处理APX活性均大于对照组, 以T2W2处理最大,达49.3 nkat·g-1·min-1,是对照组的261.8%。表明APX在干旱、高温+干旱胁迫下起到重要的防御作用。
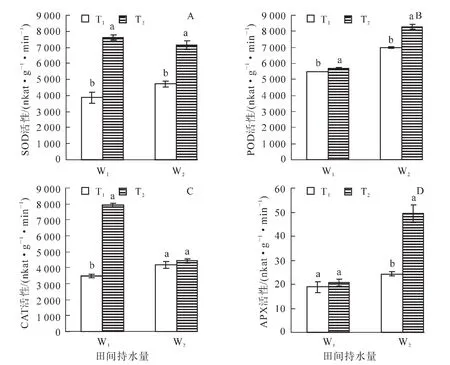
图3 高温干旱胁迫下毛竹叶片SOD,POD,CAT和APX活性的变化Figure 3 Changes of SOD,POD,CAT and APX activity of Phyllostachys edulis leaf under heat and drought stress
2.3 复水对毛竹实生苗抗氧化防御系统及膜脂过氧化的影响
2.3.1 复水对毛竹实生苗活性氧物质及膜脂过氧化的影响 由图4可以看出:在复水当天,2个处理下过氧化氢质量摩尔浓度均保持在相同水平,没有显著性差异,复水后T1W2处理下过氧化氢质量摩尔浓度后先上升后下降,且复水后第3天过氧化氢质量摩尔浓度显著低于复水前,而在T2W2处理下,过氧化氢质量摩尔浓度先下降后上升,且差异显著(P<0.05)。如图5所示:MDA质量摩尔浓度在复水当天处于较高的水平,复水后,在T1W2处理下表现出持续性下降趋势,且差异显著(P<0.05),然而在T2W2处理下,MDA质量摩尔浓度呈现持续上升的趋势,且上升幅度较大,2个处理下的MDA质量摩尔浓度始终存在显著差异(P<0.05),表明复水并没有使植物受到的胁迫损伤得到恢复。
2.3.2 复水对毛竹实生苗抗氧化防御系统的影响 如图6A所示:在T1W2(干旱)处理下,毛竹叶片SOD活性在复水1 d后变化不明显,复水后第3天显著性上升(P<0.05),T2W2处理SOD活性呈持续下降的趋势。由图6B可知:复水后POD活性在T1W2处理下随复水时间的延长呈现先上升后下降的趋势,且差异显著(P<0.05),而在T2W2处理下持续性下降,在复水后第3天下降至接近对照的水平。从图6C可以看出:2种不同处理下毛竹叶片中CAT活性的变化趋势同POD相似,在T1W2表现出先上升后下降,在复水后1 d大幅上升到5 524.4 nkat·g-1·min-1,是复水当天的162.6%,随后缓慢下降,而T2W2处理下的CAT活性持续下降,在复水后第3天CAT活性仅1 131.9 nkat·g-1·min-1,可能是高温干旱叠加胁迫对植物体造成严重损伤而导致酶活性下降,且2个处理间的酶活性均有显著性差异(P<0.05)。如图6D所示:毛竹叶片APX活性在2个处理下均表现出先下降后上升的趋势,且差异显著(P<0.05),T2W2处理下的毛竹叶片APX活性始终显著高于T1W2处理,在T1W2处理下复水后第3天APX活性回升至对照水平。
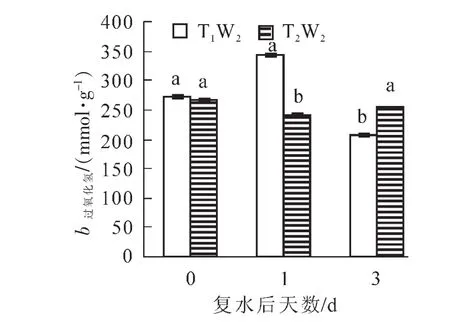
图4 复水对毛竹叶片过氧化氢质量摩尔浓度的影响Figure 4 Effect of rewatering on H2O2content of Phyllostachys edulis leaf
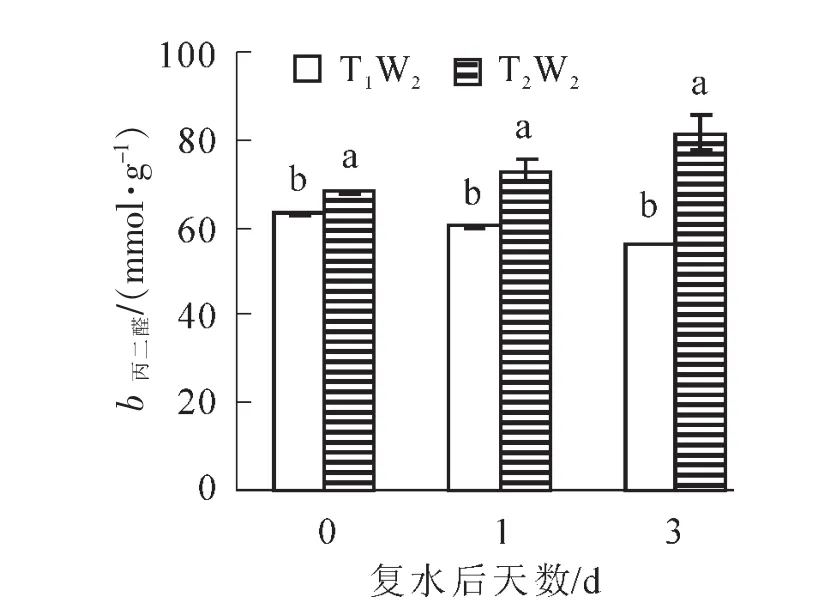
图5 复水对毛竹叶片丙二醛质量摩尔浓度的影响Figure 5 Effect of rewatering on MDA content of Phyllostachys edulis leaf
3 讨论
3.1 高温、干旱对毛竹实生苗叶片抗氧化防御系统及膜脂过氧化的影响
植物在正常的生长环境下,体内的自由基活性氧的产生和清除处于平衡的状态,不会对植物造成伤害,逆境胁迫下植物体内活性氧的产生和清除的平衡被打破,活性氧积累,植物自身的抗氧化防御系统启动以适应或抵抗逆境伤害[18],植物体内活性氧清除系统主要分为酶促和非酶促两类,酶促清除系统主要包括POD,CAT,SOD,APX等酶类[19]。本研究结果表明:在高温干旱胁迫下,保护酶活性均表现出不同程度的升高,其中SOD,POD,CAT活性在3种胁迫处理下均有较为显著的上升趋势,APX活性在高温胁迫下没有显著变化,而在干旱胁迫和高温干旱复合胁迫处理有显著的上升。高温胁迫使SOD和CAT上升幅度最大,表明这两种酶对温度最敏感;干旱胁迫下POD上升的幅度最大,其次是CAT,表明POD对水分最敏感;POD和APX等2种酶活性在高温+干旱复合胁迫下上升幅度最大;其中SOD酶活性在3种胁迫下均有显著性升高(P<0.05),它能将O2-·歧化成过氧化氢(H2O2),随后POD,CAT,APX等抗氧化酶协调作用将过氧化氢(H2O2)分解成对细胞无毒害的水(H2O),以达到清除活性氧物质、保护细胞免受氧化伤害的目的[20]。这和前人对小麦Triticun aestivum[21],沙棘Hippophae rhamnoides等[22]的研究结果相同。植物在受到胁迫时体内活性氧自由基积累并导致膜脂过氧化,丙二醛 (MDA)是膜脂过氧化的主要产物,其积累可以检测细胞膜脂过氧化的程度。过氧化氢和MDA在高温胁迫下较干旱胁迫和高温干旱复合胁迫没有较大幅度的上升,表明SOD,CAT活性的大幅增长有效的将细胞积累的过氧化氢分解成无害的水和分子氧,使得细胞免受氧化伤害,这与谢亚军等[23]对甘草Glycyrrhiza uralensis的研究结果相似。高温干旱复合胁迫处理下,毛竹叶片中过氧化氢质量摩尔浓度急速上升,引起细胞膜脂过氧化,MDA质量摩尔浓度急速升高,同时SOD,POD,APX酶活性也大幅度升高,这与吴永波等[24]的研究结果相似。
3.2 复水对毛竹实生苗叶片抗氧化系统及膜脂过氧化的影响
植物在遭受干旱胁迫后复水处理可以检测植物自身是否有适应干旱胁迫的能力[25]。周自云等[26]的研究发现,在对酸枣Zizyphus jujuba var.spinosa进行多次干旱-复水实验后,酸枣具有了更强的适应干旱逆境的能力,植物经历适度干旱胁迫后复水,能够产生补偿或超补偿的正面效应[27-28]。本研究发现:干旱处理(T1W2)复水后第3天,MDA和过氧化氢质量摩尔浓度基本接近对照水平,而过氧化氢质量摩尔浓度则在复水后第1天回升,诱导POD和CAT活性上升,同时,APX活性也先降后升,在复水后第3天达到对照水平,这与崔豫川等[29]的研究结果相似。T2W2处理毛竹叶片保护酶活性在复水后整体上均处于持续性下降的趋势,其中POD和CAT的活性远低于对照及T1W2,同时,T2W2处理MDA质量摩尔浓度持续上升。
4 结论
3种胁迫对毛竹实生苗叶片保护酶系统和膜脂过氧化程度的影响不同,CAT在高温胁迫处理起到主要作用,POD对干旱胁迫响应较为敏感,APX和POD是毛竹适应高温干旱复合胁迫的主要抗氧化酶,SOD在3种胁迫处理均起到重要作用,毛竹实生苗通过自身的抗氧化防御系统主动适应逆境胁迫以维持正常生理功能。干旱处理的毛竹在复水3 d后各项指标基本恢复至对照水平,表明毛竹实生苗具有一定的耐旱性,复合胁迫处理的毛竹叶片各指标在复水3 d后均未恢复,这可能是由于高温干旱复合胁迫对毛竹造成了不可逆的损伤,复水处理并未使胁迫得到解除。另外,植物遭受高温干旱胁迫时间的长短及复水时间的长短对植物的恢复情况可能会有不同的效果,需要再进一步研究复水时间与植物恢复情况之间的关系。
[1] 毛美红,丁笑章,傅柳方,等.干旱对毛竹林新竹成竹影响的调查分析[J].世界竹藤通讯,2012,10(1):12-15. MAO Meihong,DING Xiaozhang,FU Liufang,et al.Investigation of the effect of drought on new moso forest cultiva-tion[J].World Bamboo Rattan,2012,10(1):12-15.
[2] 李应,陈双林,李迎春,等.气候因子对竹子生长的影响研究综述[J].竹子研究汇刊,2011,30(3):9-17. LI Ying,CHEN Shuanglin,LI Yingchun,et al.Research review in the effects of climate factors on bamboo growth[J].J Bamboo Res,2011,30(3):9-17.
[3] SCANDALIOS J G.Oxygen stress and superoxide dismutases[J].Plant Physiol,1993,101(1):7-11.
[4] 简令成,王红.逆境植物细胞生物学[M].北京:科学出版社,2009:232-240.
[5] 林晓红,施木田,林三睦.高温胁迫对金线莲叶绿素荧光参数及SOD活性与电导率的影响[J].热带作物学报,2014,35(6):1137-1142. LIN Xiaohong,SHI Mutian,LIN Sanmu.Effect of high-temperature stress on chlorophyll fluorescence parameters,SOD activity and electrolyte leakage of Anoectochilus roxburghii(Wall.)Lindl.and Anoectochilus formosanus Hayata[J]. Chin J Trop Crops,2014,35(6):1137-1142.
[6] 任彩虹,闫桂琴,郜刚,等.高温胁迫对马铃薯幼苗叶片生理效应的影响[J].中国马铃薯,2007,21(1):5-10. REN Caihong,YAN Guiqin,GAO Gang,et al.Physiological effects of high temperature stress on leaves of potato seedlings[J].Chin Potato J,2007,21(1):5-10.
[7] 卢琼琼,宋新山,严登华.干旱胁迫对大豆苗期光合生理特性的影响[J].中国农学通报,2012,28(9):42-47. LU Qiongqiong,SONG Xinshan,YAN Denghua.Effects of drought stress on photosynthetic physiological characteristics in soybean seedling[J].Chin Agric Sci Bull,2012,28(9):42-47.
[8] 谷战英,谢碧霞,梁文斌,等.NAA处理对圣诞红幼苗抗旱性的影响[J].中南林业科技大学学报,2008,28(5):64-67. GU Zhanying,XIE Bixia,LIANG Wenbin,et al.Effects of NAA treatment on drought resistance of Euphorbia pulcherrima seedlings[J].J Cent South Univ For Technol,2008,28(5):64-67.
[9] 刘琴,孙辉,何道文.干旱和高温对植物胁迫效应的研究进展[J].西华师范大学学报(自然科学版),2005,26(4):364-369. LIU Qin,SUN Hui,HE Daowen.Plant responses to the high temperature and moisture stress[J].J China West Norm Univ Nat Sci,2005,26(4):364-369.
[10] CRAUFURD P Q,PEACOCK J M.Effect of heat and drought stress on sorghum (Sorghum bicolor)(Ⅱ)grain yield[J].Exper Agric,1993,29(1):77-86.
[11] 许改平,吴兴波,刘芳,等.高温胁迫下毛竹叶片色素含量与反射光谱的相关性[J].林业科学,2014,50(5):41-48. XU Gaiping,WU Xingbo,LIU Fang,et al.The correlation between the pigment content and reflectance spectrum in Phyllostachys edulis leaves subjected to high temperature[J].Sci Silv Sin,2014,50(5):41-48.
[12] 应叶青,郭璟,魏建芬,等.干旱胁迫对毛竹幼苗生理特性的影响[J].生态学杂志,2011,30(2):262-266. YING Yeqing,GUO Jing,WEI Jianfen,et al.Effects of drought stress on physiological characteristics of Phyllostacys edulis seedlings[J].Chin J Ecol,2011,30(2):262-266.
[13] 叶松涛,杜旭华,宋帅杰,等.水杨酸对干旱胁迫下毛竹实生苗生理生化特征的影响[J].林业科学,2015,51(11):25-31. YE Songtao,DU Xuhua,SONG Shuaijie,et al.Effect of salicylic acid on physiological and biochemical characteristics of Phyllostachys edulis seedlings under drought stress[J].Sci Silv Sin,2015,51(11):25-31.
[14] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:161-167.
[15] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003:267-268.
[16] NAKANO Y,ASADA K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].Plant Cell Physiol,1981,22(5):867-880.
[17] 王晓东,李长海,杜晓琪.干旱胁迫对真桦苗木抗氧化系统及脂质过氧化的影响[J].防护林科技,2011,102(3):31-42. WANG Xiaodong,LI Changhai,DU Xiaoqi.Effects of drought stress on antioxidant system&lipid peroxidation in Betula maximowicziana seedlings[J].Protect For Sci Technol,2011,102(3):31-42.
[18] ZGALLAI H,STEPPE K,LEMEUR R.Effects of different levels of water stress on leaf water potential,stomatal resistance,protein and chlorophyll content and certain anti-oxidative enzymes in tomato plants[J].J Integr Plant Biol, 2006,48(6):679-685.
[19] 孙存华,李扬,贺鸿雁,等.藜对干旱胁迫的生理生化反应[J].生态学报,2005,25(10):2556-2561. SUN Cunhua,LI Yang,HE Hongyan,et al.Physiological and biochemical responses of Chenopodium album to drought stresses[J].Acta Ecol Sin,2005,25(10):2556-2561.
[20] HUANG Bingru,LIU Xiaozhong.Summer root decline:production and mortality for four cultivars of creeping bentgrass[J].Crop Sci,2003,43(1):258-265.
[21] 张英华,杨佑明,曹莲,等.灌浆期高温对小麦旗叶与非叶器官光合和抗氧化酶活性的影响[J].作物学报,2015,41(1):136-144. ZHANG Yinghua,YANG Youming,CAO Lian,et al.Effect of high temperature on photosynthetic capability and antioxidant enzyme activity of flag leaf and non-leaf organs in wheat[J].Acta Agron Sin,2015,41(1):136-144.
[22] 裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013,33(5):1386-1396. PEI Bin,ZHANG Guangcan,ZHANG Shuyong,et al.Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities in Hippophae rhamnoide Linn.seedings[J].Acta Ecol Sin,2013,33(5):1386-1396.
[23] 谢亚军,王兵,梁新华,等.干旱胁迫对甘草幼苗活性氧代谢及保护酶活性的影响[J].农业科学研究,2008,29(4):19-22. XIE Yajun,WANG Bing,LIANG Xinhua,et al.Effect of drought stress on active oxygen metabolism and activities of protective enzymes of licorice seedlings[J].J Agric Sci,2008,29(4):19-22.
[24] 吴永波,叶波.高温干旱复合胁迫对构树幼苗抗氧化酶活性和活性氧代谢的影响[J].生态学报,2016,36(2):403-410. WU Yongbo,YE Bo.Effects of combined elevated temperature and drought stress on anti-oxidative enzyme activities and reactive oxygen species metabolism of Broussonetia papyrifera seedlings[J].Acta Ecol Sin,2016,36(2):403-410.
[25] 吴甘霖,段仁燕,王志高,等.干旱和复水对草莓叶片叶绿素荧光特性的影响[J].生态学报,2010,30(14):3941-3946. WU Ganlin,DUAN Renyan,WANG Zhigao,et al.Effects of drought stress and rehydration on chlorophyll fluorescence characteristics in Fragaria×ananassa Duch[J].Acta Ecol Sin,2010,30(14):3941-3946.
[26] 周自云,梁宗锁,李硕,等.干旱-复水对酸枣相对含水量、保护酶及光合特征的影响[J].中国生态农业学报,2011,19(1):93-97. ZHOU Ziyun,LIANG Zongsuo,LI Shuo,et al.Effect of water stress and re-watering on relative water content,protective enzyme and photosynthetic characteristics of wild jujube[J].Chin J Eco-Agric,2011,19(1):93-97.
[27] 薛慧云,张永江,刘连涛,等.干旱胁迫与复水对棉花叶片光谱、光合和荧光参数的影响[J].中国农业科学,2013,46(11):2386-2393. XUE Huiyun,ZHANG Yongjiang,LIU Liantao,et al.Responses of spectral reflectance,photosynthesis and chlorophyll fluorescence in cotton during drought stress and rewatering[J].Sci Agric Sin,2013,46(11):2386-2393.
[28] 王立彬,祖伟,董守坤,等.干旱程度及时期对复水后大豆生长和代谢补偿效应的影响[J].农业工程学报,2015,31(11):150-156. WANG Libin,ZU Wei,DONG Shoukun,et al.Effects of drought stresses and times on compensation effect after rewatering in soybean[J].Trans Chin Soc Agric Eng,2015,31(11):150-156.
[29] 崔豫川,张文辉,李志萍.干旱和复水对栓皮栎幼苗生长和生理特性的影响[J].林业科学,2014,50(7):66-73. CUI Yuchuan,ZHANG Wenhui,LI Zhiping.Effects of drought stress and rewatering on growth and physiological characteristics of Quercus variabilis seedling[J].Sci Silv Sin,2014,50(7):66-73.
Protection enzymes and lipid peroxidation in Phyllostachys edulis seedlings with temperature and water stresses
LI Li1,SONG Shuaijie1,FANG Xiaomei2,YANG Lizhi1,SHAO Shanlu1,YING Yeqing1
(1.The Nurturing Station for the State Key Laboratory of Subtropical Silviculture,Zhejiang A&F University,Lin’an 311300,Zhejiang,China;2.Forest Enterprise of Qujiang District of Quzhou City,Quzhou 324000,Zhejiang,China)
To determine the effects of high temperature,drought,combined high temperature and drought,and re-watering on protective enzymes and lipid peroxidation of Phyllostachys edulis seedlings,an experiment was set up with treatments:1)optimal temperature (day 28℃/night 22℃)and normal hydration (75%of field water-holding capacity)as a control group,2)optimal temperature and drought(35%of field water-holding capacity),3)high temperature (day 40℃/night 22℃)and normal hydration,and 4)combined stress followed by re-watering to determine the effects on antioxidase,hydrogen peroide (H2O2),and malondialdehyde(MDA).Samples were respectively collected on Day 7 after the start of treatment,and at 9:00 am on Day 0,1, 3 after re-watering,sample weight of each group is 1.0 g.Results showed that 1)With high temperature SODactivity increased the most(P<0.01),and with drought POD activity was greatest(P<0.05);after drought the H2O2level was significantly higher(P<0.01)than other conditions.After combined stress,POD and APX activities increased the most(P<0.01),and the level of MDA was higher than other treatments (P<0.05).2)On Day 1 after re-watering,H2O2increased (P<0.05)leading to an increase of POD and CAT activity (P<0.05)with APX activity decreasing then increasing(P<0.05).On Day 3 after re-watering,levels of MDA and H2O2returned to levels of the control group,but with the combined-stress treatment,SOD,POD,and CAT activities continuously decreased(P<0.05)and APX activity and H2O2levels decreased and then increased(P<0.05)with MDA levels continuing to rise (P<0.05).On Day 3 after re-watering MDA and H2O2were at high levels and significantly higher than those of drought conditions (P<0.05).Thus,the protective mechanism for Ph.edulis seedlings with high temperature was CAT,with drought was POD,and with combined-stress conditions were APX and POD,with SOD playing an important role in anti lipid peroxidation for all three stresses.[Ch,6 fig.29 ref.]
plant physiology;Phyllostachys edulis;heat;drought;rehydration;protective enzyme;hydrogen peroxide;malondialdehyde
S718.3
A
2095-0756(2017)02-0268-08
10.11833/j.issn.2095-0756.2017.02.010
2016-03-09;
2016-04-28
浙江省省院合作林业科技项目(2013SY04)
李黎,从事竹林培育技术研究。E-mail:295006161@qq.com。通信作者:应叶青,教授,博士,从事现代竹苗培育及竹林培育技术研究。E-mail:yeqing@zafu.edu.cn
——以新源县为例

