脂肪干细胞复合真皮脱细胞基质修复兔关节软骨缺损的实验研究
舒雄,郑蕊,杰永生,陈磊,靳少锋,綦惠,孙磊
脂肪干细胞复合真皮脱细胞基质修复兔关节软骨缺损的实验研究
舒雄,郑蕊,杰永生,陈磊,靳少锋,綦惠,孙磊
目的探讨脂肪间充质干细胞(ADSCs)复合小牛真皮脱细胞基质(ADM)参与修复兔膝关节软骨缺损的可行性。
脂肪干细胞; 真皮脱细胞基质; 支架; 关节软骨; 组织工程
关节软骨损伤是临床常见病和多发病,由于关节软骨是无血管、淋巴管及神经的单一结缔组织,营养来源于周围关节滑液的滋润,一旦损伤其再生修复能力十分有限。目前临床治疗方法主要包括软骨下钻孔[1]、损伤软骨面给予微骨折刺激局部组织修复[2]、骨膜与软骨膜移植以及软骨移植[3]等,上述方法均有其局限性。近些年来,组织工程的技术为软骨缺损的治疗提供了新的途径,2001 年,Zuk等[4-5]从人体脂肪抽取物中成功分离出了脂肪干细胞,它具有与骨髓间充质干细胞类似的特性,具有来源丰富、扩增能力强,同时可以多向诱导分化,逐渐成为组织工程领域的研究热点。天然支架在组织工程中起支撑引导干细胞增殖、分化并提供三维构建模板的作用。异体小牛真皮脱细胞基质(acellular dermal matrix,ADM)是一种细胞外基质[6],它具有细胞外基质的共性,经过特殊工艺脱掉表皮层,有效地去除了引起免疫排斥反应的细胞表面抗原,植入体内后生物相容性好,为脂肪干细胞提供良好的支架,促进脂肪干细胞增生和分化,促进类软骨细胞的形成。本研究采用小牛 ADM 复合脂肪间充质干细胞(adipose-derived stem cells,ADSCs)进行体外复合培养,观察其修复兔关节软骨缺损的效果。
1 材料和方法
1.1 材料
1.1.1 主要试剂 脂肪组织来源于 6 周龄新西兰大白兔,抽吸部位为腹部,术后无菌保存。I 型胶原酶,胰酶、低糖 DMEM 和 FBS 购自美国Gibco 公司;抗人 CD29、CD44、CD31、CD105、CD34、CD45、CD49d、CD106、HLA-DR 抗体购自美国 BD 公司;II 型胶原小鼠抗兔单克隆抗体购自美国 Abcam 公司;免疫组化 SP 试剂盒购自福州迈新公司。
1.1.2 仪器 CO2细胞培养箱为美国 Shellab 公司产品;往复式真空泵为上海益化真空设备有限公司产品;真空冷冻干燥机为美国 Virtis 公司产品;倒置相差显微镜为日本 Olympus 公司产品;流式细胞仪为美国 BD 公司产品;扫描电镜为日本Hitachi 公司产品。
1.1.3 实验动物 6 周龄新西兰大白兔 24 只,体重(2.0 ± 0.5)kg,雌雄不限,由北京市创伤骨科研究所动物实验中心提供,SPF 级,实验过程中对动物的处置符合动物伦理学要求。
1.2 方法
1.2.1 ADSCs 的分离、培养 无菌条件下取脂肪组织,将脂肪组织在 PBS 中清洗 3 次,彻底去除红细胞与组织碎片。加入预热的 0.1% 的 I 型胶原酶溶液,置 37 ℃ 水浴振荡消化 1 h。300×g 离心 5 min,去除上层脂肪细胞与胶原酶溶液。加入适量含 10% 牛血清白蛋白(BSA)的 DMEM 重悬细胞,经 100 μm 细胞筛过滤,调整合适的细胞密度接种至细胞培养瓶,于 37 ℃、5% CO2培养箱中培养[7]。48 h 后换液,去除未贴壁细胞及残留的红细胞。此后每 3 天换液。当细胞达到 80%融合时,用 0.25% 的胰酶消化贴壁细胞,按 1∶2进行传代,倒置显微镜下观察细胞生长及形态变化特征。
1.2.2 ADSCs 的鉴定和多向诱导分化 将 P1 代ADSCs 经胰酶消化后,调整细胞浓度为 106个/ml,与 FITC 和 PE 标记的抗体冰上避光孵育 30 min,用含 1% BSA的 PBS 重悬细胞,流式细胞术分析其表面特异性抗原 CD29-PE、CD44-FITC、CD31-PE、CD34-PE、CD45-FITC、CD49d-PE、CD106-FITC、CD105-PE 及 HLA-DR-FITC 的表达情况。
1.2.3 小牛 ADM 的制备 选用新生小牛,活杀后,将背部毛发剪短,用取皮刀切取厚度为 1 mm的真皮层,清洗后浸入 0.5 mol/L 的乙酸中浸泡2 h,PBS 清洗后,切成 1 cm×1 cm 的正方形小块。将小牛真皮用 0.1% 十二烷基硫化钠(SDS)在室温中超声 4 h 后用 PBS 溶液洗涤 20 次,流水过夜(10 h)冲洗。低温冻干 24 h 后备用。常规 HE 染色,观察脱细胞效果。浸入 0.5% 胰蛋白酶,37 ℃ 条件下超声 2 h,再用蒸馏水清洗 20 次,0.1% 甲醛浸泡,交联 1 h,流水冲洗 50 h,低温冻干 24 h,扫描电镜观察胶原纤维的排列及空隙大小等物理特征,60Co 照射后备用。
1.2.4 ADSCs与 ADM 复合 将培养的 ADSCs消化后制成细胞悬液浓度,细胞密度调整为 2×107个/ml。向 ADM 材料表面缓慢滴加 1.5 ml 细胞悬浮液至完全覆盖支架,放在 37 ℃、5% CO2培养箱中静置 48 h 备用。
1.2.5 实验分组及方法 选取健康成年新西兰大白兔 24 只,编号后随机分 3 组,饱和硫化钠脱去兔膝关节上下约 5 cm 兔毛;异戊巴比妥钠3 mg/kg 耳缘静脉麻醉。常规消毒、铺无菌巾。沿髌韧带内侧做一长约 5 cm 的切口,进入关节腔后在股骨髁间窝用 4 mm 环钻打孔关节软骨,见创面少许渗血为止。A 组在孔内外科手术缝合植入ADSCs 复合 ADM,B 组在孔内外科手术缝合只植入 ADM,C 组缺损处不作任何处理,无菌盐水冲洗关节腔,仔细分层缝合。术后笼内自由饲养,肌注青霉素 1 周预防感染。
1.2.6 观测指标 ①一般情况:动物模型制备后,观察三组大白兔存活及饮食等情况。②大体观察:于模型制备后 12 周,三组大体观察创面愈合情况。③HE 染色:术后标本经甲醛固定、脱钙、石蜡包埋、沿矢状面垂直于缺损区进行切片,苏木精-伊红染色 5 min,镜下观察。
1.2.7 II 型胶原免疫组化染色 应用 II 型胶原单克隆抗体行免疫组织化学染色,一抗为小鼠抗兔II 型胶原单克隆抗体,二抗为辣根过氧化物酶标记的山羊抗鼠多克隆抗体,采用 3,3-二氨基联苯(DAB)染色。
1.3 统计学处理
2 结果
2.1 ADSCs 形态观察和鉴定
原代分离培养新西兰大白兔 ADSCs,贴壁24 h 后细胞呈圆形状,48 h 后细胞呈现长梭形和多角形,72 h 后细胞数量明显增加,排列密集(图 1)。第 4 代 ADSCs 通过流式细胞仪检测结果显示,脂肪干细胞表型呈 CD44+,CD105+,CD49d+,CD106-,CD31-,CD29+,CD34-,CD45-,HLA-DR-(图 2)。
2.2 支架细胞相容性观察
脱细胞、交联后,HE 染色显示真皮基质中细胞几乎无残留,纤维结构完整(图 3A)。ADSCs接种 48 h 后,大量增殖的细胞呈片层贴附于支架上,细胞形态饱满,表面可见微绒毛和分泌现象(图 3B)。
2.3 大体观察
实验的新西兰大白兔于手术后 12 周处死,支架复合 ADSCs 组缺损处几乎填充完全,修复组织色泽、质地同正常关节软骨,表面光滑,与周围正常软骨组织界限模糊,结合紧密(图 4A)。单纯支架组缺损部分修复表面欠平整,凸凹不平,交界区界限明显(图 4B)。对照组缺损内无软骨修复组织,部分有少量修复,不起填充作用(图 4C)。
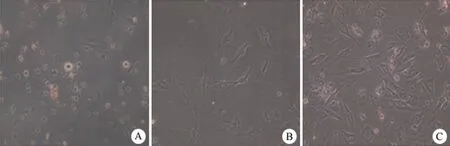
图1 ADSCs 形态学观察(倒置相差显微镜×40)(A:24 h;B:48 h;C:72 h)Figure 1 Morphology observation of the hADSCs (Inverted phase contrast microscope×40) (A:24 h; B:48 h; C:72 h)

图2 ADSCs 表面特异性蛋白检测Figure 2 Phenotype analysis of ADSCs
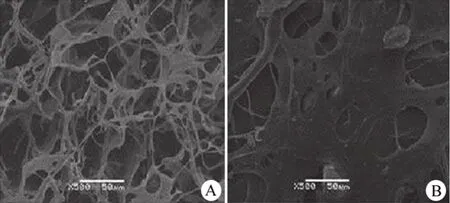
图3 扫描电镜观察 ADSCs 在 ADM 上黏附情况(×500)(A:脱细胞和交联后结构;B:接种细胞后 48 h)Figure 3 Scanning electron microscope observation of cell attachment of ADM (×500) (A:Scaffold after acellular and crosslinked structure; B:ADSCs implanted on the scaffold for 48 hours)
2.4 组织学观察
HE 染色显示,支架复合 ADSCs 组再生组织中支架已被吸收,细胞排列较为规律,在软骨下可见连续的新骨形成,并与再生的软骨整合(图 5A)。单纯支架组再生组织中支架大部分吸收,富含纤维软骨(图 5B)。对照组软骨缺损处因无修复组织或修复组织太少,仅见少量的纤维组织(图 5C)。
2.5 II 型胶原表达变化的免疫组合检测
II 型胶原免疫组化染色检测显示,支架复合ADSCs 组再生组织中支架已被吸收,再生的软骨是阳性(图 6A)。单纯支架组再生组织中支架大部分吸收,再生的软骨是阳性,但不完整(图 6B)。软骨损处因无修复组织,再生软骨表达阴性(图 6C)。

图4 三组术后创面大体观察(A:支架复合 ADSCs 组;B:单纯支架组;C:对照组)Figure 4 General observation of wounds in 3 groups after operation (A:Scaffold combine with ADSCs group; B:Scaffold group; C:Control group)

图5 术后组织学 HE 染色观察(×10)(A:支架复合 ADSCs 组;B:单纯支架组;C:对照组)Figure 5 Histology observation after operation (×10) (A:Scaffold combine with ADSCs group; B:Scaffold group; C:Control group)
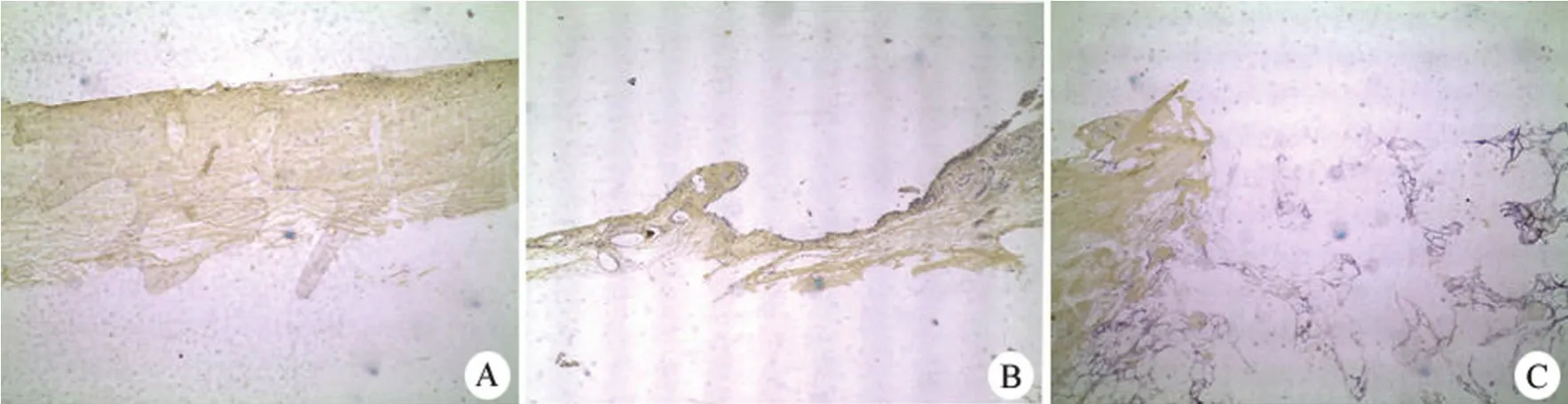
图6 术后 II 型胶原表达的 IHC 观察(×40)(A:支架复合 ADSCs 组;B:单纯支架组;C:对照组)Figure 6 Expression of type II collagen after operation (×40) (A:Scaffold combine with ADSCs group; B:Scaffold group; C:Control group)
3 讨论
关节软骨缺少血液供应,其自身修复能力十分有限。目前软骨损伤的治疗方法虽然在短期内可以缓解患者疼痛,但长期治疗效果都不甚理想。近年来,再生医学和组织工程技术的发展,为软骨损失修复提供了新的思路和技术,并在世界范围内有了初步应用。
诱导成体干细胞向软骨分化,构建组织工程软骨修复是目前组织工程领域的研究热点。其中骨髓间充质干细胞(mesenchymal stem cells,MSCs)是研究较多的成体干细胞。但由于骨髓穿刺给患者带来一定痛苦,而且细胞获得量很小,因此在应用中受到一定的限制[8]。ADSCs 与 MSCs 相比,具有以下优势[9-12]:①ADSCs 在培养时间较长时具有更强的基因稳定特征;②脂肪来源更充足,并且取材方便;③衰老率低、增殖率强。真皮脱细胞基质(ADM)是典型的脱细胞基质支架的一种,有良好的生物相容性,无抗原性,通过对 ADM 支架材料的性状改善及表面修饰可以弥补其性能上的缺陷,使其更适合种子细胞的生长,用于影响细胞分化、增殖、黏附、形态发生和表型表达等生物学过程。
我们在本实验中,首先用酶消化法结合密度梯度离心分离培养 ADSCs,我们发现多次 PBS 的清洗和 0.1% 的 I 胶原酶处理,可以很好地分离脂肪组织的脂肪干细胞,37 ℃ 恒温摇床,间隔 1 h,也能有效分离 ADSCs 且更完全;脂肪组织获取量、培养液成分以及消化传代等因素同样对细胞的分离纯化有影响,但最佳分离培养方法仍需要进一步探讨。同时,Wen 等[13]将 ADSCs 接种到兔软骨缺损处,3个月后发现缺损处充满了透明软骨,并且 II 型胶原高度表达,说明了其能有效修复软骨损伤,为我们将 ADSCs 作为修复兔关节软骨缺损的种子细胞提供理论依据。本研究中我们拟不采用在支架中添加生长因子的技术路线,因为生长因子容易失活以及价格昂贵,在临床实际应用中限制较多。通过修饰交联制备小牛 ADM 作为理想的细胞载体,通过复合 ADSCs 诱导类软骨细胞,初步在动物实验中证实修复关节软骨缺损的有效性。
以上结果证明,脂肪干细胞具有分化为软骨细胞功能性潜能,与小牛ADM 复合可以大大提高修复效率,是一种理想的供体细胞来源,为关节软骨的细胞治疗开辟新的途径。但目前该研究还存在一定局限性,虽然在这项研究中做了一些临床前试验,但兔子不是直立行走的动物,膝关节的结构和人类差异较大。复合载体对比格犬的关节软骨损伤的修复情况需要进一步验证,同时,ADSCs 的进一步分化实验以及分子细胞学研究及其在修复中的调动机制、修复机制也有待阐明。
[1]Bark S,Piontek T,Behrens P,et al.Enhanced microfracture techniques in cartilage knee surgery:Fact or fiction? World J Orthop,2011,5(4):444-449.
[2]Yang SL,Harnish E,Leeuw T,et al.Compound screening platform using human induced pluripotent stem cells to identify small molecules that promote chondrogenesis.Protein Cell,2012,3(12):934-942.
[3]Musumeci G,Castrogiovanni P,Leonardi R,et al.New perspectives for articular cartilage repair treatment through tissue engineering:A contemporary review.World J Orthop,2014,5(2):80-88.
[4]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies.Tissue Eng,2001,7(2):211-228.
[5]Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells.Mol Biol Cell,2002,13(12):4279-4295.
[6]Chen YC,Chen RN,Jhan HJ,et al.Development and characterization of acellular extracellular matrix scaffolds from porcine menisci for use in cartilage tissue engineering.Tissue Eng Part C Methods,2015,21(9):971-986.
[7]Dubois SG,Floyd EZ,Zvonic S,et al.Isolation of human adipose-derived stem cells from biopsies and liposuction specimens.Methods Mol Biol,2008,449:69-79.
[8]Zorzi AR,Amstalden EM,Plepis AM,et al.Effect of human adipose tissue mesenchymal stem cells on the regeneration of ovine articular cartilage.Int J Mol Sci,2015,16(11):26813-26831.
[9]Pak J,Lee JH,Kartolo WA,et al.Cartilage regeneration in human with adipose tissue-derived stem cells:current status in clinical implications.Biomed Res Int,2016,2016:4702674.
[10]Kon E,Filardo G,Roffi A,et al.New trends for knee cartilage regeneration:from cell-free scaffolds to mesenchymal stem cells.Curr Rev Musculoskelet Med,2012,5(3):236-243.
[11]Mardani M,Hashemibeni B,Ansar MM,et al.Comparison between chondrogenic markers of differentiated chondrocytes from adipose derived stem cells and articular chondrocytes in vitro.Iran J Basic Med Sci,2013,16(6):763-773.
[12]Cucchiarini M,Henrionnet C,Mainard D,et al.New trends in articular cartilage repair.J Exp Orthop,2015,2(1):1-8.
[13]Wen W,Na H,Feng C,et al.Human adipose-derived mesenchymal progenitor cells engraft into rabbit articular cartilage.Int J Mol Sci,2015,16(6):12076-12091.
Effect of adipose-derived stem cells combine with acellular dermal matrix in repair of rabbit articular cartilage defects
SHU Xiong,ZHENG Rui,JIE Yong-sheng,CHEN Lei,JIN Shao-feng,QI Hui,SUN Lei
ObjectiveTo evaluate the healing behavior of rabbits articular cartilage defects repaired with tissue engineered cartilage constructed by the calf acellular dermal matrix (ADM) seeded with rabbit adipose derived stem cells (ADSCs).MethodsRabbit ADSCs were isolated by enzyme,cultured and expanded from subcutaneous adipose tissue.FACS and multi-lineage differentiation were used to characterize the cultured stem cells.Calf epidermis was prepared by decelluarizing,cross-linking and lyophilizing to calf ADM which reached a certain number and then seeded in ADM to obtain cell scaffold complexes.24 New Zealand white rabbits were divided into A,B and C groups randomly.Then engineered cartilage was surgically sutured cartilage defect position of rabbits in the group A.ADM was surgically sutured for the group B and nothing for the group C.The rabbits were killed in the 12th week.Restored tissues were evaluated using naked eyes,histology.ResultsRabbit ADSCs were isolated and identified successfully.After modification,the surface of ADM was smooth with uniform pores.In the group A,articular cartilage defects of the rabbits were filled with chondrocyte-like tissue in which cells were positive of HE staining and type II-collagen either in expression.In the group B,the defect was filled with the fibrous tissue.No tissue was found in the group C.ConclusionThe new calf ADM scaffolds possesses a good biocompatibility with rabbit ADSCs.The complex of ADSCs and ADM after cartilage induction can be used to repair articular cartilage defects,which has the potential to substitute for the normal cartilage.
Adipose-derived stem cells; Acellular dermal matrix; Scaffolds; Articular cartilage; Tissue engineering
s:SUN Lei,Email:dr_sunlei@263.net; QI Hui,Email:kellyqhqh2002@163.com
首都卫生发展科研专项(首发 2011-1006-01);北京市科技新星计划(H013610310113)
100035 北京市创伤骨科研究所/北京积水潭医院
孙磊,Email:dr_sunlei@263.net;綦惠,Email:kellyqhqh2002@ 163.com
2016-12-28
10.3969/j.issn.1673-713X.2017.02.008
方法取自体新西兰兔的脂肪组织,采用酶消化分离培养ADSCs 并传代,倒置相差显微镜观察细胞形态,FACS 检测细胞表面特异性表达以鉴定细胞,行成脂和成骨诱导鉴定。小牛真皮通过脱细胞、交联和冻干制备小牛 ADM,ADSCs 达到一定数量后接种于 ADM 得到细胞支架复合物。24 只新西兰大白兔随机分 A、B、C 共三组,A 组关节软骨缺损处外科缝合细胞支架复合物,B 组软骨缺损处外科缝合 ADM,C 组软骨缺损不做任何处理。分别于术后第 12 周处死动物,修复处行大体、组织学检测。
结果成功分离鉴定新西兰兔的脂肪干细胞。经重塑后真皮脱细胞基质支架材料表面光滑、孔隙均匀。ADSCs 与 ADM复合后,缺损处类软骨组织填充,修复区表面光滑;II 型胶原免疫组化显示,复合支架已被吸收,再生的软骨是阳性。
结论新型小牛 ADM 支架材料与 ADSCs 生物相容性好,ADSCs 与 ADM 复合向软骨诱导后可良好地修复关节软骨缺损,具有替代正常软骨的潜力。
Author Affiliation:Beijing Institute of Traumatology and Orthopaedics,Beijing 100035,China

