西葫芦ISSR-PCR反应体系优化及引物筛选
郭秀霞,李灵芝,马太光,雷逢进,张瑞腾,李海平
(1.山西农业大学园艺学院,山西太谷030801;2.山西省农业科学院棉花研究所,山西运城044000)
西葫芦ISSR-PCR反应体系优化及引物筛选
郭秀霞1,李灵芝1,马太光1,雷逢进2,张瑞腾1,李海平1
(1.山西农业大学园艺学院,山西太谷030801;2.山西省农业科学院棉花研究所,山西运城044000)
为了确定西葫芦ISSR-PCR的最佳反应体系,以西葫芦基因组DNA为模板,采用正交试验方法,对模板DNA、引物及2×Taq PCR Master Mix的用量进行了优化,并通过梯度PCR确定不同引物的最佳退火温度。结果表明,最佳反应体系为:在20 μL的体系中,模板DNA(50 ng/μL)1 L,引物(10 μmol/L)3 L,Master Mix 10 μL;利用该体系从50条ISSR引物中筛选出18条扩增条带清晰、多态性好的引物。这一体系的建立及引物筛选为以后利用ISSR分子标记技术对西葫芦进行研究提供了科学依据。
西葫芦;ISSR-PCR;正交设计;引物筛选
西葫芦(Cucurbita pepo L.)又名美洲南瓜,是葫芦科南瓜属中的一个栽培种[1],为1年生草本植物[2]。西葫芦生长迅速、适应性强、结瓜早,经济效益高[3],随着种植面积的扩大,西葫芦已成为我国广泛栽培的重要蔬菜之一。为了适应生产的需要,要培育高品质、多抗、专用的西葫芦新品种,就需要充分利用优质的种质资源。
近年来,DNA分子技术已被广泛用于植物育种,涉及植物品种鉴定、基因定位、遗传多样性等方面。目前,国内外用于西葫芦遗传关系分析的分子标记主要有SSR和RAPD,采用的分子标记比较单一。ISSR标记技术(inter-simple sequence repeat,简单重复序列区间标记技术)是1994年加拿大蒙特利尔大学的ZIETKIEWICZ等[4]提出的,是在SSR分子标记技术的基础上创建的,该技术快速简便,成本较低,有较好的稳定性和多态性,能有效地对种质资源进行遗传多样性的分析,在苦瓜、南瓜、丝瓜、甜瓜方面都有报道[5-11]。虽然ISSR技术较简单,但它的反应结果容易受模板、引物等因素的影响,因此,需要对反应体系进行优化。ISSR引物虽然具有通用性,但是不同的植物适用的引物也不同,同一引物在不同植物PCR时,退火温度也不同[12],比如引物827在芦笋、稗属植物、暴马丁香中的最佳退火温度分别分47.0,51.7,48.2℃[12-14]。因此,必须筛选引物的最佳退火温度。
本研究采用正交试验设计方法对影响ISSR反应的模板、引物及Master Mix和退火温度进行了优化,旨在为进一步利用ISSR分子标记进行西葫芦种质资源遗传多样性、种质资源鉴定等研究提供理论依据。
1 材料和方法
1.1 试验材料
试验所用的DNA Marker DL2000,2×Taq PCR Master Mix购自中科瑞泰生物技术有限公司;引物是根据哥伦比亚大学公布的引物序列以及卢亚楠[15]、司旻星[16]、钟开勤[17]等研究中所用的ISSR引物所设计的,共50条,由上海生工生物工程技术服务有限公司合成。
1.2 试验方法
1.2.1 DNA提取 采用改良的CTAB法提取西葫芦幼嫩叶片基因组DNA。采用NANODROP2000c核酸蛋白仪测定DNA的浓度和纯度,并用1%琼脂糖凝胶电泳检测DNA的完整性,-20℃保存以备后期使用。
1.2.2 ISSR-PCR反应体系优化 用L16(43)正交试验设计方法,在20 μL的反应体系中,对影响ISSRPCR试验的模板DNA、引物和Master Mix 3个因素(每个因素设置4个水平)进行筛选(表1),共16个处理(表2)。试验所用的模板DNA质量浓度均稀释为50 ng/μL,引物浓度均为10 μmol/L。

表1 西葫芦ISSR-PCR反应的因素和水平
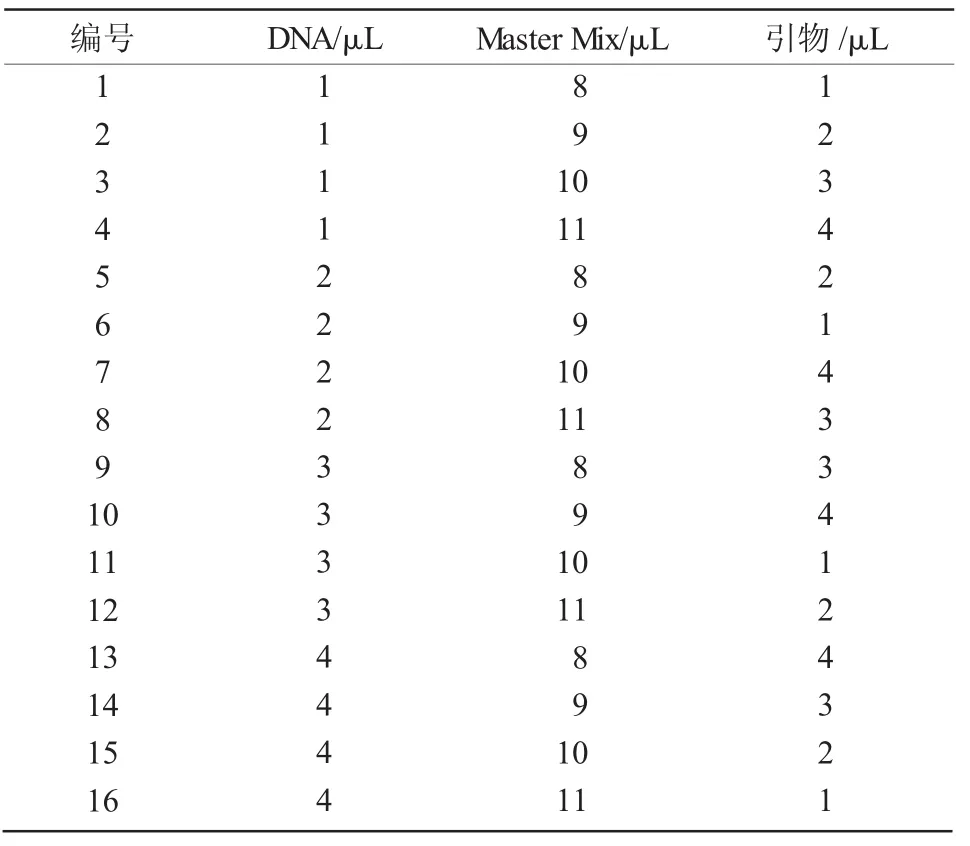
表2 ISSR-PCR反应正交试验设计L16(43)
扩增反应程序为:94℃预变性2 min;94℃变性45 s,退火1 min,72℃延伸90 s,35个循环;最后72℃延伸10 min;4℃保存[15]。反应结束后,PCR产物用1.5%琼脂糖凝胶电泳分离,并用凝胶成像仪观察并拍照。
1.2.3 引物筛选 随机抽取5个品种的DNA为试材,在试验确定的最佳反应体系基础上,从试验初步筛选的50条引物中选出能扩增出多个清晰条带的引物。
1.2.4 最佳退火温度筛选 以其中1个品种为样本,每个引物的退火温度设置为理论退火温度上下5℃范围,采用PCR仪自动生成8个温度,PCR扩增反应结束后,采用1.5%琼脂糖凝胶电泳对筛选出的引物在不同退火温度下的扩增效果进行检验,以筛选出最佳退火温度。
2 结果与分析
2.1 DNA质量检测
用核酸蛋白仪对提取的西葫芦DNA进行了检测,结果显示,所提取的DNA OD260/OD280在1.90左右,纯度较高。从图1可以看出,所提取的DNA主带清晰,排列整齐,能够满足ISSR分析的要求。

2.2 ISSR-PCR反应体系的正交试验结果分析
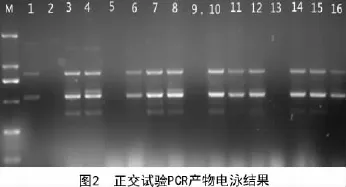
从图2可以看出,16个处理的扩增效果具有一定的差异性,除处理2,5,9,13外,其他处理都有条带,处理3,4,7,8,10扩增的条带多态性均丰富,通过后期的进一步验证,认为处理3的稳定性最佳。因此,确定处理3为西葫芦ISSR-PCR的最佳反应体系。
2.3 不同引物退火温度的确定及其筛选
各引物的退火温度不一定等于它的Tm值,而是在其附近波动,也有可能偏离严重[10]。采用PCR仪自动生成的8个温度梯度对初选的50条引物进行退火温度优化,根据不同退火温度下的扩增效果确定各引物的最佳退火温度。
从图3可以看出,第3,12,21泳道的扩增条带数多且清晰,因此,引物807,810,812的最佳退火温度分别为48.9,50.9,53.2℃。18条引物的最佳退火温度结果列于表3。
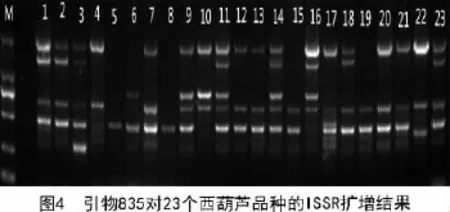
从表3可以看出,不同引物的最佳退火温度差别较大,为了验证所选出来的18条引物的有效性和体系的可行性,用这18个引物对23个不同的西葫芦品种进行了PCR扩增,结果显示,这些引物扩增出的条带清晰可见,说明该体系以及筛选出的引物可以用于研究西葫芦的遗传多样性(图4)。
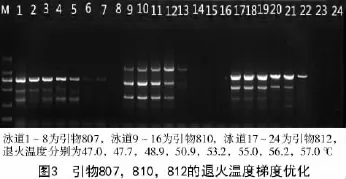

表3 筛选出的有效ISSR引物及其退火温度
3 结论与讨论
ISSR以PCR反应为基础,其反应结果容易受模板、引物、dNTPs和Taq DNA聚合酶、Mg2+等因素的影响。其中,引物的浓度尤为重要,若浓度太高,会产生非特异性扩增和大量引物二聚体,还会使碱基发生错配;若浓度太低,扩增产物量少且稳定性差。模板DNA的浓度对PCR反应的影响不是很大,只要保证其质量就可以了。本试验采用了Master Mix,它包含了dNTPs,Taq DNA聚合酶和Mg2+,稳定性好、灵敏度高、多态性好,不仅避免了污染,还大大节省了时间,并且便于分析[18]。正交试验结果表明,在西葫芦ISSR-PCR 20 μL体系中,3个因素的最佳水平为:模板DNA(50 ng/μL)1 μL,引物(10 μmol/L)3 μL,Master Mix 10 μL。
ISSR的引物具有通用性,但如果植物不同,适用的ISSR引物也不同;同一个引物应用到不同的植物,其退火温度也会不同。刘威生等[19]研究认为,退火温度对ISSR-PCR反应的结果影响较大,若温度太高,会影响引物与模板的结合;若温度太低,会降低特异性。最佳的退火温度与理论值可能相差5℃左右,也有可能相差很大[20]。本试验对所筛选的引物进行了最佳退火温度的筛选,且它与其Tm值之间没有规律性,没有严重的偏离,可对今后西葫芦ISSR分子标记的研究提供帮助。
本试验利用最佳扩增体系从50条ISSR引物中筛选出18条扩增条带清晰、多态性好的引物,并对目的基因组DNA进行扩增,表现出较丰富的多态性,说明西葫芦保留了丰富的遗传多样性,对西葫芦育种具有重要的意义。
[1]吴会昌.我国西葫芦育种现状、问题及对策[J].北方园艺,2006(2):48-49.
[2]白玉.DNA分子标记技术及其应用 [J].安徽农业科学,2007,35(24):7422-7424.
[3]李素珍,许晶,车星星.西葫芦新品系比较试验[J].山西农业科学,2017,45(1):13-16.
[4]周延清.DNA分子标记技术在植物研究中的应用 [M].北京:化学工业出版社,2005:1,143.
[5]高山,林碧英,许端祥,等.苦瓜种质遗传多样性的RAPD和ISSR分析[J].植物遗传资源学报,2010,11(1):78-83.
[6]陈禅友,兰红,李亚木,等.苦瓜种质资源ISSR遗传多态性分析[J].长江蔬菜(学术版),2012(12):19-22.
[7]杨正安,孟平红,代贤,等.云南黑籽南瓜种质遗传多样性的RAPD和 ISSR分析 [J].植物遗传资源学报,2011,12(6):860-864.
[8]龙荣华.云南地方南瓜资源遗传多样性及亲缘关系分析[D].北京:中国农业科学院,2011.
[9]陈朝文.丝瓜种质资源遗传多样性的ISSR分析[D].福州:福建农林大学,2009.
[10]任光云,谭亮,李炳.丝瓜ISSR-PCR反应体系的建立[J].山西农业科学,2008,36(1):68-69.
[11]刘万勃.RAPD和ISSR标记对甜瓜种质遗传多样性及杂种鉴定的研究[D].重庆:西南农业大学,2002.
[12]齐仙惠,李改珍,巫东堂.芦笋ISSR引物筛选及遗传多样性分析[J].山西农业大学学报(自然科学版),2014,34(3):249-251.
[13]刘德好,陆永良,娄玉霞.正交试验优化稗属植物ISSR-PCR反应体系[J].上海农业学报,2016,32(4):17-21.
[14]杨晓霞,郑健,冷平生.暴马丁香ISSR-PCR反应体系优化及引物筛选[J].分子植物育种,2014,12(5):1018-1026.
[15]卢亚楠.利用RAPD、SSR及ISSR鉴定西葫芦种质资源亲缘关系的研究[D].雅安:四川农业大学,2009.
[16]司旻星.黄瓜种质资源遗传多样性及亲缘关系分析[D].上海:上海交通大学,2006.
[17]钟开勤.瓠瓜种质资源的RAPD和ISSR分析[D].福州:福建农林大学,2007.
[18]赵建涛,尹延旭,常培培,等.番茄SSR-PCR反应体系的优化[J].黑龙江农业科学,2014(12):15-18.
[19]刘威生,冯晨静,杨建民,等.杏ISSR反应体系的优化和指纹图谱的构建[J].果树学报,2005,22(6):30-33.
[20]刘红艳,杨东,张繁荣,等.鱇浪白鱼ISSR-PCR最佳退火温度的筛选[J].北方园艺,2011(16):164-166.
Optimization of ISSR-PCR Reaction System and Selection of Primers in Cucurbita pepo
GUOXiuxia1,LI Lingzhi1,MATaiguang1,LEI Fengjin2,ZHANGRuiteng1,LI Haiping1
(1.College ofHorticulture,Shanxi Agricultural University,Taigu 030801,China;2.Institute ofCotton,Shanxi Academy ofAgricultural Sciences,Yuncheng 044000,China)
To determine the best ISSR-PCR reaction system for Cucurbita pepo,experiment with Cucurbita pepo genome DNA as the template,the concentrations of template DNA,primers and 2×Taq PCR Master Mix were optimized by an orthogonal experimental method.The optimal anneal temperature of different primers was determined by gradient PCR.The results showed that the best reaction system was as follows:template DNA(50 ng/μL)1 L,primers(10 μmol/L)3 L,Master Mix 10 μL.Using this system,18 primers with clear and multiple polymorphic bands were selected from 50 primers.The establishment of this system and polymorphism primers could provide a scientific basis for related research using ISSR molecular marker technology in Cucurbita pepo in the future.
Cucurbita pepo L.;ISSR-PCR;orthogonal design;selection ofprimer
S642.6
A
1002-2481(2017)03-0325-04
10.3969/j.issn.1002-2481.2017.03.02
2016-10-19
国家农业科技成果转化资金项目(2014GB2A300017);山西省科技攻关项目(201303110084);山西省回国留学人员科研资助项目(2011050);山西农业大学引进人才博士科研启动基金项目(2013YJ23)
郭秀霞(1990-),女,山西孝义人,在读硕士,研究方向:蔬菜栽培与生理。李灵芝为通信作者。

