HS-SPME结合GC-O-MS技术分析不同大曲中的香气活性化合物
孟维一,黄明泉,孙宝国,郑福平,孙金沅,孙啸涛,李贺贺
(1.北京市食品风味化学重点实验室,北京工商大学,北京 100048;2.食品质量与安全北京实验室,北京工商大学,北京 100048)
HS-SPME结合GC-O-MS技术分析不同大曲中的香气活性化合物
孟维一,黄明泉*,孙宝国,郑福平,孙金沅,孙啸涛,李贺贺
(1.北京市食品风味化学重点实验室,北京工商大学,北京 100048;2.食品质量与安全北京实验室,北京工商大学,北京 100048)
通过顶空-固相微萃取(HS-SPME)结合气相色谱-嗅闻-质谱(GC-O-MS)联用技术,研究了大曲的香气成分,同时考察了萃取头、萃取时间、萃取温度和样品量对大曲样品中挥发性成分分析的影响。结果表明:取1.5 g样品在50 ℃下平衡10 min后,用50/30 μm DVB/CAR/PDMS纤维萃取头在50 ℃下萃取30 min,萃取效果较好;在此条件下分析大曲样品,7种大曲中共检出69种挥发性成分,包括醇类9种、酯类13种、醛类8种、酮类4种、酸类3种、吡嗪类9种、芳香族类8种、酚类5种、杂环类2种、烷烃类3种和其他类5种;采用GC-O-MS检出17种为香气活性化合物,定性出14种化合物,其中2-乙基-3,5-二甲基吡嗪、苯乙醛是OAV值较大且香气强度较大的香气活性化合物,贡献了烤土豆香、蜂蜜香、甜香,综合组成了大曲独特的风味。
大曲,顶空-固相微萃取,气相色谱-嗅闻-质谱,风味活性化合物,香气活性值
大曲是以小麦为主要原料制成的形状较大的、且含有多种菌类和酶类物质的曲块[1]。大曲自古就有“酒之骨”之称,是大曲酒酿造生产中的重要物质,是酿酒生产的糖化、发酵、酒化和生香剂,含有多种微生物及其酶,其品质对大曲酒的出酒率和酒质都有极大的影响[2]。目前,对大曲的研究主要集中于其微生物功能和多样性及曲中的酶[3-4],同时实际生产中对大曲的质量多从糖化力、发酵力、液化力、酯化力、淀粉含量等方面进行考察和控制[5],对大曲风味关注较少。另外,对大曲挥发性成分的研究中,张春林等[6]对泸州老窖浓香型大曲的研究表明,其挥发性风味物质中含量较高的是醇类、酯类和酮类化合物,另外还含有一些吡嗪类化合物。并且张春林等[7]对其香气活性成分进行了分析,发现己醛、苯乙醛,4-乙基愈创木酚和一种未知物对大曲风味贡献大,可为浓香型白酒香味成分的来源提供参考依据。这表明,大曲的风味对酒的品质也有重要的影响,因此对大曲风味的研究具有重要意义。
目前,挥发性成分常用的前处理方法有溶剂辅蒸馏萃取法(SAFE)、液液萃取法(LLE)、同时蒸馏萃取法(SDE)和顶空-固相微萃取法(HS-SPME)。HS-SPME无需溶剂,集采样、萃取、进样于一体,灵敏度高,选择性好,能方便快捷地分离鉴定食品中的风味物质[8-13]。气相色谱-嗅闻检测技术(GC-O)以人的鼻子作为检测器,能有效地在众多挥发性化合物中找到真正对食品风味有贡献的活性化合物,因此,近年来被广泛应用于食品研究中[14-20]。例如,郑杨等[19]利用GC-O技术分析了芝麻香型白酒中的关键香气化合物,发现3-甲硫基丙醛、二甲基三硫醚、3-甲基丁醛等对芝麻香白酒风味有重要的贡献。香气活性值(Odor activity value,OAV)是评价香气化合物重要性的一个指标,是物质的浓度与香气阈值之比,能更好的衡量一个香气物质对大曲的香气贡献大小。化合物的OAV值大于或者等于1 则对样品香气组成有贡献,OAV值越大,该香气化合物贡献越大[21]。因此,可以通过对风味活性物质OAV值的比较,来分析各风味活性物质对大曲整体风味的贡献大小。
本文以两个芝麻香白酒厂家的7种大曲样品为原料,通过顶空-固相微萃取和气相色谱-嗅闻-质谱检测联用技术对其挥发性成分进行定性和半定量分析,采用频率法和强度法鉴定了大曲的风味活性物质,结合香气活性值(OAV)确定了其中的关键香气活性成分,本文的研究可为建立芝麻香白酒大曲的质量控制标准提供参考数据。
1 材料与方法
1.1 材料与仪器
1号厂家大曲(6月曲B1、7月曲B2、8月曲B3) 山东扳倒井股份有限公司;2号厂家大曲(低温曲J1、中温曲J2、高温曲J3、酱香曲J4) 山东景芝酒业股份有限公司;2-辛醇标样(色谱纯,纯度>98.0%) 梯希爱(上海)化成工业发展有限公司;氯化钠(分析纯) 国药集团化学试剂有限公司。
7890B-5977A气相色谱-质谱联用仪 美国Agilent公司;ODP3嗅闻仪 德国Gerstel公司;DB-WAX(60 m×0.250 mm×0.25 μm)毛细管柱 美国Agilent公司;SPME手动进样手柄及50/30 μm DVB/CAR/PDMS,65 μm PDMS/DVB,75 μm CAR/PDMS固相微萃取头 美国SUPELCO公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司。
1.2 实验方法
1.2.1 样品前处理 将采集到的冷冻储存的大曲块粉碎后过40目筛,在密封冷藏保存,待萃取分析。
1.2.2 顶空固相微萃取 称取一定量大曲样品于20 mL顶空瓶中,加入5 mL饱和NaCl溶液和50 μL内标(0.50 μg/mL 2-辛醇,溶剂:无水乙醇),盖上瓶盖。在一定温度下平衡10 min,将老化后的萃取头插入样品瓶中,顶空吸附一定时间,然后250 ℃解析5 min后,进行GC-MS分析。为防止样品间相互污染,每次样品萃取前,纤维萃取头都在250 ℃老化20 min。
1.2.3 萃取头对萃取效果的影响 称取0.5 g大曲样品于20 mL顶空瓶中,加入5 mL饱和NaCl溶液和50 μL内标(0.50 μg/mL 2-辛醇,溶剂:无水乙醇),盖上瓶盖。在40 ℃下平衡10 min,将老化后的50/30 μm DVB/CAR/PDMS、65 μm PDMS/DVB、75 μm CAR/PDMS萃取头插入样品瓶中,顶空吸附30 min,然后250 ℃解析5 min后,进行GC-MS分析。
1.2.4 萃取时间对萃取效果的影响 称取0.5 g大曲样品于20 mL顶空瓶中,加入5 mL饱和NaCl溶液和50 μL内标(0.50 μg/mL 2-辛醇,溶剂:无水乙醇),盖上瓶盖。在40 ℃下平衡10 min,将老化后的50/30 μm DVB/CAR/PDMS萃取头插入样品瓶中,顶空吸附10、20、30、40、50 min,然后250 ℃解析5 min后,进行GC-MS分析。
1.2.5 萃取温度对萃取效果的影响 称取0.5 g大曲样品于20 mL顶空瓶中,加入5 mL饱和NaCl溶液和50 μL内标(0.50 μg/mL 2-辛醇,溶剂:无水乙醇),盖上瓶盖。在30、40、50、60 ℃下平衡10 min,将老化后的50/30 μm DVB/CAR/PDMS萃取头插入样品瓶中,顶空吸附30 min,然后250 ℃解析5 min后,进行GC-MS分析。
1.2.6 样品量对萃取效果的影响 称取0.5、1.0、1.5、2.0 g大曲样品于20 mL顶空瓶中,加入5 mL饱和NaCl溶液和50 μL内标(0.50 μg/mL 2-辛醇,溶剂:无水乙醇),盖上瓶盖。在50 ℃下平衡10 min,将老化后的50/30 μm DVB/CAR/PDMS萃取头插入样品瓶中,顶空吸附30 min,然后250 ℃解析5 min后,进行GC-MS分析。
1.2.7 GC-MS分析 GC条件:DB-WAX型毛细管柱(60 m×0.25 mm,0.25 μm);升温程序:40 ℃保持3 min,以3 ℃/min升至150 ℃,保持2 min,以7 ℃/min升至230 ℃,保持5 min;载气(He)流速1.0 mL/min,进样口温度250 ℃;不分流进样。
MS条件:电子轰击离子源;电子能量70 eV;传输线温度250 ℃;离子源温度230 ℃;四极杆温度150 ℃;扫描模式为全扫描,质量扫描范围m/z 30~550。
1.2.8 GC-O-MS分析 GC-O-MS是由气相色谱-质谱联用仪(7890B-5977A)和嗅闻仪(ODP3)装置组成。样品经进样口解析5 min后,经GC分离后分别进入质谱检测器和嗅闻检测器,分流比为1∶1,嗅闻口温度210 ℃,检测时为了防止实验员鼻腔干燥通入湿润的空气。GC-O实验由三个感官评价员完成,每名评价人员对每个样品至少嗅闻3次。感官评价人员在嗅闻过程中描述香气化合物的气味特征及强度(1=微弱的,可识别的味道;2=清晰,但不强烈的味道;3=强烈的味道;4=非常强烈的味道),只有被两名以上的评价人员嗅闻到的化合物才能被确定为风味活性物质。
1.2.9 定性定量分析
1.2.9.1 定性分析 以NIST11谱库检索结合标准品比对(保留时间定性)及保留指数定性对检测结果进行分析。标准品比对即在相同的色谱条件下,比较待测物与标准品的保留时间是否一致来判断是否为同一个化合物。化合物的保留指数(Retention Index,RI)通过正构烷烃(C6~C30)计算得到,与文献中报道(查阅NIST11谱库检索RI数据库)的RI值相比较,RI按以下公式计算:
式中:RI值为样品a的保留指数值;ta为样品a保留时间(min)(在正构烷烃Cn和Cn+1之间);tn为正构烷烃Cn保留时间(min);tn+1为正构烷烃Cn+1保留时间(min)。
1.2.9.2 定量分析 通过内标(2-辛醇)对大曲中挥发性物质进行了半定量分析,即在大曲样品进行固相微萃取时加入2-辛醇,根据添加的2-辛醇的量、挥发性化合物的色谱峰面积及2-辛醇的色谱峰面积,计算出每一种挥发性化合物相对于2-辛醇的含量,相对响应因子假定为1。
1.3 数据分析
采用SPSS Statistics 17.0软件进行相应数据处理和分析。
2 结果与分析
2.1 不同萃取头对萃取效果的影响
不同萃取头对萃取效果的影响如图1所示。从图1可知,50/30 μm DVB/CAR/PDMS萃取头萃取的挥发性成分总峰面积最大,峰个数也是最多,是较优的萃取头,这和文献[22]报道一致。
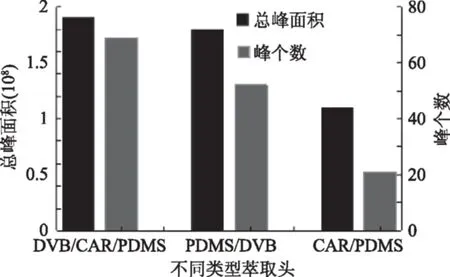
图1 萃取头对萃取效果的影响Fig.1 Effect of fiber type on volatile extraction
2.2 不同萃取时间对萃取效果的影响
不同萃取时间对萃取效果的影响如图2所示。由图2可知,随着萃取时间延长,即从10 min增加到30 min时,萃取物总峰面积和峰个数逐渐增加;但当萃取时间继续延长时,总峰面积稍有增加,但不明显,吸附和解析趋于平衡。因此,综合考虑实验效率,选取萃取时间30 min为较优的萃取时间。

图2 萃取时间对萃取效果的影响Fig.2 Effect of time on volatile extraction
2.3 不同萃取温度对萃取效果的影响
不同萃取温度对萃取效果的影响如图3所示。由图3可知,随着温度的升高,总峰面积和峰个数逐渐增加,在50 ℃时达到最大;但是当温度继续升高到60 ℃时,萃取效果反而变差,总峰面积较50 ℃减少,峰个数不变。这是因为对于顶空固相微萃取而言,温度升高,有机成分的挥发性增强,顶空气相浓度增加,有利于吸附,但当温度太高时,吸附在萃取头上的挥发性成分解析速度也大大加快了,导致其吸附能力下降。因此,选取50 ℃为较优的萃取温度。

图3 萃取温度对萃取效果的影响Fig.3 Effect of temperature on volatile extraction
2.4 不同样品量对萃取效果的影响
不同样品量对萃取结果的影响如图4所示。由图4可知随样品量的增加,萃取物总峰面积和峰个数也随之增加,在样品量1.5 g时达到最大,而继续加大样品量,萃取效果变差,总峰面积减少,峰个数只有微弱增加。因为萃取头吸附挥发性成分是有限度的,大曲样品量增加,顶空气相挥发性成分浓度也增加,在相同的萃取时间内,纤维萃取头很快达到吸附饱和,此时解析速度加快,在剩下的萃取时间内,解析速度会高于吸附速度,导致纤维萃取头吸附量下降。因此,综合考虑,选取样品量为1.5 g。
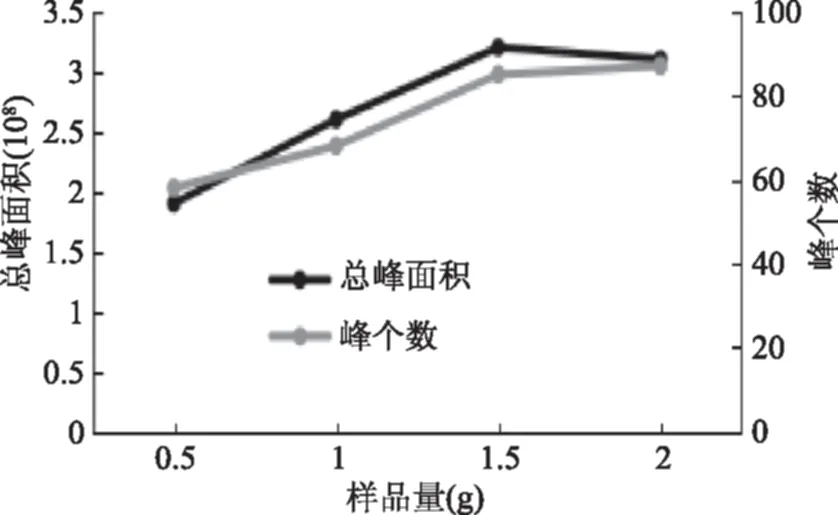
图4 样品量对萃取效果的影响Fig.4 Effect of sample weight on volatile extraction
综上所述,固相微萃取较优的萃取条件为:样品1.5 g,萃取头类型 50/30 μm DVB/CAR/PDMS,萃取温度50 ℃,萃取时间30 min。
2.5 GC-MS分析大曲中挥发性化合物
利用优化好的顶空固相微萃取条件对大曲样品进行萃取,然后进行GC-MS分析,分析结果如表1所示。

表1 不同厂家七种大曲挥发成分HS-SPME-GC-MS分析结果

续表
注:RIL:文献中化合物的保留指数;n.a.:谱库中未查到该化合物的保留指数;MS:使用NIST11检索定性,匹配度大于 85%;RI:保留指数定性;S:标准品比对定性;-:未检出;表2同。
由表1分析结果可知,采用HS-SPME-GC-MS分析了7种大曲样品,共检出69种挥发性化合物;在大曲样品B1中化合物的数量最多,共检出50个,而B3样品中化合物的数量最少,只检出38个,其余的5种大曲样品化合物的检出数量相当;挥发性成分可分为醇类(9种)、酯类(13种)、醛类(8种)、酮类(4种)、酸类(3种)、吡嗪类(9种)、芳香族类(8种)、酚类(5种)、杂环类(2种)、烷烃类(3种)和其他类(5种)。
在检测到的挥发性化合物中,酯类化合物的数量最多。7种大曲样品中酯类化合物的含量介于1.34~280.86 ng/g,其中J1和J2大曲样品中的酯类化合物最多,并且这两种大曲样品的酯类化合物与其他大曲样品相比,其相对含量也最大,分别达35.7%、23.9%。可见,对于2号厂家的四种大曲,低温曲和中温曲中的酯类化合物较多,而高温曲和酱香曲中相对较少。棕榈酸甲酯在7种大曲样品中都有检出,且含量都相对较高。十四酸甲酯除了J4样品外,在其他样品中都有检出。同时,己酸甲酯在检测到的大曲样品中含量均较高。酯类成分主要是在大曲的培菌发酵和贮存期间,由酵母菌和其它微生物利用醇类物质和羧酸类物质合成的[23]。这些化合物绝大多数同样在白酒中也被检测出,这些物质可能对白酒的风味有一定影响[24-25]。
在检测到的挥发性化合物中,醇类和吡嗪类化合物的数量也居于第二位。7种大曲样品中B1大曲样品中的醇类化合物最多,同时1号厂家大曲样品中的醇类物质多于2号厂家。1-辛烯-3-醇、2,3-丁二醇这两种化合物在7种大曲中均有检出,1-辛醇也在绝大多数大曲样品中都有检出。2,3-丁二醇在7种大曲中的含量较其他醇类物质相对较高。对于同一厂家的不同类别曲,其醇类物质数量基本接近,差别不大。一般来说,醇类物质的产生主要是由于大曲发酵期间有氧条件下的糖类物质的降解或者微氧条件下的氨基酸降解产生。由于大曲原料富含丰富的氨基酸类物质,酵母能够利用氨基酸通过代谢途径合成醇类物质[23];另外,酵母降解醛类物质也能生成醇类物质[23]。对于吡嗪类化合物,7种大曲样品中,B1、B2样品的吡嗪类化合物最多,其中B1样品相对其他6种曲样中吡嗪类化合物的含量也最大,同时1号厂家样品的吡嗪类化合物个数多于2号厂家,并且2号厂家的中温曲吡嗪类化合物数量最少。2,6-二甲基吡嗪、3-甲基吡嗪、2,3,5,6-四甲基吡嗪这三种化合物在7种大曲样品中均有检出,并且3-甲基吡嗪、2,3,5,6-四甲基吡嗪这两种化合物在7种大曲中含量均较大。吡嗪类化合物的来源可能是大曲生产过程中发生美拉德反应形成,由于大曲在培菌发酵期间温度会达到50 ℃以上,这样高的温度有利于美拉德反应的进行,促使大量含氮类化合物生成[23]。
芳香族类和醛类化合物在被检测的大曲中数量也较大。对于7种大曲样品中芳香族类化合物,其含量介于1.22 ng/g到324.34 ng/g之间,其中苯乙醇含量在7种大曲样品中较其他芳香类物质含量是最高的,该化合物可由酿酒酵母大量合成[26]。同时苯甲醇、苯乙醇、苯甲醛、苯乙醛和2,4-二叔丁基苯酚这五种芳香族化合物在7种大曲中均被检测出。此外,苯甲酸甲酯、苯乙酸甲酯、苯乙酸乙酯在大多数大曲中均被检出。其次是苯甲醛含量也较高。个别芳香族化合物如愈创木酚和4-乙基愈创木酚仅在J1样品中检出,2-羟基-6-甲基苯甲醛仅在J2样品中检出,但其含量较大。对于醛类物质,J4样品中检测到的醛类物质最多,同时2号厂家大曲样品的醛类物质较多。己醛、壬醛、反-2-辛烯醛这3种醛在7种大曲样品中均有检出,并且在7种大曲样品这3种醛的含量也较大。大曲中醛类物质的产生可由微生物降解大曲原料中的淀粉类物质,在糖酵解过程中产生,特别可能是在酵母的作用下产生[27]。
在大曲样品中,还检测出茴香脑、草蒿脑这两种化合物。在J2、J3和J4样品中茴香脑的含量均很高,分别是55.52、91.66和78.2 ng/g,说明2号厂家的高温曲和酱香曲中茴香脑的含量较高,同时,草蒿脑只在高温曲中被检出。另外,萘和1-石竹烯在部分样品中也有检出。
7种大曲样品各自分别检出的化合物含量箱线图如图5所示。由图5可知,7种大曲样品呈现相同的趋势,样品中挥发性化合物的含量分布在1.34 ng/g到57.01 ng/g之间。每种样品中位数线分布在10 ng/g左右,呈现明显的拖尾,说明样品中化合物含量在10 ng/g以上的有约50%,且含量跨度较大,图中的异常值就表明大曲中个别挥发性化合物的含量很高。对1号厂家的B1、B2、B3样品和2号厂家的J1、J2、J3、J4样品进行比较可知,2号厂家化合物含量总体上比1号厂家要高一些。

图5 7种大曲样品箱线统计图Fig.5 Seven samples of Daqu Bexplot
各大类化合物占总挥发性物质含量的平均百分比如图6所示,芳香族类、醛类、吡嗪类、酯类为所有大曲样品中含量较高的化合物,分别占总挥发性物质含量的22%、19%、18%、14%,其次是醇类、酸类、酚类化合物等。对于不同厂家的大曲,1号厂家吡嗪类物质含量百分比明显比2号厂家高,约为2号厂家的三倍,同时1号厂家大曲醛类和酸类物质含量也相对较高,而醇类、芳香类、酯类这几种化合物在2号厂家大曲中的百分比含量高。不同厂家生产使用的大曲挥发性物质个数和含量均有差异,用不同曲酿制出来的酒的味道就可能会大不相同。

图6 化合物大类占大曲样品总挥发性化合物的平均百分比Fig.6 The average percentage of volatile chemical groups in Daqu注:总体百分比=此物质所有含量/所有化合物含量×100;1号厂家百分比=1号厂家此物质含量/1号厂家所有化合物含量×100;2号厂家百分比=2号厂家此物质含量/2号厂家所有化合物含量×100。
2.6 GC-O-MS分析大曲中香气活性化合物
通过GC-O分析,在大曲样品中,共有17种香气活性化合物可被至少两个嗅闻人员闻到,其嗅闻结果如表2所示。由表2可知,有14种香气活性化合物被检出,另外3种香气化合物(8号、12号、13号)未被定性出,可能是由于这几种化合物的含量很低。6号(2-乙基-3,5-二甲基吡嗪)、10号(苯乙醛)、11号(异戊酸)、15号(苯乙醇)、17号(γ-壬内酯)都有很高的香气强度,贡献着烤土豆香、蜂蜜香、甜香、酸味、玫瑰香及椰子味,说明这5种香气物质可能对大曲整体香气特征具有重要贡献。同时,4号(2,3,5-三甲基吡嗪)、5号(反-2-辛烯醛)、7号(苯甲醛)和12号(未知)这四种化合物的香气强度评分值也较高,贡献着烤土豆香、坚果香、焦糖香及米香。总计有10种化合物在7种大曲中都能被嗅闻到,分别是2,3,5-三甲基吡嗪、反-2-辛烯醛、苯甲醛、2,3-丁二醇、苯乙醛、异戊酸、苯乙醇、γ-壬内酯及两种未知物。这些香气物质可能是构成大曲整体香气特征的基本物质。有个别化合物:3-辛醇只在J3和J4样品中检出,苯甲醇只在J4样品中检出。

表2 不同厂家七种大曲GC-O-MS香气活性成分分析结果
注:-:未被嗅闻到。
在这些香气活性化合物中,芳香族类化合物的香气强度较大,可能也是大曲香气的重要来源。芳香族化合物一般会呈现出玫瑰花香、蜂蜜香、水果香。如苯乙醛和苯乙醇,都具有花香、甜香、蜂蜜香,与苯丙氨酸的代谢相关[23],它们是多种食物的关键香气组成。吡嗪类化合物也具有较高的香气强度,这些含氮类化合物一般具有坚果香、烘焙香和烤肉类香味,最终能被带入到成品白酒中,成为白酒香气形成的重要来源之一。沈海月[27]对酱香白酒的闻香结果表明,2,5-二甲基吡嗪是酱香型白酒中香气强度最大的吡嗪类物质。这是因为在白酒生产工艺中,大曲的用量很大,一般会占到窖池发酵中用粮的25%左右。含氮类化合物的来源可能是大曲生产过程中发生美拉德反应形成,由于大曲在培菌发酵期间温度会达到 50 ℃以上,这样高的温度有利于美拉德反应的进行,促使大量含氮类化合物生成[28]。

表3 不同厂家七种大曲香气强度较大活性成分的浓度及香气活性值
注:a指文献报道该化合物在水中的阈值;-表示J4样品中未检测到6号化合物;n.a.表示查询不到该化合物在水中的阈值。
2.7 大曲香气活性化合物的香气活性值(OAV)分析
由表3可知,对于两个厂家的大曲,2-乙基-3,5-二甲基吡嗪和苯乙醛都是风味活性物质中香气活性值较高的两种化合物,分别贡献着烤土豆味、蜂蜜味和甜香。这些化合物对大曲的整体风味有重要贡献作用。芳香族类是大曲中主要的香气贡献物质,这与此前的研究结果一致[29]。就整体而言,1号厂家大曲中2,3,5-三甲基吡嗪的香气活性值较2号厂家高。另外,2号厂家J4大曲样品的苯乙醛的香气活性值较其他样品高。异戊酸(酸味)、苯乙醇(玫瑰香)、γ-壬内酯(椰子味、桃味)这3种化合物的OAV<1,但它们的香气评分均很高,GC-O结果与香气活性值分析结果存在差异,已有研究中也有过类似现象[28]。原因可能是化合物在水中的阈值与其在大曲体系中的阈值有一定偏差,也或许因为香气化合物在食品基质中的协同与拮抗作用,这些OAV<1 的化合物能被感官评价人员闻到很可能是因为某些其他化合物的协同作用[28]。
3 结论
本文以2种芝麻香白酒厂家的7种大曲为研究对象,采用固相微萃取结合气相色谱-质谱/嗅闻(GC-MS/O)联用技术对大曲挥发性活性成分进行了研究,同时考察了萃取头纤维类型、萃取时间、萃取温度以及样品量因4个因素对萃取效果的影响。研究结果表明,在50 ℃条件下,对1.5 g大曲样品采用50/30 μm DVB/CAR/PDMS萃取头顶空吸附30 min效果较佳;在7种大曲中共分离鉴定出69种挥发性化合物,分为11类,其中醇类(9种)、酯类(13种)、醛类(8种)、酮类(4种)、酸类(3种)、吡嗪类(9种)、芳香族类(8种)、酚类(5种)、杂环类(2种)、烷烃类(3种)和其他类(5种)。不同厂家的大曲挥发性化合物个数和含量均有差异,是形成不同酒风味特征的一个原因。
通过GC-O实验,2-乙基-3,5-二甲基吡嗪、苯乙醛、异戊酸、苯乙醇、γ-壬内酯等都有很高的香气强度,贡献着烤土豆香、蜂蜜香、甜香、酸味、玫瑰香及椰子味。此外2-乙基-3,5-二甲基吡嗪和苯乙醛这两种化合物的香气活性值OAV>1,与其他香气活性化合物共同组成了大曲独特的风味。
[1]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2015:45-53.
[2]涂荣坤,钱志伟,秦辉,等.大曲检测指标研究进展[J].酿酒科技,2016(1):110-112.
[3]申孟林,张超,王玉霞. 白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[4]向双全,黄应予,刘丽娟,等.大曲蛋白酶对固态酿酒发酵的影响[J].中国酿造,2016,35(6):101-104.
[5]倪雪.西凤酒大曲理化指标的优化与创新[J].酿酒,2015,42(1):118-120.
[6]张春林,敖宗华,炊伟强,等.顶空固相微萃取-气质联用快速测定大曲中的挥发性风味成分[J].食品科学,2011,32(10):137-140.
[7]ZHANG Chunlin,AO Zonghua,CHUI Weiiang,et al.Characterization of the aroma-active compounds in Daqu:a tradition Chinese liquor starter[J].European Food Research and Technology,2012(234):69-76.
[8]RISTICEVIC S,NIRI V H,VUCKOVIC D,et al. Recent developments in solid-phase microextraction[J].Analytical and Bioanalytical Chemistry,2009,393(3):781-795.
[9]DU Liping,HE Tingting,LI Wei,et al. Analysis of volatile compounds in Chinese Laobaigan liquor using headspace solid-phase microextration coupled with GC-MS[J].Analytical methods,2015,7(5):1906-1913.
[10]赵谋明,曹永,蔡宇,等. SDE和HS-SPME法与GC-O联用分析阳江豆豉的香气活性化合物的研究[J].现代食品科技,2016,32(5):264-275.
[11]李婷婷,索化夷,郑炯.顶空-固相微萃取-气质联用分析永川豆豉中挥发性成分[J].中国调味品,2013,38(12):86-90.
[12]ZHU Wenyou,REN Cong,NIE Yao,et al. Quantification of ochratoxin A in Chinese liquors by a new solid-phase extraction clean-up combined with HPLC-FLD method[J].Food Control,2016(64):37-44.
[13]LUO Tao,FAN Wenla,XU Yan. Characterization of volatile and semivolatile compounds in chinese rice wines by headspace solid phase microextraction followed by gas chromatography-mass spectrometry[J].Journal of the Institute of Brewing,2008,114(2):172-179.
[14]郝宝瑞,张坤生,张顺亮,等. 基于GC-O-MS和AEDA法对清酱肉挥发性风味成分分析[J].食品科学,2015,36(16):153-157.
[15]夏亚男,迟超逸,郭洁,等. GC-O-MS法对比3种红枣白兰地的挥发性成分[J].中国酿造,2014,33(2):119-124.
[16]王露,江伟,刘玉梅,等. GC-O-MS法对酒花中香气活性成分的分析[J].分析实验室,2015,34(6):640-646.
[17]GAO Wenjun,FAN Wenla,XU Yan,et al. Characterization of the Key Odorants in Light Aroma Type Chinese Liquor by Gas Chromatograph-Olfactometry,Quantitative Measurements,Aroma Recombination,and Omission Studies[J].Journal of Agricultural and Food Chemistry,2014(62):5796-5804.
[18]刘廷竹,黄明泉,邹青青,等.GC-O与GC-MS结合分析竹荪牛肉香精中的挥发性成分[J].食品科学,2016,37(2):92-98.
[19]ZHENG Yang,SUN Baoguo,ZHAO Mouming,et al.Characterization of the Key Odorants in Chinese Zhima aroma-type Baijiu by Gas Chromatography-Olfactometry,Quantitative Measurements,Aroma Recombination,and Omission Studies[J]. Journal of Agricultural and Food Chemistry,2016.
[20]赵谋明,蔡宇,冯云子,等.HS-SPME-GC-MS/O联用分析酱油中的香气活性化合物[J]. 现代食品科技,2014,30(11):204-211.
[21]Monica N,Roberto LS,Armando T,et al. Evaluation of fruit aroma quality:comparison between gas chromatography-olfactometry(GC-O)and odor activity value(oav)aroma patterns of strawberries[J]. Food Analysis Methods,2008(1):270-282.
[22]Luo T,Fan W L,Xu Y.Characterization of volatile and semi-volatile compounds in chinese rice wines by headspace solid phase microextraction followed by gas chromatography-mass spectrometry[J].Journal of The Institute of Brewing,2008,114(2):172-179.
[23]张春林.泸州老窖大曲的质量、微生物与香气成分的关系[D].无锡:江南大学,2012:15-25.
[24]Fan W L,Qian M C.Characterization of aroma compounds of Chinese“ Wuliangye” and “Jiannanchun” liquors by aroma extract dilution analysis[J]. Journal of Agricultural and FoodChemistry,2006,54(7):2695-2704.
[25]Fan W L,Qian M C.Headspace solid phase microextraction and gas chromatography-olfactometry dilution analysis of young and aged Chinese “Yanghe Daqu” l iquors[J].Journal of Agricultural and Food Chemistry,2005,53(20):7931-7938.
[26]Chen S,Xu Y.The Influence of yeast strains on the volatile flavour compounds of Chinese rice wine[J].Journal of the Institute of Brewing,2010,116(2):190-196.
[27]沈海月. 酱香型白酒香气物质研究[D]. 无锡:江南大学,2010.
[28]Pang X L,Guo X F,Qin Z H,et al.Identification of aroma-active compounds in Jiashi muskmelon juice by GC-O-MS and OAV calculation[J].Journal of Agricultural and Food Chemistry,2012,60(17):179-185.
[29]汪玲玲.酱香型白酒微量成分及大曲香气物质研究[D]. 无锡:江南大学,2013:31-33.
Identification of aroma-active compounds in Daqu by HS-SPME-GC-MS/O
MENG Wei-yi,HUANG Ming-quan*,SUN Bao-guo,ZHENG Fu-ping,SUN Jin-yuan,SUN Xiao-tao,LI He-he
(1.Beijing Key Laboratory of Flavor Chemistry,Beijing Technology and Business University,Beijing 100048,China;2.Beijing Technology and Business University,Beijing Technology and Business University,Beijing 100048,China)
The aroma compounds of Daqu were analyzed by headspace-solid-phase microextraction(HS-SPME)combined with gas chromatography-olfactometry-mass spectrometry(GC-O-MS). At the same time,the conditions of fiber type,adsorption time,extraction temperature and sample amount for analysis of volatile compounds in Daqu samples were optimized. The conditions of SPME were optimized by single factor experiment,such as fiber type,adsorption time,extraction temperature and sample amount. The optimum extraction conditions were 1.5 g sample,50/30 μm DVB/CAR/PDMS fiber,extraction time 30 min and extraction temperature 50 ℃. With the potimal conditons,69 volatile compounds were identified from the tested Daqu sample,including 9 alcohols,13 esters,8 aldehydes,4 ketones,3 acids,9 pyrazines,8 aromatic compounds,5 phenols,2 heterocyclic,3 alkanes and 5 others. 17 aroma-active compounds were detected by GC-O-MS,14 compounds were identified. The key aroma-active compounds were 2-ethyl-3,5-dimethyl pyrazine and phenylacetaldehyde. Their odor activity values(OAVs)and their aroma intensities were stronger than others. They contribute honey-like,baked potato-like,and the all aroma-active compounds constitute the unique aroma of Daqu.
Daqu;headspace solid-phase microextraction(HS-SPME);gas chromatography-olfactometry-mass spectrometry(GC-O-MS);aroma-active compounds;odor activity value
2016-09-02
孟维一(1992-),女,硕士研究生,研究方向: 香精香料的分析与应用,E-mail:meng_weiyi@163.com。
*通讯作者:黄明泉(1977-),男,副教授,研究方向: 食品检测分析,E-mail:hmqsir@163.com。
国家自然科学基金 (31471665);北京市属高等学校高层次人才引进与培养计划项目(CIT&tcd201404034)。
TS207.3
A
1002-0306(2017)06-0054-09
10.13386/j.issn1002-0306.2017.06.002

