自组装型金磁复合颗粒的制备与表征
习志江,刘畅,刘婕
(长江大学医学院,湖北 荆州 434023)
自组装型金磁复合颗粒的制备与表征
习志江,刘畅,刘婕
(长江大学医学院,湖北 荆州 434023)
基于磁性纳米颗粒的磁分离具有操作简单、分离速度快、易实现功能化、不影响分离物质的活性等优越的理化性质和生物相容性。金纳米颗粒作探针载体时可负载多个信号分子,从而对靶分子的检测信号进行放大。将磁性纳米颗粒和金纳米颗粒结合制备的金磁复合颗粒,既具有快速磁分离的优点,又具有金纳米颗粒对靶分子的检测信号进行放大的作用。采用自组装技术制备了金磁复合颗粒,并对所制备的金纳米颗粒和金磁复合颗粒进行了各种表征。结果表明,制备的金纳米颗粒大小比较均匀且性能稳定,通过自组装技术金纳米颗粒成功共价结合在Fe3O4@SiO2磁性颗粒表面,所制备的金磁复合颗粒具有良好的磁响应性。
自组装;磁性纳米颗粒;金纳米颗粒;金磁复合颗粒;制备;表征
纳米技术是一门研究尺寸在1~100nm范围内的物质组成体系的运动规律和相互作用以及实际应用的新的科学技术,主要包括纳米材料、纳米器件、纳米机器、纳米结构设计和加工组装以及相应的检测表征技术和方法等。其中,纳米材料因具有不同于其他材料的优异性能以及广阔的应用前景而成为当今科学研究的热点之一,纳米材料学也被称为21世纪“最有前途的材料学”。随着纳米技术与磁学的结合,磁性纳米材料出现了许多新的性质与现象,已成为人们研究的热点。磁性纳米颗粒(magnetic nanoparticles, MNPs)主要包括磁性合金(如CoPt3、FePt)、铁的氧化物(如Fe3O4、γ-Fe2O3)以及其他磁性复合物等,其中Fe3O4和γ-Fe2O3应用最为广泛。随着MNPs合成技术的发展,已成功研发出了各种制备MNPs的方法,如溶剂热法、共沉淀法、溶胶-凝胶法、微乳液法等[1~4]。MNPs具有粒径小、比表面积大、易表面修饰等特点,还具有特有的磁响应性,可在恒定磁场下聚集和定位,在交变磁场下吸收电磁波产热,已被广泛应用于核磁共振成像、生物标记与分离、疾病检测与诊断以及药物载体等领域。基于MNPs的磁分离具有操作简单、分离速度快、易实现功能化、易实现自动化及不影响分离物质的活性等优越的理化性质和生物相容性[5~7]。由于纳米颗粒比表面积很大,其表面活性极高,容易发生团聚和氧化,所以在实际研究和应用中经常在其表面进行各种功能化修饰。修饰后的纳米颗粒,不仅改善了表面性质,降低了表面活性,且由于其表面静电效应使颗粒之间发生排斥作用,氧化和团聚现象得到抑制,而且还可以改变其表面功能基团,使其带上一些与生物体比较相容的基团,可更好地应用于生物医学等领域。
金纳米颗粒(gold nanoparticles, AuNPs)是指直径在1~100nm范围内的金微小颗粒,一般为分散在水中的水溶胶,故又称胶体金。与其他纳米颗粒一样,金纳米颗粒也表现出一些独特的理化性质,如表面效应、小尺寸效应、量子尺寸效应等。金纳米颗粒的表面效应使它具有良好的催化性能,已成为纳米催化材料的一个典型代表。而金纳米颗粒的小尺寸效应导致了它具有独特的光学性质——表面等离子体共振(surface plasma resonance, SPR),在520nm左右金纳米颗粒有强SPR吸收,其吸收峰的等离子共振常随着尺寸的变化而发生频移,使其溶液的颜色发生从橘红色到紫红色的相应变化[8],有利于肉眼观察。此外,金纳米颗粒能迅速、稳定地与核酸和蛋白质等生物分子结合,而几乎不影响这些分子的生物活性[9],所以金纳米颗粒是优良的生物分子载体。金纳米颗粒标记技术实质上是蛋白质等高分子被吸附到金纳米颗粒表面的包被过程,它可以与牛血清白蛋白、免疫球蛋白、糖蛋白、毒素和酶等非共价结合。
目前,有许多金磁复合颗粒(gold-coated magnetic nanocomposites, GMNPs)的研究报道,其制备方法主要有微乳液法、超声化学还原法、自组装技术和种子生长法等[10~13]。相比之下,自组装技术不需要复杂的过程,能够简便快速合成GMNPs:首先制备金纳米颗粒、以及氨基或巯基修饰的MNPs,然后通过静电吸附作用或共价作用将金纳米颗粒吸附在MNPs表面。金纳米颗粒与巯基和氨基有很强的共价结合力,而且通过静电吸附作用,带负电的金纳米颗粒能够自组装吸附在氨基修饰的带正电的MNPs表面。
在传统检测方法中,在探针的一端只标记一个信号分子,而金纳米颗粒作探针载体时可负载多个信号分子,从而对目标靶分子的检测信号进行放大[9]。因此,将磁性纳米颗粒和金纳米颗粒结合制备的金磁复合颗粒,既具有快速磁分离的优点,又具有金纳米颗粒对靶分子的检测信号进行放大的作用。下面,笔者采用自组装技术制备金磁复合颗粒,并对所制备的金纳米颗粒和金磁复合颗粒进行了各种表征。
1 制备
1.1 试剂与仪器
1)试剂 六水合三氯化铁(FeCl3·6H2O)、乙酸铵(CH3COONH4)、乙二醇、正硅酸四乙酯(TEOS)、氨水、无水乙醇、氯金酸(HAuCl4)、二水柠檬酸三钠、3-巯丙基三乙氧基硅烷(MPTES)等,以上化学试剂均为分析纯。
2)仪器设备 电子天平(BSA124S,赛多利斯科学仪器有限公司)、电热恒温鼓风干燥箱(DHG-914385-Ⅲ,上海新苗医疗器械有限公司)、超声清洗机(KS-2500,宁波科生仪器厂)、恒速搅拌器(S-212,上海申胜生物技术有限公司)、透射电子显微镜(JEM-2200CX,日本Hitachi公司)、振动样品磁强计(7407,美国Lakeshore公司)、紫外可见分光光谱仪(UV-1800,日本Shimadzu公司)、Zeta电位与粒度分析仪(Nano-ZS,英国Malvern公司)等。
1.2 Fe3O4@SiO2磁性纳米颗粒的制备
首先采用软模板法制备Fe3O4磁性纳米颗粒[14~16],然后采用经典Stöber法[17~19]并进行改进后在Fe3O4颗粒表面包覆一层SiO2。
1.3 金纳米颗粒的制备与表征
还原法制备金纳米颗粒通常是在含有Au(Ⅲ)的溶液中,加入不同种类的还原剂,使Au(Ⅲ)被还原而聚集成直径为纳米级的金纳米颗粒。在选用同一种还原剂时,其粒径大小可通过对还原剂的用量来控制,用量大小与金纳米颗粒的粒径大小成反比。

图1 自组装金磁复合颗粒制备示意图
研究采用柠檬酸钠还原法[20~22]制备金纳米颗粒,具体过程如下:带冷凝管的烧瓶内先加入去离子水,几分钟后加入一定量的1%的氯金酸溶液,剧烈搅拌下加热至沸腾;然后加入适量的柠檬酸钠溶液,1~2min后溶液变为深红色;变色后继续回流15min,然后让其自然冷却至室温,即得到金纳米颗粒混悬液。
分别采用透射电子显微镜(Transmission Electron Microscope, TEM)、紫外可见分光光谱仪和Zeta电位与粒度分析仪对所制备的金纳米颗粒的形貌、紫外吸收峰及Zeta电位进行表征。
1.4 自组装型金磁复合颗粒的制备
图1为表面巯基修饰的Fe3O4@SiO2颗粒与金纳米颗粒自组装制备金磁复合颗粒示意图。
首先,采用3-巯丙基三甲氧基硅烷(3-mercaptopropyltriethoxysilane, MPTES)对Fe3O4@SiO2颗粒进行表面巯基修饰[23~27]。取上述制备的Fe3O4@SiO2颗粒,磁分离后用95%的乙醇溶解并超声30min,然后倒入三颈烧瓶中;在200r/min和通N2保护下,逐滴加入一定量的MPTES和氨水,反应4h,修饰巯基;用无水乙醇反复清洗产物直至无MPTES的气味,再用去离子水清洗2遍,最后溶解在95%的无水乙醇中,获得表面巯基修饰的Fe3O4@SiO2颗粒。
然后,取上述表面巯基修饰的Fe3O4@SiO2颗粒,超声30min,逐渐加入制备好的金纳米颗粒,放在37℃、180r/min的摇床中,直至磁分离上清液有略微红色为此,得到自组装型金磁复合颗粒。用去离子水反复清洗5次,最后金磁复合颗粒分散于去离子水中。
2 表征
采用透射电子显微镜(TEM)和振动样品磁强计(Vibrating Sample Magnetometer, VSM)分别对金磁复合颗粒的形貌及磁响应性进行表征。
2.1 金纳米颗粒的形貌、紫外吸收峰和Zeta电位
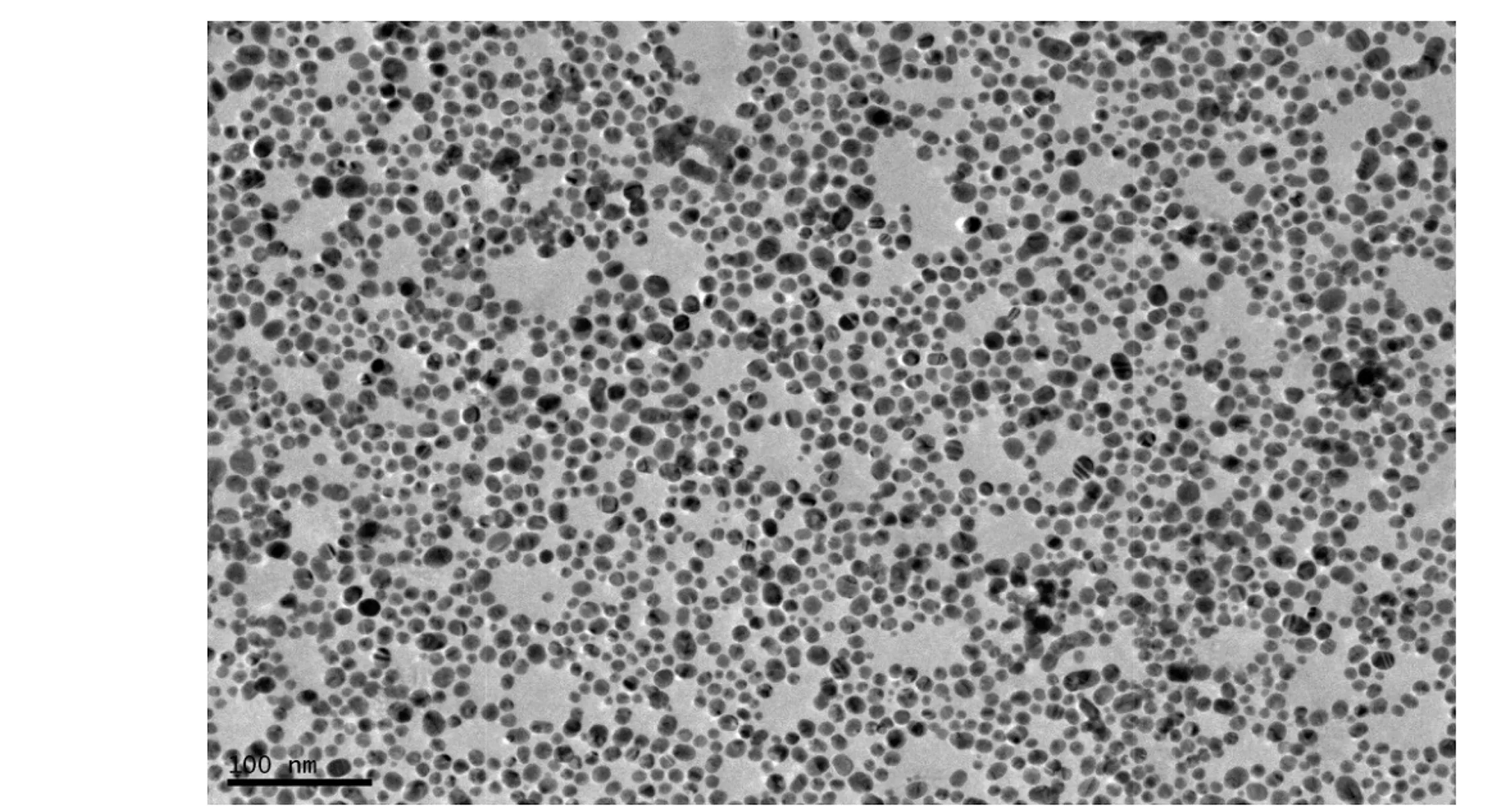
图2 金纳米颗粒TEM图

图3 不同稀释倍数的金纳米颗粒紫外吸收峰
通过控制柠檬酸钠的用量,可获得不同粒径大小的金纳米颗粒。图2为采用柠檬酸钠还原法制备的金纳米颗粒TEM图,其形态基本为圆形且粒径大小分布均匀(15nm左右),表明所制备的金纳米颗粒大小可控且比较均一。
所制备的金纳米颗粒稀释成不同的倍数,测定其紫外吸收,结果如图3所示。从图3可看出,不同稀释倍数的金纳米颗粒均在523nm有一吸收峰,其浓度越大,峰值就越大,表明所制备的金纳米颗粒具有一致性且性能稳定。
Zeta电位是对颗粒之间相互排
斥力或吸引力的强度的度量,是表征胶体分散体系稳定性的重要指标。Zeta电位绝对值越高,体系越稳定,即排斥力超过了吸引力,分散可以抵抗聚集;反之,Zeta电位绝对值越低,越倾向于凝聚,即吸引力超过了排斥力,分散被破坏而发生凝聚[28]。采用不同方法制备的金纳米颗粒,其Zeta电位有些为正值,有些为负值。图4为金纳米颗粒Zeta电位分布图,从图4可看出,采用柠檬酸钠还原法制备的金纳米颗粒Zeta电位为负值,这是因为采用该方法制备的金纳米颗粒表面含有柠檬酸根(C5H7O5COO—),而且其电位比较高,峰值为-42.7mV,所以金纳米颗粒不易发生凝聚,具有良好的稳定性。

图4 金纳米颗粒Zeta电位分布图
2.2 自组装型金磁复合颗粒的形貌及磁响应性

图5 金磁复合颗粒TEM图

图6 Fe3O4@SiO2磁性颗粒和Fe3O4@SiO2@Au复合颗粒的磁滞回归曲线
巯基修饰的Fe3O4@SiO2颗粒与金纳米颗粒通过二硫键共价结合自组装为金磁复合颗粒,图5为其TEM图。从图5中可清晰看出,在SiO2表面共价结合有许多金纳米颗粒,但未形成明显的核壳结构。
Fe3O4磁性纳米颗粒具有磁响应性,通过施加外磁场,可以方便、快速地从反应介质中分离,而且不影响分离物质的活性。可采用振动样品磁强计(VSM)测定Fe3O4磁性颗粒的磁滞回归曲线,也可简单用磁铁测试Fe3O4磁性颗粒的磁性强弱。图6为Fe3O4@SiO2磁性颗粒和Fe3O4@SiO2@Au复合颗粒的磁滞回归曲线,Fe3O4@SiO2磁性颗粒具有很强的磁响应性;结合金纳米颗粒后的Fe3O4@SiO2@Au复合颗粒磁性略微有所下降,这是因为Fe3O4@SiO2磁性颗粒表面吸附了金纳米颗粒所致,但仍然具有良好的磁响应性可用于磁分离。
3 结语
Fe3O4磁性纳米颗粒易被氧化而失去磁性,而且由于其表面活性高、粒子之间磁偶极相互作用,使得它易发生团聚,因此必须对其进行表面改性。对Fe3O4磁性颗粒进行表面包覆SiO2修饰后,大大增强了其稳定性,并提高了它在水溶液中的分散性和生物相容性;同时如果进一步与其他化学基团、纳米颗粒等结合,可进一步实现磁性纳米颗粒的功能化。金纳米颗粒能迅速、稳定地与核酸和蛋白质等生物分子结合,而几乎不影响这些分子的生物活性,是优良的生物分子载体。而且,以金纳米颗粒作探针载体可以负载多个信号分子,从而对靶分子的检测信号进行放大。
在贵金属中,金由于其低活性和易被含有巯基的化学或生物分子修饰的特点,成为磁性纳米颗粒优良的包覆材料之一。Fe3O4@SiO2磁性颗粒表面巯基修饰后可以与金纳米颗粒通过二硫键共价结合自组装为金磁复合颗粒。近些年来,由于金磁复合颗粒具有良好的生物相容性、快速的磁响应性、无需偶联剂而易于和生物分子结合等优点,目前已被广泛应用于磁分离、固定化、分子检测、靶向药物和磁共振成像等诸多领域。笔者研究制备了大小比较均匀且性能稳定的金纳米颗粒,并通过自组装技术成功制备了Fe3O4@SiO2@Au复合颗粒,尽管其磁性比Fe3O4@SiO2磁性颗粒略微有所下降,但仍然具有良好的磁响应性,可用于磁分离。
[1]Yeon T, Lee S S, Park J.Synthesis of highly crystalline and monodisperse maghemite nanocrystallites without a size-selection process[J].J Am Chem Soc, 2001, 123(51): 12798~12801.
[2] Lin C R, Chu Y M, Wang S C.Magnetic properties of magnetite nanoparticles prepared by mechanochemical reaction[J].Mater Lett, 2006, 60(4): 447~450.
[3] Wan S R, Huang J S, Yan H S, et al.Size-controlled preparation of magnetite nanoparticles in the presence of graft copolymers[J].J Mater Chem, 2006, 16(3): 298~303.
[4] Lan F, Hu H, Jiang W, et al.Synthesis of superparamagnetic Fe3O4/PMMA/SiO2nanorattles with periodic mesoporous shell for lysozyme adsorption[J].Nanoscale, 2012, 4(7): 2264~2267.
[5] Li Z Y, He L, He N Y, et al.Chemiluminescent detect of E.coli O157:H7 using immunological method based on magnetic nanoparticles[J].J Nanosci Nanotechnol, 2010, 10(2): 696~701.
[6] Liu B, Jia Y Y, Ma M, et al.High throughput SNP detection system based on magnetic nanoparticles separation[J].J Biomed Nanotechnol, 2013, 9(2): 247~256.
[7] Mahmoudian M R, Alias Y, Basirun W J, et al.Synthesis, characterization, and sensing applications of polypyrrole coated Fe3O4nanostrip bundles[J].Ceram Int, 2014, 40(7): 9265~9272.
[8] 孙双姣, 蒋治良.金纳米微粒的制备和表征及其在生化分析中的应用[J].贵金属, 2005,26(3): 55~65.
[9] 郑静, 程圭芳, 冯婉娟, 等.纳米金和磁性纳米颗粒在生物传感器中的应用[J].化学世界, 2010, 51(5): 310~313.
[10] Cho S J, Idrobo J C, Olamit J, et al.Growth mechanisms and oxidation resistance of gold-coated iron nanoparticles[J].Chem Mater, 2005, 17(12): 3181~3186.
[11] Liu T, Li D S, Yang D R, et al.An improved seed-mediated growth method to coat complete silver shells onto silica spheres for surface-enhanced Raman scattering[J].Colloid Surf A-Physicochem Eng Asp, 2011, 387(1-3): 17~22.
[12] Stoeva S I, Huo F, Lee J S, et al.Three-layer composite magnetic nanoparticle probes for DNA[J].J Am Chem Soc, 2005, 127(44): 15362~15363.
[13] Wu W, He Q G, Chen H, et al.Sonochemical synthesis, structure and magnetic properties of air-stable Fe3O4/Au nanoparticles[J].Nanotechnology, 2007, 18(14): 1~8.
[14] Xi Z J, Huang R R, Li Z Y, et al.Selection of HBsAg-specific DNA aptamers based on carboxylated magnetic nanoparticles and their application in the rapid and simple detection of hepatitis B virus infection[J].ACS Appl Mater Interfaces, 2015, 7(21): 11215~11223.
[15] Xi Z J, Zheng B, Wang C.Synthesis, surface modification, and biolabeling with aptamer of Fe3O4@SiO2magnetic nanoparticles[J].Nanosci Nanotechnol Lett, 2016, 8(12): 1061~1066.
[16] Ma C, Li C Y, He N Y, et al.Preparation and characterization of monodisperse core-shell Fe3O4@SiO2microspheres and its application for magnetic separation of nucleic acids from E.coli BL21[J].J Biomed Nanotechnol, 2012, 8(6): 1000~1005.
[17] He L, Li Z Y, Fu J, et al.Preparation of SiO2/(PMMA/Fe3O4) nanoparticles using linolenic acid as crosslink agent for nucleic acid detection using chemiluminescent method[J].J Nanosci Nanotechnol, 2011, 11(3): 2256~2262.
[18] Li C Y, Ma C, Wang F, et al.Preparation and biomedical applications of core-shell silica/magnetic nanoparticle composites[J].J Nanosci Nanotechnol, 2012, 12(4): 2964~2972.
[19] Sun X J, Liu F T, Sun L, et al.Well-dispersed Fe3O4/SiO2nanoparticles synthesized by a mechanical stirring and ultrasonication assisted stober method[J].J Inorg Organomet Polym Mater, 2012, 22(2): 311~315.
[20] 彭菊村, 卢强华, 吴波英.金纳米颗粒水相合成工艺研究[J].稀有金属材料与工程, 2006, 35(6): 954~958.
[21] 贺听, 熊晓东, 梁敬博, 等.免疫检测用纳米胶体金的制备及粒径控制[J].稀有金属, 2005, 29(4): 471~474.
[22] 周泽渊, 于淑湘, 姜永, 等.氯金酸的浓度对纳米金形态的影响[J].稀有金属材料与工程, 2008, 37(2): 350~353.
[23] 江红荣.金磁复合颗粒的制备与表征及其应用于拷贝数变异分析的初步探索[D].南京: 东南大学, 2013.
[24] 宋娟, 徐强, 张升晓, 等.巯基修饰磁性纳米材料富集-原子荧光法测定花蛤中甲基汞[J].鲁东大学学报(自然科学版), 2014, 30(4): 320~324.
[25] 贺全国, 吴伟, 杨云, 等.表面巯基化修饰的磁性Fe3O4纳米粒子合成与表征[J].精细化工中间体, 2007, 37(2): 63~67.
[26] Zhang S X, Zhang Y Y, Liu J S, et al.Thiol modified Fe3O4@SiO2as a robust, high effective, and recycling magnetic sorbent for mercury removal[J].Chem Eng J, 2013, 226(9): 30~38.
[27] Du J J, Jing C.Preparation of thiol modified Fe3O4@Ag magnetic SERS probe for PAHs detection and identification[J].J Phys Chem C, 2011, 115(36): 17829~17835.
[28] 朱欣星, 安然, 李昌朋, 等.胶原与明胶的结构研究: 方法、结果与分析[J].皮革科学与工程, 2012,24(5): 9~14.
[编辑] 洪云飞
2016-10-15
湖北省卫生计生科研基金资助项目(WJ2016-YZ-02)。
习志江(1977-),男,博士,讲师,现主要从事纳米技术在医学领域的分子检测及靶向治疗等方面的研究工作,xizhijiang@163.com。
TB383;R318
A
1673-1409(2017)01-0026-05
[引著格式]习志江,刘畅,刘婕.自组装型金磁复合颗粒的制备与表征[J].长江大学学报(自科版),2017,14(1):26~30.

