苯丙酮尿症新生儿血斑中辅酶及葡萄糖等物质的分析
闫静��王春艳 张雯艳 皮子凤 刘志强++宋凤瑞
摘要苯丙酮尿症(PKU)是新生儿先天性苯丙氨酸羟化酶缺陷所引起的苯丙氨酸代谢障碍疾病。本研究采用超高效液相色谱质谱联用技术,测定了5例PKU新生儿出生3天和出生30天后的血斑与20例年龄相仿的正常新生儿血斑中辅酶Q10的绝对含量和辅酶Q9的相对含量,其中,健康新生儿血斑中辅酶Q10的含量为(122.1±24.9)ng/mL,PKU新生儿组的含量为(59.0±12.0)ng/mL。采用气相色谱质谱联用技术测定了胆固醇和葡萄糖的相对含量。研究结果表明,与对照组相比,PKU新生儿血斑中辅酶Q10、Q9、胆固醇和葡萄糖的含量均显著降低,辅酶Q10的降低与血斑中苯丙氨酸含量升高呈现显著反向相关。本研究结果为PKU患儿的饮食治疗方案提供了依据。
关键词苯丙酮尿症;辅酶Q10;胆固醇;葡萄糖
1引言
苯丙酮尿症(Phenylketonuria,PKU)是一种由于肝脏苯丙氨酸羟化酶(PAH)缺乏或活性减低而导致苯丙氨酸代谢障碍的常染色体隐性遗传性疾病。辅酶Q10(CoQ10)是一种小分子醌类化合物,主要参与线粒体氧化磷酸化过程,在营养物质在线粒体内转化为能量的过程中起重要作用,且有明显的抗脂质过氧化作用[1,2]。人体的所有细胞中都存在CoQ10[3],在哺乳动物体内存在有辅酶Q9(CoQ9)[4]。CoQ10在个体中含量差异主要受饮食和疾病的影响[5],人体的血液和生物组织中,90%以上CoQ10是还原型[1,6,7]。Artuch等[8]在1999年首次报道了PKU患者体内CoQ10含量降低,通过饮食治疗的PKU患儿与相应年龄的正常对照组相比,血清中的CoQ10含量显著降低。随后的研究发现,PKU患者血清中CoQ10降低主要是由于苯丙氨酸(Phe)含量升高[9]。
苯丙氨酸有抑制胆固醇合成的作用[10,11]。Hughes等[12]发现,血清中CoQ10的降低与血清中的胆固醇水平有关。在PKU患儿病症与CoQ10和胆固醇等含量关系的研究中,目前的研究对象均为饮食治疗或控制的PKU患儿与相应年龄的正常儿童,然而由于血浆/血清中的CoQ10受饮食影响较大,所以无法确定其差异变化源于疾病本身,还是由于饮食差异。
人血清CoQ10的分析方法有色谱分析法、分光光度法、比色法[13]、电化学分析法[14]和电泳法[15],其中反向液相色谱分析应用最为广泛,所使用的检测器主要有紫外检测器[16]、电化学检测器[17,18]和质谱检测器[19~25],其中质谱检测的选择性和高灵敏度高。本研究采用超高效液相色谱与三重四极杆质谱联用技术,进行新生儿血斑中CoQ10的定量分析和CoQ9的半定量分析,采用气相色谱质谱联用技术(GCMS)测定胆固醇和葡萄糖,研究了PKU新生患儿与正常新生儿之间的CoQ10、胆固醇以及葡萄糖含量差异。
2实验部分
2.1实验对象
PKU新生儿与正常新生儿血斑均来自吉林省妇幼保健院(已签署知情同意书,并经伦理委员会同意),实验中使用S&S903滤纸进行新生儿血斑采集,正常新生儿组包括20例出生3天后的新生儿血斑,PKU新生儿组包括5例出生3天与出生30天未经饮食治疗的PKU新生儿血斑。使用1296071Delfia血斑打孔器(PerkinElmer公司)在滤纸片上采集直径为3.2mm的圆形血斑(相当于3.4μL血液,可以保证每片血斑中的血液含量是一致的[27])。血斑在检测辅酶含量前,需在室温晾干处理至少24h;或将样品于4℃保存待测。
2.2仪器与试剂
WatersXevoTQ质谱仪(英国Micromass公司),电喷雾离子源,数据采集使用MassLynx4.1采集软件和处理软件(Waters公司,Manchester公司,英国);AcquityUltraPerformanceLC超高效液相色譜系统(美国Waters公司),配有自动进样器。6890Nnetworld气相色谱系统(美国AgilentTechnologies公司),配5975inertXLMassselectivedetector质谱检测器,7683seriesG2614AN279自动进样器。
CoQ10、CoQ9、CoQ4,色谱级氨水和氟化铵(美国SigmaAldrich公司);甲醇(色谱纯,美国Tedia公司);葡萄糖标准品(D(+)Glucose,minimum99%GC,美国Sigma公司);其余试剂均为分析纯。实验用水为超纯水(MilliQ,比利时Millipore公司)。
2.3质谱条件和色谱条件
质谱条件:采用正离子模式,多反应离子监测模式进行检测,锥孔电压和碰撞电压通过Intellistart功能进行优化。离子源电压为3.0kV,离子源温度为120℃,去溶剂温度为500℃,去溶剂气体流速为800L/h,锥孔气流速为50L/h。碰撞气氩气压力为0.43Pa。使用QuanLynx软件(Micromass,UK)绘制标准曲线及进行定量分析。
超高效液相色谱分离条件:ACQUITYUPLCBEHC18色谱柱(50mm×2.1mm,1.7μm,Waters公司),流动相A为含0.005%(V/V)氨水和0.2mmol/LNH4F的甲醇溶液,流动相B为纯水,以A〖KG-3∶〖KG-5B=99.9〖KG-3∶〖KG-50.1(V/V)等度洗脱,流速为0.45mL/min,色谱柱平衡时间为10min。流动相中的铵离子可以增强辅酶在质谱中的信号。由于辅酶的极性较小,在反相色谱柱中很难被洗脱,最终确定采用纯水(流动相B)与添加NH+4的甲醇有机相(流动相A)为流动相进行分析。
2.4血斑样品中辅酶的提取
取两片直径3.2mm的血斑,置于1.5mL离心管中,加入102μL含0.1%甲酸(V/V)的甲醇,超声提取20min,11000r/min离心15min,取上清液进行液相色谱质谱分析[23]。
2.5胆固醇和葡萄糖的GCMS分析
取一片直径3.2mm的血斑,加入100μL双(三甲基甲硅烷基)三氟乙酰胺(Bis(trimethylsilyl)trifluoroacetamide,BSTFA)和50μL吡啶,振荡混匀后,70℃反应2h,11000r/min离心5min,取上清液进行GCMS分析。GCMS仪器设置条件:初始柱温70℃,保持1.5min;以20℃/min升温至220℃,保持5min;以10℃/min程序升温至230℃,保持5min;以10℃/min程序升温至280℃,保持5min,每个样品的运行时间为30min。无分流进样,进样体积1μL。载气为氦气,总流速为7.8mL/min。HP5MS毛细管柱(0.25mm×30m×0.25μm,Agilent19091S433)。电子轰击离子源,正离子模式检测,电子能量70eV,离子源温度280℃。
3结果与讨论
3.1串联质谱参数的确定
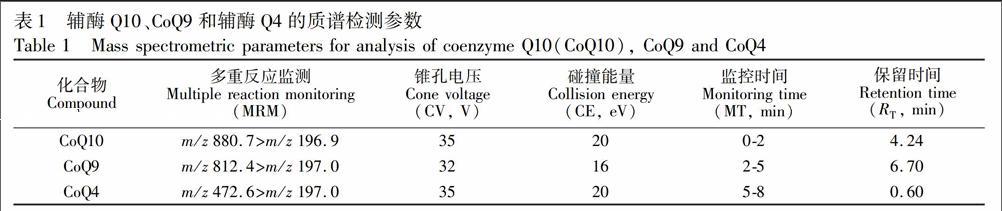
通过直接进样分析模式优化质谱条件,辅酶标准品用实验中的流动相溶解,进行质谱检测。优化后3种辅酶的准分子离子\[M+NH4\]+与特征分子离子组成的定量离子对及其它质谱参数见表1。在正离子质谱条件下,CoQ10,CoQ9和CoQ4的准分子离子\[M+NH4\]+分别为m/z880.7,m/z812.4和m/z472.6,特征子离子m/z197.0代表的是辅酶碎片离子苯醌环结构。
3.2方法的分析性能
以不同浓度CoQ9和CoQ10的峰面积与一定浓度内标CoQ4的峰面積比值作为纵坐标,CoQ9和〖CM(44CoQ10的浓度为横坐标,绘制标准曲线。测定CoQ10线性方程为y=4.180x-4.835,相关系数R2=〖CM)
0.997,线性范围为1.5~89.0ng/mL,检出限(LOD,S/N>3)为0.8ng/mL,定量限(LOQ,S/N>10)为1.5ng/mL。测定CoQ9线性方程为y=15.238x-0.798,R2=0.999,线性范围为0.3~20.0ng/mL,LOD为0.2ng/mL,LOQ为0.3ng/mL。测定CoQ9和CoQ10的日内和日间精密度,以及添加不同浓度辅酶标准品后的回收率,日内和日间精密度(相对标准偏差)均小于15%,回收率在85.0%~115.0%之间,说明本方法准确、可靠。
3.3血斑样品的分析
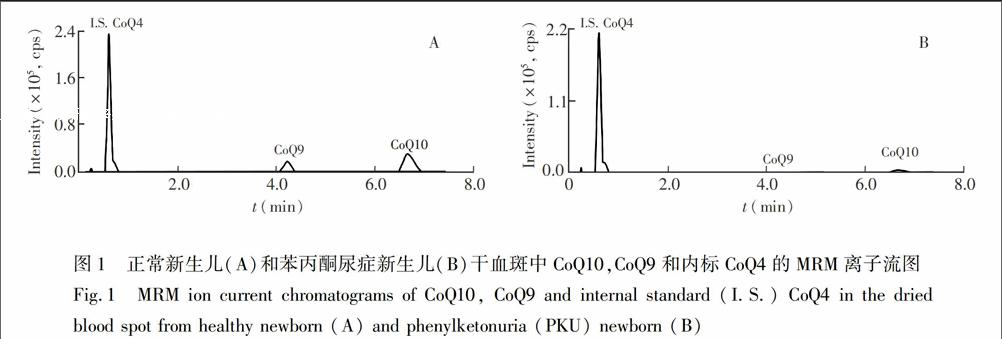
采用UPLCMS/MS方法分析新生儿血斑样品(健康新生儿20例,经典型PKU新生儿5例)中CoQ9和CoQ10的含量,其中5例PKU新生儿血斑样品分别为出生3天和30天后采集。PKU是一种以智力低下为特征的先天性代谢缺陷疾病,分为经典型和非经典型两类。2其中经典型是由于苯丙氨酸缺乏或活性降低所致。图1为健康新生儿与经典型PKU新生儿血斑样品中CoQ9和CoQ10的MRM离子流图。与健康正常新生儿(图1A)相比,PKU新生儿血斑中(图1B)CoQ9和CoQ10的含量均显著降低。CoQ10的信噪比(S/N)均大于10,可以进行定量分析,而CoQ9的3
正常新生儿组CoQ10的含量为(122.1±24.9)ng/mL(20例新生儿出生3天后采集的血斑),PKU新生儿组的含量为(59.0±12.0)ng/mL(分别为5例出生3天和30天后采集的血斑)。与正常新生儿相比,PKU新生儿血斑中CoQ10的含量显著降低。如表2所示,两组的t检验结果为p<0.001(4.1×10
0)。此外,以峰面积大小进行相对含量分析,在正常新生儿血斑中(图1A)中可以定量检测到CoQ9,而在PKU新生儿血斑中(图1B)CoQ9含量低于方法定量限,表明PKU新生儿血斑中CoQ9的含量与健康对照组相比显著降低。
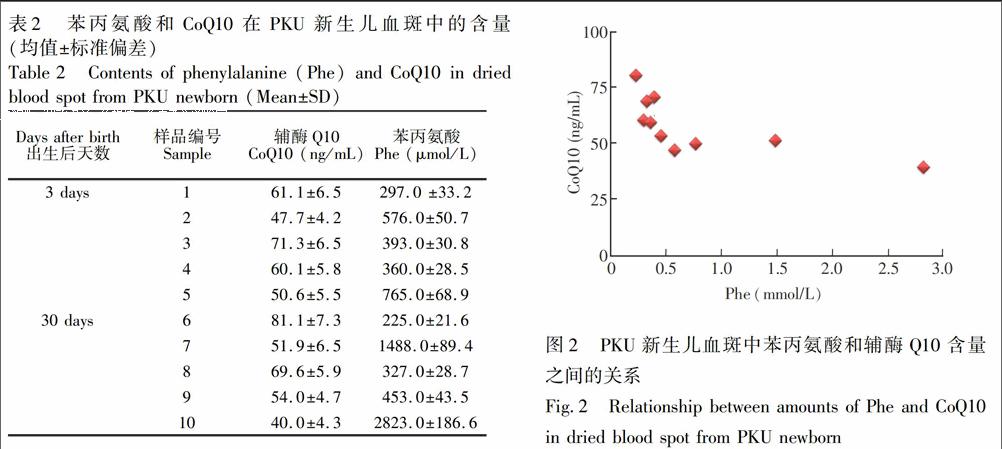
PKU新生儿血斑中苯丙氨酸(Phe)的含量采用本研究组已建立的分析方法[24,25]进行测定。PKU新生儿血斑中苯丙氨酸的含量与CoQ10之间的含量如表2和图2所示,每个样品重复测定3次,样品1~5号为PKU新生儿出生3天后采集的血斑,样品6~10号为PKU新生儿出生30天后采集的血斑,可见血液中Phe的含量越高,CoQ10的含量越低。经典型PKU患儿由于苯丙氨酸羟化酶缺乏或活性降低会导致Phe代谢障碍,使血液中的Phe含量显著升高,其血液中CoQ10的降低可能是由于其自身的抗氧化作用所导致。
3.4胆固醇和葡萄糖的GCMS的结果分析
采用GCMS分析经衍生化处理后的血斑提取样品[25],根据谱库检索对α和β型D葡萄糖以及胆〖CM(44固醇进行归属,并测定其相对含量,每个样品重复测定3次。由表3可知,与正常新生儿相比,PKU新〖CM)
生儿血液中的胆固醇、α和β型D吡〖ZH(喃型葡萄糖的含量均显著降低,与CoQ10和CoQ9降低的结果一致,均与血液中苯丙氨酸的含量呈反向相关。
4结论
测定了新生儿血斑中CoQ10、CoQ9、胆固醇和葡萄糖的含量,结果〖ZH)表明,与健康的新生儿相比,PKU新生儿出生3天后采集的血斑和出生30天后(正常哺乳的情况下)采集的血斑中上述化合物的含量均显著降低,与血液中苯丙氨酸的含量升高呈现反向相关。由于CoQ10在抗脂质过氧化作用中起着重要作用,推荐在确诊为经典型PKU患儿的饮食治疗中适当提高CoQ10的摄入量。此外,针对PKU患儿血液中葡萄糖含量降低的情况,建议在经典型PKU患儿的饮食治疗中适当增加葡萄糖的摄入。
References
1CraneFL.J.Am.Coll.Nutr.,2001,20(6):591-598
2HargreavesIP.Ann.Clin.Biochem.,2003,40(Pt3):207-218
3MilesMV,HornPS,MorrisonJA,TangPH,deGrauwT,PesceAJ.Clin.Chim.Acta,2003,332(12):123-132
4RuizJimenezJ,PriegoCapoteF,MataGranadosJM,QuesadaJM,LuquedeCastroMD.J.Chromatogr.A,2007,1175(2):242-248
5HansenG,ChristensenP,TüchsenE,LundT.Analyst,2004,129(1):45-50
6GómezMurciaV,TorrecillasA,deGodosAM,CorbalánGarcíaS,GómezFernndezJC.Biochim.Biophys.Acta,2016,1858(6):1071-1081
7LeeBJ,TsengYF,YenCH,LinPT.Nutr.J.,2013,12(1):142-150
8ArtuchR,VilasecaMA,MorenoJ,LambruschiniN,CambraFJ,CampistolJ.Am.J.Clin.Nutr.,1999,70(5):892-895
9ArtuchR,ColomeC,VilasecaMA,SierraC,CambraFJ,LambruschiniN,CampistolJ.J.Inherit.Metab.,2001,24(3):359-366
10SheferS,TintGS,JeanGuillaumeD.J.Neurosci.Res.,2000,61(5):549-563
11HironoriN,HirokazuT,YoshiyukiO,KenichiH,ToshihiroS,HUIShuPing,ToshihiroO,HiromiU,TohruY,SatoshiH,AkiraO,TakashiM.Clin.Chim.Acta,2014,433:1-4
12HughesK,LeeBL,FengX.FreeRadic.Biol.Med.,2002,32(2):132-138
132TangPH,MilesMV,SteeleP,DeGrauwA,ChuckG,SchroerL,PesceA.Clin.Chim.Acta,2002,318(12):127-131
14NiklowitzP,MenkeT,GiffeiJ,AndlerW.BioFactors,2005,25(14):67-72
15LucangioliS,FlorS,ContinM,TripodiV.Electrophoresis,2009,30(11):1899-1905
16DuncanAJ,HealesSJR,MillsK,EatonS,LandJM,HargreavesIP.Clin.Chem.,2005,51(12):2380-2382
17MoscaF,FattoriniD,BompadreS,LittarruGP.Anal.Biochem.,2002,305(1):49-54
18MonteroR,ArtuchR,BrionesP,NascimentoA,GarciacazorlaA,VilasecaMA,SánchezAlcázarJA,NavasP,MontoyaJ,PinedaM.Biofactors,2005,25(14):109-115
19TeshimaK,KondoT.Anal.Biochem.,2005,338(1):12-19
20HahnSH,KerfootS,VastaV.MethodsMol.Biol.,2012,837:169-179
21QuinnPJ,PackerL.FreeRadic.Biol.Med.,1990,9(2):117-126
22MilesMV,HornPS,MorrisonJA,TangPH,DeGrauwT,PesceAJ.Clin.Chim.Acta,2004,347(12):139-144
23WangCY,ZhangWY,SongFR,LiuZQ,LiuSY.AminoAcids,2012,42(5):1889-1895
24WangCY,ZhuHB,ZhangWY,SongFR,LiuZQ,LiuSY.AminoAcids,2013,44(2):661-671
25JungY,AhnYG,KimHK,MoonBC,LAY,RyuDH,HwangGS.Analyst,2011,136(20):4222-4231
AbstractPhenylketonuria(PKU)isanewborninheritedmetabolicdisordercausedbythegeneticdeficiencyofhepaticenzymephenylalaninehydroxylase(PAH)whichthusinmetabolicdisorderofphenylalanine.Inthisstudy,ultraperformanceliquidchromatographytandemmassspectrometry(UPLCMS/MS)methodwasusedtoanalyzetheaccurateamountofcoenzymeQ10(CoQ10)andtherelativeamountofCoQ9innewborndriedbloodspot(DBS)collectedfrom5PKUnewborns(3and30daysafterbirth,respectively)and20healthynewborns.ThecontentofCoQ10was(122.1±24.9ng/mL)and(59.0±12.0ng/mL)inDBSfromhealthynewbornsandPKUnewborns,respectively.TherelativecontentsofcholesterolandglucoseintheDBSweredeterminedbygaschromatographymassspectrometry(GCMS).Incomparisonwithhealthynewborngroup,thelevelsofCoQ10,CoQ9,cholesterolandglucosewereallsignificantlydecreasedinPKUnewborns.TheincreasedcontentofPheandthedecreasedcontentofCoQ10showedsignificantinversecorrelationintheDBSfromPKU.ThisstudyprovidesreferencesfordiettherapyofPKUnewborns.
KeywordsPhenylketonuria;CoenzymeQ10;Cholesterol;Glucose
(Received20September2016;accepted26December2016)
ThisworkwassupportedbytheNationalNaturalScienceFoundationofChina(No.21673219).

