数字减影血管造影定位引导技术在动态采集恒河猴脑脊液中的应用
焦 河,王凤英*,王 滔
(1.四川大学华西医院,四川成都 610041;2.成都高新海尔森医院,四川成都 610041)
数字减影血管造影定位引导技术在动态采集恒河猴脑脊液中的应用
焦 河1,王凤英1*,王 滔2
(1.四川大学华西医院,四川成都 610041;2.成都高新海尔森医院,四川成都 610041)
探索数字减影血管造影(DSA)定位引导技术在恒河猴脑脊液动态采集中的应用。将28只恒河猴随机均分为2组,经左前肢静脉推注30 g/L戊巴比妥钠溶液全麻后,常规剔除背部脊柱周围体毛并消毒;试验组在DSA定向引导技术下行腰椎间隙穿刺蛛网膜下腔采集脑脊液,结果14只全部穿刺成功,穿刺后均有脑脊液从穿刺针中流出;对照组直接行腰椎间隙穿刺蛛网膜下腔,8只穿刺成功,6只穿刺失败,后经DSA定位引导技术调整针尖方向与位置,完成穿刺,采集到脑脊液;28只恒河猴穿刺成功后均在DSA定位引导下将硬膜外麻醉导管经蛛网膜下腔至枕大池,置泵于腰背部,通过所置的泵可实现恒河猴在清醒、全生理状态下对脑脊液进行动态多次采集,快速省时,由于采样导管置于枕大池,采集到的脑脊液无色透明、样品质量有保证,易于满足检验需要,具有一定的实用价值。
恒河猴;腰椎穿刺术;脑脊液
脑脊液(cerebral spinal fluid,CSF)由侧脑室中脉络丛产生,供给脑细胞一定的营养,运走脑组织的代谢产物,调节中枢神经系统的酸碱平衡,缓冲脑和脊髓的压力,对脑和脊髓具有保护和支持作用[1],脑脊液中含有通透血脑屏障的成分,采用脑脊液药理学的试验方法比血清药理学更具有说服力和可信度[2],通过检测药物在脑脊液中的含量来探索药物是否能有效通过血脑屏障[3],对研究中枢神经系统疾病病因和病理机制,以及神经系统药理学具有重要作用[4]。在动物清醒、全生理状态下动态多次采集枕大池无色透明的脑脊液是研究的关键环节,定位至关重要。以往常用的小脑延髓穿刺,因危险性大,容易造成血性脑脊液,混入的血液可能影响药物浓度测定的准确性,同时易发生颅内感染[5]。本文在数字减影血管造影(digital subtraction angiography,DSA)定位引导下可以直观将硬膜外麻醉导管经腰椎间隙蛛网膜下腔置于枕大池,实现恒河猴在清醒、全生理状态下动态多次采集脑脊液,为神经系统疾病机制的研究和药效评价、神经精神类药物在脑脊液中药-时曲线等提供了非常好的平台。
1 材料与方法
1.1 材料
1.1.1 实验动物 恒河猴28只,雄性,体重4 kg~7 kg,年龄3岁~6岁,购自四川格林豪斯生物科技有限公司。随机分为试验组和对照组两组,每组14只,穿刺前禁食禁水8 h。
1.1.2 仪器设备 飞利浦大型平板数字减影血管造影机(DSA)-FD20。
1.1.3 主要耗材和试剂 一次性使用麻醉穿刺包,鲁食药监器械生产产品,规格型号:AS-E 18#;微导丝,美国COOK公司产品,规格型号:TPMG-16C-180-TC45-FLX12,批号:E3415442;BD18G封闭式静脉留置针;30 g/L戊巴比妥钠溶液,规格:25 g/瓶,白色粉末状,瓶身批号:CAS Number:57-33-0,MDL number:MFCD00070198。
1.2 方法
1.2.1 腰椎穿刺术 将恒河猴按1 mL/kg 30 g/L戊巴比妥钠溶液注射麻醉后侧卧于DSA手术检查台上,尽量屈颈、后肢屈曲贴近腹部,使动物背部呈弓形,体位正确与否,常为穿刺成功与否的重要环节。消毒后的恒河猴,脊柱前屈,整个身体呈“C”字形,充分打开椎间隙[6],以保证穿刺的顺利进行。常规剔除背部脊柱周围体毛并50 mL/L艾利克(聚维酮碘溶液)消毒铺巾(图1)。试验组在DSA透视下选择L5与L6、L6与L7间隙作为穿刺点(图2),通过DSA直视穿刺针斜面与动物矢状面平行,同时缓慢刺入椎间隙,出现落空感后,在DSA下将穿刺针斜面旋转至与身体纵轴垂直,并使斜口朝向头部,取出硬膜外套管针的针芯,观察脑脊液流出情况,再将带有微导丝的麻醉导管在DSA下通过蛛网膜下腔至枕大池;对照组凭经验同样选择L5与L6、L6与L7间隙作为穿刺点穿刺,观察脑脊液流出情况,将带有微导丝的麻醉导管在DSA下通过蛛网膜下腔至枕大池。

图1 侧卧位相对固定、消毒

图2 穿刺点的选择
1.2.2 微导丝的应用 硬膜外麻醉导管定位准确,必须要知道导管远端的位置,而麻醉导管本身在DSA下不具备显像能力,必须要借助一个能进入麻醉导管的特殊材料微导丝,微导丝是一种复合金属材质,在DSA透视下具有一定显像能力,根据在DSA下微导丝的尖端位置确定麻醉导管远端的位置,从而定位到采集脑脊液的具体位置——枕大池(图3)。
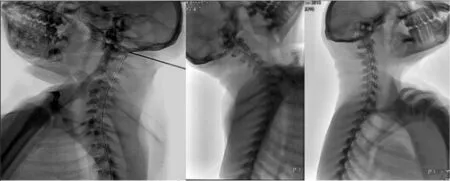
图3 导管远端位置(枕大池)
1.2.3 皮下采样接口(泵)的埋置 在穿刺点朝头部5 cm~10 cm处,制作切口,分离皮肤和皮下脂肪组织层,形成皮下空间;取出微导丝,将硬膜外麻醉导管引导至切口;然后将采样接口(泵)和硬膜外麻醉导管稳固连接;最后将采样接口(泵)缝合固定在皮下,缝合切口。
1.2.4 术后检查及评价 28只恒河猴术后每天观察并记录动物的行为学(包括摄食能力、活动能力、步态),神经损害体征,穿刺局部情况,并对以上指标进行量化,参照改良Tarlov评分标准[7]评价其神经功能,即:0级,后肢无活动,不能负重,计0分;1级,后肢可见活动但不能负重,计1分;2级,后肢活动频繁或有力,不能负重,计2分;3级,后肢可支持体重,能走1步~2步,计3分;4级,可行走,仅有轻度障碍,计4分;5级,行走正常,计5分(正常状态下,动物Tarbv评分为5分)。改良的切口愈合等级评分标准[8]评价其腰椎穿刺局部情况如下:0级,穿刺局部化脓,需切开引流等处理,计0分;1级,穿刺局部有炎症或渗血、漏液,如红肿、血肿、积液、硬结等,计1分;2级,穿刺局部愈合优良,无不良反应,计2分。

2 结果
2.1 直接穿刺法
14例中8例穿刺成功,退出穿刺针芯后见无色透明的脑脊液从穿刺针中流出,6例穿刺后无脑脊液流出,成功率为57%。穿刺失败的6例经DSA定位引导技术下调整针尖深度、方向与位置,见无色透明的脑脊液从穿刺针中流出。
2.2 在DSA定位引导下穿刺法
14例经DSA定位引导下全部穿刺成功,退出针芯后均有无色透明的脑脊液从穿刺针中流出,成功率为100%。两种穿刺方法经卡方检验,差异显著(P<0.05)(表1)。
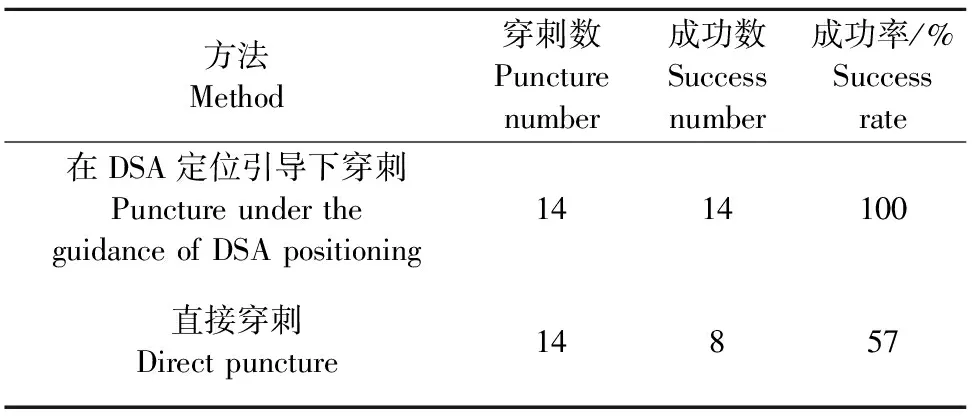
表1 2种方法穿刺结果比较
2.3 脑脊液采集情况
本文28例恒河猴穿刺后均经DSA定位引导下置管至枕大池,埋置泵于腰背部,术后均能从泵中采集到无色透明的脑脊液。其中对照组中有2例经腰椎间隙穿刺成功后在进入蛛网膜下腔时无脑脊液流出,经DSA下进微导丝至导管远端发现其远端转折(图4),微退调整导管尖端方向,顺利进入枕大池;有3例在置入泵准备缝合时,确认脑脊液抽吸情况发现抽吸受阻,负压增大,在DSA下进微导丝,微调导管远端方向和位置,回抽,脑脊液通畅,其原因是在置入泵过程中,导管和泵对接时因旋转了留在体外的导管,导致导管远端方向和位置移位;对照组有2例在腰椎穿刺时有创伤,造成最初的脑脊液稍带血色,后逐渐变成无色透明的脑脊液;有5例动物在术后第3天行脑脊液动态采集时,导管负压增大,致无法采集到脑脊液,拔出导管后观察导管远端有凝固血液阻塞或神经根组织堵塞了引流管通道。

图4 导管远端转折
2.4 行为学观察、神经功能评分及穿刺点情况
28只恒河猴均于置管术后1 h左右清醒,术中和术后均无死亡,术后生命体征平稳。穿刺术后恒河猴的饮食、活动均于当天恢复正常。术后观察1周,腰椎穿刺点和皮下采样接口(泵)埋置位置伤口愈合良好,改良Tarlov评分标准评价其神经功能,显示穿刺前后均无神经损害(表2)。

表2 术后1周观察结果统计情况
3 讨论
3.1 实验动物脑脊液的采集方法
一类是经皮颈椎穿刺小脑延髓池置管法,需要切除部分椎板,且手术部分的蛛网膜下腔易发生粘连,影响脑脊液循环及其成分,导管置入时易损伤血管导致蛛网膜下腔出血[9];其二在颅骨上钻孔插管引流脑脊液,这种方法往往适合于一次性采集脑脊液,而再次采集脑脊液时却要再次麻醉动物,在原骨窗处清除骨腊或另开骨窗,重新置管[10],操作有一定的难度且不易预留和固定导管,同时在暴露颅骨操作过程中,易大量出血,存在人为损伤脑组织、脑脊液外漏等问题,观察结果不够稳定可靠[11],多次穿刺过程中容易误刺到脑干,导致动物立即死亡,死亡率很高[12];而本文中在DSA定向引导下经腰椎间隙穿刺蛛网膜下腔至枕大池并埋泵,这种方法操作简便,安全性好,可行性强,手术损伤较小,导管定位准确,其成功率几乎为100%;通过埋置的泵采集脑脊液,快速省时,实现在动物清醒时、全生理状态下对脑脊液进行动态多次采集,采集导管在体内可留置3个月时间,最频繁的间隔1 h~2 h采集1次,也有1 d~2 d采集1次,每次的量0.5 mL~1 mL。
3.2 穿刺技巧
由于蛛网膜下腔外有由疏松结缔组织和静脉丛构成的硬膜外腔,内有富含血管的软脊膜,因此穿刺前需熟悉局部解剖,穿刺方向不当、歪斜、太深或太浅都可能导致穿刺失败或损伤周围组织[13],穿刺时,穿刺针垂直刺入恒河猴背部腰椎间隙,当感觉有落空感及动物的后肢跳动时,表明针尖已达蛛网膜下腔[14],退出针芯,可见清亮脑脊液流出。将带有微导丝的硬膜外导管缓慢送入穿刺针内,当送入约10 cm左右后,感觉到导管尖端受阻,DSA下见导管远端已到针尖处,逐渐将穿刺针斜面从与动物矢状面平行位置旋转到与动物冠状面平行,同时将暴露在体外的穿刺针向足侧轻轻倾斜,轻进导管明显有突破感时,表明导管远端已进入蛛网膜下腔越过了穿刺针尖,缓慢将带有微导丝的导管送至枕大池,轻轻退出微导丝,微导丝尖端会有无色透明的脑脊液点滴,同时导管内有无色透明的脑脊液缓慢流出。由于脑脊液中真正含有通透血脑屏障的成分, 因此在对中枢神经系统药效学的研究中采用脑脊液药理学的试验方法就比血清药理学更具说服力, 可增加试验结果的可信度[15]。介入微创的采样操作,再次采集脑脊液时无需麻醉动物,提高了动物的福利,大大降低了脑脊液采样的难度,减少了劳动力消耗,相应地减少了实验动物的消耗,降低了实验动物成本;DSA的准确定位,采集的脑脊液样品质量更有保证,易于满足检验需要,具有一定的实用价值,采集的数据结果更有分析意义。
[1] 陈 霆,丛 喆,魏 强.实验用猴脑脊液采集技术方法的创新[J].中国比较医学杂志,2011,21(2):49-51.
[2] 富 宏,陶迎红,王学美,等.经皮穿刺延髓池抽取兔和大鼠脑脊液的方法[J].中国比较医学杂志,2006,16(11):684-687.
[3] Huang H,Zhang Y,Yang R,et al. Determination of baicalin in rat cerebrospinal fluid and blood using microdialysis coupled with ultra-performance liquid chromatography-tandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2008,874(1-2):77-83.
[4] 杨之兰,何东松,鲁婷婷.老年人侧入法与直入法腰椎穿刺比较[J].云南医药,2015,36(3):348-349.
[5] 何继红,许 飞,孙红斌.一种Beagle犬腰椎穿刺置管术介绍[J].中国比较医学杂志,2008,18(3):72-74.
[6] 高启贤,张慧玲,译.脑脊髓液的采集和化验在诊断价值方面的研究进展[J].动物医学进展,1997,18(2):40-42.
[7] Goldsmith H S,Steward E,Duckett S.Early application of pedicled omentum to the acutely traum atised spinal cord[J].Paraplegia, 1985, 23(2): 100-112.
[8] 吴在德,吴肇汉.外科学[M].7版.北京:人民卫生出版社,2008:132.
[9] 吕田明,潘志勇.啮齿类动物脑脊液取样技术[J].中华临床医师杂志:电子版,2013,24(7):11623-11626.
[10] 李惠勉,李建章,姚淑芬.一种实用的采集兔脑脊液方法[J].解剖学杂志,2000,23(5):488.
[11] 孙建森,黎海涛,应大君.监测烧伤实验犬颅内压椎管内置管技术的探讨[J],中国比较医学杂志,2007,17(3):174-176.
[12] Kelley D J,Farhoud M,Meyerand M E,et al.Creating physical 3D stereolithograph models of brain and skull[J].PLoS One,2007,2(10):e1119.
[13] Wang Z C.Neurosurgery of Wang Zhong- cheng[M].Wuhan:Hubei Science and Technology Press,2005:169-170.
[14] 田 野,黎兰芝,陈 强,等.提高腰椎穿刺成功率的体会[J].现代医药卫生,2004,14(20):1393-1394.
[15] 梅建勋,张伯礼,陆 融.采用脑脊液药理学方法对中药影响星形胶质细胞神经营养作用的观察[J].中药材,2000,23(8):467-470.
Application of DSA Positioning and Guiding Technique in Dynamic Acquisition of Cerebrospinal Fluid in Ganges River Monkeys
JIAO He1,WANG Feng-ying1,WANG Tao2
(1.WestChinaHospitalofSichuanUniversity,Chengdu,Sichuan,610041,China; 2.ChengduHighTechHai'ersenHospital,Chengdu,Sichuan,610041,China)
This paper is to explore the application of Digital Subtraction Angiography (DSA) positioning technology in the dynamic acquisition of cerebrospinal fluid in Ganges River monkeyss.In the research,28 Ganges River monkeys were randomly divided into two groups.The monkey in both groups were injected with 30 g/L pentobarbital sodium solution through the left forelimb intravenous after general anesthesia, and were shaved conventionally around the spine and then disinfected.In the experimental group,under the guidance of DSA technology,the puncture was performed from the lumbar intervertebral space to the subarachnoid to collect the cerebrospinal fluid.All the 14 cases were successful.However,in the control group, the puncture was directly performed,8 cases succeeded and 6 cases failed.And then after the adjustment of the position and direction of the needle under the guidance of DSA technology, all the negative cases succeeded.Therefore,all the 28 Ganges River monkeys were successfully punctured under the guidance of DSA technology.In the end,the epidural anesthesia catheter was put through the subarachnoid space to the cisterna magna,and the pump was put on the back.Through the pump, dynamic acquisition of cerebrospinal fluid can be achieved repeatedly and quickly during the awake and full physiological state of Ganges River monkey.Due to sample catheter was placed in the cisterna magna, cerebrospinal fluid is transparent,high quality,and easily meet the needs of the further test, which has the potential practical value.
Ganges River monkey; lumbar puncture; cerebrospinal fluid
2016-09-07
国家高技术研究发展计划项目(863计划)(2012AA020702)
焦 河(1965-),男,四川成都人,主管技师,主要从事DSA影像技术及动物影像技术工作。
S854.78
A
1007-5038(2017)04-0057-05
*通讯作者

