烟草青枯菌Tn5突变体库的构建及突变位点分析
李小杰,李淑君,李成军,陈玉国,王海涛,邱 睿,胡亚静
(河南省农业科学院 烟草研究所,河南 许昌 461000)
烟草青枯菌Tn5突变体库的构建及突变位点分析
李小杰,李淑君*,李成军,陈玉国,王海涛,邱 睿,胡亚静
(河南省农业科学院 烟草研究所,河南 许昌 461000)
为了从烟草青枯菌全基因组范围内发掘致病性相关基因,采用电转化法构建了一个Ez-Tn5转座子介导的烟草青枯菌TXLLJ14-3菌株插入突变体库,该突变体库包含1.2万个突变子,经烟草上的致病性检测,共得到216个无致病力或弱致病力突变菌株。利用TAIL-PCR扩增获得其中15个无致病力烟草青枯菌的Tn5侧翼序列,并对其插入位点进行了分析,结果表明,15个突变菌株的插入位点分别位于核苷酸水解酶、糖基转移酶、转座酶和合成酶等具有不同功能的基因上,这些基因受到干扰或破坏后,可能会抑制致病相关物质的表达或分泌,或者诱导烟草对病原菌产生抗性,从而表现出无致病力特征。
烟草青枯菌; Tn5插入突变; 无致病力菌株; TAIL-PCR; 突变位点
青枯雷尔氏菌(Ralstoniasolanacearum)引起的烟草青枯病是危害世界烟草生产的主要根茎部细菌性病害,目前在河南省信阳、驻马店等夏季高温多雨地区已有发生,其中信阳罗山县,驻马店确山县、遂平县和泌阳县烟区的个别地块烟株发病率较高,达到80%左右,严重的地块出现大面积死亡[1]。青枯雷尔氏菌侵染寄主范围广,可对多种经济作物的生产造成严重危害,且具有明显的生理分化现象和菌系多样性[2-3]。
青枯雷尔氏菌基因组大小约为5.8 Mb,具有很高的G+C含量和约5 120个可能的编码基因。它由3.7 Mb的染色体和2.1 Mb的大质粒组成,主要的致病因子有Ⅱ型蛋白分泌系统(T2SS)、Ⅲ型蛋白分泌系统(T3SS)、胞外多糖(extracellular polysaccharide,EPS)[4]、胞外蛋白(extracellular protein,EXP)[5]、脂 多 糖(lipopolysaccharides,LPS)和Ⅳ型鞭毛系统(type Ⅳ pilus system)等。其中,Ⅱ型和Ⅲ型蛋白分泌系统主要是将多种致病因子由胞内输送到胞外,从而导致寄主植物感病[6-7];Ⅳ型鞭毛系统对细菌在植物表面的附着起重要作用,直接影响青枯菌的致病性[8]。随着基因组测序技术的不断发展,目前已经完成基因组序列测定的雷尔氏菌越来越多,包括烟草青枯菌株系Y45 和FQY_4[9-11],但许多基因的功能还有待于进一步研究,尤其是致病相关基因。
随着分子生物学技术的快速发展,挖掘功能基因的方法越来越多,其中制备突变体是最直接有效的方法。转座子标签(transposontagging)是一种常用的构建突变体库的方法,也是发现新基因和进行基因功能分析的有效工具。20世纪90年代开始,许多研究者通过转座子诱变技术获得了多种类型的青枯菌突变体。康耀卫等[12]利用转座子Tn5在青枯雷尔氏菌基因组单一的eep位点中插入,获得了国际上第1例青枯雷尔氏菌胞外蛋白输出功能缺失突变株。程本亮等[13]利用EZ-Tn5转座子随机插入青枯雷尔氏菌Rs91,构建了青枯雷尔氏菌无致病力突变体库,筛选获得13株具有无致病力菌株形态的突变株。车建美等[14]利用Tn5插入强致病力青枯雷尔氏菌FJAT-91,获得了无致病力突变株FJAT-t582和FJAT-t583,弱化指数均在0.8以上。
本研究拟利用Ez-Tn5转座子标签技术构建烟草青枯菌菌株TXLLJ14-3的插入突变体库,以期获得大量无致病力突变菌株,为烟草青枯菌致病相关基因的挖掘及其与寄主互作机制的研究奠定基础,同时为河南省烟草青枯病的防治提供理论依据。
1 材料和方法
1.1 材料
1.1.1 供试菌株 烟草青枯菌菌株TXLLJ14-3分离自河南省信阳市罗山县烟区,由烟草行业黄淮烟区烟草病虫害绿色防控重点实验室长期保存。
1.1.2 培养基 NA培养基:多聚蛋白胨5 g、酵母提取物1 g、牛肉浸膏3 g、蔗糖10 g、琼脂18 g,加水定容至1 000 mL,121 ℃灭菌20 min。
NB培养基:即不加琼脂的NA培养基。
LB固体培养基:蛋白胨10 g、牛肉膏5 g、氯化钠5 g、琼脂18 g,加水定容至1 000 mL,调pH值至7.0,121 ℃灭菌20 min。
TB甘油培养基:胰蛋白胨10 g、琼脂15 g、氯化钠5 g、甘油250 mL、七水硫酸镁2.46 g,加水定容至1 000 mL,调pH值至7.0,121 ℃灭菌20 min。
TTC培养基:即在NA培养基灭菌后加入0.05%的氯化三苯基四氮唑(TTC)。
1.1.3 主要试剂和仪器 Ez-Tn5TM
1.2 方法
1.2.1 烟草青枯病菌感受态细胞制备及电转化 从新鲜活化的NA平板上挑取单菌落,接种于50 mL NB液体培养基中,28 ℃、180 r /min 振荡培养48 h,按1% 转接到200 mL NB液体培养基中,28 ℃、180 r /min振荡培养一定时间至菌液浓度OD600≈0.7;将菌液置于冰上冷却 10~15 min,随后转移至预冷的50 mL离心管中,4 ℃、6 000 r /min 离心10 min,弃上清,将细胞重悬于预冷的去离子水中,4 ℃、6 000 r/min 离心10 min,重复清洗3 次;再将细胞重悬于预冷的10%甘油溶液中,4 ℃、8 000 r/min离心10 min,重复清洗3 次;最后沉淀用1/1 000 初始菌液体积的预冷10%甘油溶液重悬,以100 μL分装至1.5 mL离心管中,保存于-80 ℃备用。
将1 μL Ez-Tn5转座子和50 μL烟草青枯菌感受态细胞混合,置于预冷的1 mm电击杯中,立即用于转化。电转仪参数设置为:1.8 kV、25 μF、200 Ω。电击后立即加950 μL NB培养液在28 ℃下振荡复苏培养4~6 h。
1.2.2 转化子的筛选与PCR鉴定 将复苏培养的细胞液稀释100倍,取稀释液100 μL涂到含有卡那霉素(Kan,25 μg/mL)的NA培养基上,28 ℃培养2~3 d,筛选具有卡那霉素抗性(Kanr)的转化子,并计算电转化率,计算公式为:转化率(cfu/μg)=克隆数(cfu)/DNA质量(ng)×103。根据Ez-Tn5的Kanr基因设计特异性引物对Kan-F(5′-AAGGTAGCGTTGCCAATGAT-3′)和Kan-R(5′-GCCGTTTCTGTAATGAAGGA-3′),对转化子进行PCR验证。PCR扩增体系为25 μL,扩增条件为:95 ℃ 5 min;94 ℃ 45 s、53 ℃ 40 s、72 ℃ 45 s,28个循环;72 ℃ 10 min;4 ℃保存。用1.0%琼脂糖凝胶电泳检测。
1.2.3 突变菌株的致病性测定 将保存的突变体菌株在NA平板上活化培养,28 ℃培养2~3 d,将菌苔刮下,用无菌水配成108cfu/mL 的菌悬液,采用无针头注射法接种烟草活体叶片进行致病性测定,以烟草青枯病菌野生型菌株为阳性对照,水为空白对照。
1.2.4 TAIL-PCR获取突变体插入位点侧翼序列 根据Ez-Tn5转座子的两端臂结构分别设计3对特异性引物,根据细菌基因组DNA 特点设计4条简并引物(表1),组合后,以新鲜的突变体菌液为模板进行TAIL-PCR。第1轮TAIL-PCR的反应体系是:10 × ExTaqbuffer 2.5 μL、25 mmol/L MgCl22 μL、2.5 mmol/L dNTP 2 μL、20 μmol/L特异性引物SP1 1 μL、20 μmol/L简并引物AD混合物4 μL、ExTaqDNA 聚合酶0.5 μL,加入相应的模板,用去离子水补至25 μL。在第2轮TAIL-PCR中,以第1轮的产物稀释50倍为模板,特异性引物采用SP2,用去离子水补至30 μL,其他与第1轮相同。第3轮以第2轮产物稀释20 倍为模板,特异性引物采用SP3,加入20 μmol/L简并引物AD混合物2 μL,用去离子水补至50 μL,其他与第1轮相同。PCR的条件见表2。对TAIL-PCR第2 轮和第3 轮产物进行电泳检测,然后回收第3 轮与第2 轮TAIL-PCR 大小接近、条带清晰的产物,连接T-载体后,转化大肠杆菌DH5α,在含氨苄青霉素(Amp,100 μg/mL)的LB平板上筛选转化子。
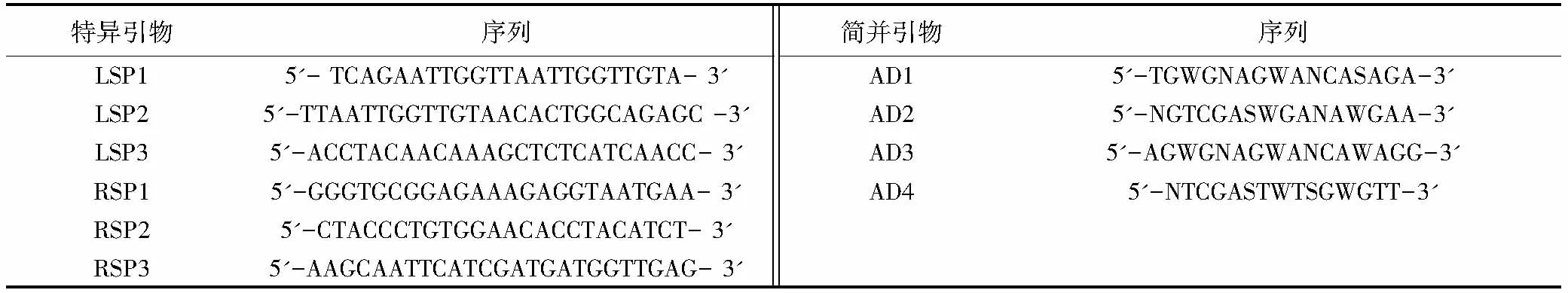
表1 TAIL-PCR所用引物
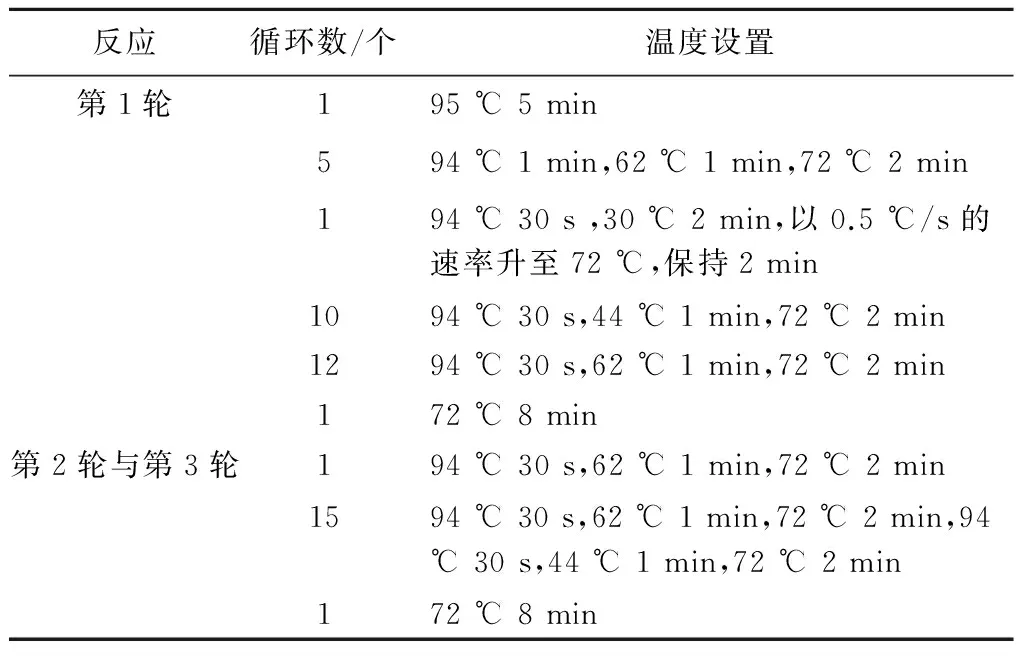
表2 TAIL-PCR反应条件
1.2.5 侧翼序列测定及比对分析 TAIL-PCR扩增获得的侧翼序列由生工生物(上海)公司测序。通过Blastn程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)与青枯病菌基因组进行比对,分析侧翼序列与目的基因的同源性和相关生物学信息。
2 结果与分析
2.1 烟草青枯病菌Tn5插入突变体库的构建
利用Ez-Tn5转座子插入突变技术构建了烟草青枯菌菌株TXLLJ14-3的突变体库,分3次转化共得到了约1.2万个转化子,转化率约为3.8×103cfu/μg。将转化子分别点接于表面铺有灭菌滤膜(孔径为0.22 μm)的TB甘油培养基平板上,-80 ℃冰箱保存备用。
2.2 Tn5插入突变体的分子验证
根据Ez-Tn5的Kanr基因设计特异性引物对Kan-F/Kan-R,对插入突变体进行PCR扩增,均能得到567 bp的目的片段,而野生型菌株中未扩出相应的条带(图1)。将突变体菌株进行划线继代培养4~5代后,PCR检测仍然能够得到相应的目的片段,说明转座子已稳定地插入到突变体基因组中。

M:DL2000 DNA Marker; 1:野生型; 2—16:随机挑选的插入突变体图1 Kanr基因的PCR扩增
2.3 无致病力突变菌株的筛选
通过注射接种烟草叶片,对突变体菌株进行了致病性测定,筛选到无致病力或弱致病力菌株216个。从TTC培养基上的菌落形态(图2)看,野生型菌株菌落表面较湿润,中间呈粉红色,白边较宽,且流动性强,为典型的强致病力青枯菌;无致病力突变体菌株菌落表面较干燥,中间呈暗红色,白边较窄,无流动性。

左图为野生型,右图为部分无致病力突变菌株图2 烟草青枯菌在TTC平板上的菌落形态
2.4 无致病力突变菌株Tn5侧翼序列的获得
根据Ez-Tn5转座子的两侧序列设计了6条特异性引物,其中LSP1—LSP3引物和RSP1—RSP3 引物分别位于转座子的左端和右端臂上,随机与简并引物AD1—AD4进行组合,以筛选出的部分无致病力突变体菌株的菌液为模板,按照表2条件进行TAIL-PCR。电泳结果显示,TAIL-PCR 可有效扩增转座子的侧翼序列,第2轮和第3轮TAIL-PCR 产物大小基本接近(图3)。将第3轮PCR产量较高且与第2轮产物大小接近的TAIL-PCR 产物进行切胶回收,连接T-载体后进行序列测定。测序结果表明,TAIL-PCR 产物序列中均存在Tn5的2个臂端序列和Tn5 插入的青枯菌基因组序列。由此说明,TAIL-PCR可有效鉴别Tn5的插入位点和扩增Tn5转座子的侧翼序列。

上图为第2轮TAIL-PCR电泳结果,下图为第3轮TAIL-PCR电泳 结果。M:DL2000 DNA Marker; 1—19:无致病力突变体菌株图3 部分无致病力突变体菌株的TAIL-PCR电泳结果
2.5 无致病力突变菌株Tn5 插入位点分析
将TAIL-PCR 扩增获得的15个无致病力烟草青枯菌菌株的Tn5侧翼序列进行TA克隆后测序,测序结果在NCBI数据库中进行比对,结果(表3)表明,15个突变菌株的插入位点分别位于核苷酸水解酶、糖基转移酶、转座酶和合成酶等具有不同功能的基因上,这些基因受到干扰或破坏后,可能会抑制致病相关物质的表达或分泌,或者是诱导烟草对病原菌产生抗性,从而表现出无致病力特征。

表3 TAIL-PCR 法获得的Tn5 插入位点及相应的功能基因
3 结论与讨论
与常规的转座子技术相比, Ez-Tn5TM
本研究利用Ez-Tn5TM
[1] 曾强,李小龙,汪莹,等.生物有机肥和土壤调理剂对烤烟生长发育和产、质量的影响[J].河南农业科学,2014,43(11):36-40.
[2] 徐树德,尚志强,秦西云.烟草青枯病研究进展[J].天津农业科学,2010,16(4):49-53.
[3] 卢同.我国作物细菌性青枯菌的研究进展[J].福建农业学报,1998,13(2):33-40.
[4] 王胜坤.桉树青枯菌菌株致病力分化、吸附识别及PCR快速检测研究[D].北京:中国林业科学研究院,2007.
[5] Von Bodman S B,Bauer W D,Coplin D L.Quorum sensing in plant-pathogenic bacteria[J].Annual Review of Phytopathology,2003,41(1):455-482.
[6] Poueymiro M,Genin S.Secreted proteins fromRalstoniasolanacearum:A hundred tricks to kill a plant[J].Current Opinion in Microbiology,2009,12(1):44-52.
[7] 杨军,尹启生,宋纪真,等.植物病原细菌的hrp基因[J].遗传,2005,27(5):852-858.
[8] Kang Y,Liu H,Genin S,etal.Ralstoniasolanacearumrequires type 4 pili to adhere to multiple surfaces and for natural transformation and virulence[J].Molecular Microbiology,2002,46(2):427-437.
[9] Salanoubat M,Genin S,Artiguenave F,etal.Genome sequence of the plant pathogenRalstoniasolanacearum[J].Nature,2002,415:497-502.
[10] Li Z F,Wu S L,Bai X F,etal.Genome sequence of the tobacco bacterial wilt pathogenRalstoniasolanacearum[J].J Bacteriol,2011,193(21):6088-6089.
[11] Cao Y,Tian B Y,Liu Y X,etal.Genome sequencing ofRalstoniasolanacearumFQY_4,isolated from a bacterial wilt nursery used for breeding crop resistance[J].Genome Announcements,2013,1(3):e00125-13.
[12] 康耀卫,黄键中.利用转座子Tn5诱变植物青枯菌获得胞外蛋白输出功能丧失突变体[J].植物病理学报,1994,24(3):265-269.
[13] 程本亮,车建美,刘波.青枯雷尔氏菌Tn5转座子无致病力突变株构建及其生物学特性[J].农业生物技术学报,2011,19(1):26-38.
[14] 车建美,马桂美,刘波,等.青枯雷尔氏菌TN5转座子无致病力突变株插入位点的鉴定与分析[J].福建农业学报,2012,27(11):1231-1236.
[15] Douglasr D,Igor Y G,Willian S,etal.Three dimensional structure of the Tn5 synaptic complex transposition intermediate[J].Science,2000,289:77-85.
Construction of Tn5 Mutant Library ofRalstoniasolanacearumand Analysis of Mutation Sites
LI Xiaojie,LI Shujun*,LI Chengjun,CHEN Yuguo,WANG Haitao,QIU Rui,HU Yajing
(Tobacco Research Institute of Henan Academy of Agricultural Sciences,Xuchang 461000,China)
In order to explore the pathogenic genes from the whole genome range ofRalstoniasolanacearum,this study constructed a Ez-Tn5 transposon insertion mutant library ofR.solanacearumTXLLJ14-3 by electroporation method.The library contained 12 000 mutants.There were 216 non or weak pathogenic mutant strains by the pathogenic detection on tobacco.Tn5 flanking sequences of 15 non pathogenic mutant strains were amplified by TAIL-PCR,and simultaneously,the insertion sites were analyzed.The results showed that the insertion sites of the 15 mutant strains were located at genes with different functions such as nucleotide hydrolases,glycosyltransferases,transposase and synthase.When they were disrupted or destroyed,the expression or secretion of virulence related substances might be inhibited,or tobacco resistance to pathogen be induced,thus showing no pathogenic characteristics.
Ralstoniasolanacearum; Tn5 insertion mutation; non pathogenic strain; TAIL-PCR; mutation site
2016-11-01
河南省基础与前沿技术研究计划项目(152300410142);河南省烟草公司科技项目(HYKJ201407)
李小杰(1983-),女,河南许昌人,助理研究员,博士,主要从事烟草病理研究。E-mail:lixiaojie000631@sina.com
*通讯作者:李淑君(1966-),女,河南焦作人,研究员,硕士,主要从事烟草植保研究及技术推广工作。 E-mail:13603749396@126.com
S435.72
A
1004-3268(2017)04-0080-05

