猪鼻支原体套式 PCR 诊断方法的建立及应用
彭 凌,刘博婷,杨旭夫
(韶关学院 英东生命科学学院/中国农业科学院哈尔滨兽医研究所-韶关学院动物疫病诊断中心联合实验室,广东 韶关 512005)
猪鼻支原体套式 PCR 诊断方法的建立及应用
彭 凌,刘博婷,杨旭夫
(韶关学院 英东生命科学学院/中国农业科学院哈尔滨兽医研究所-韶关学院动物疫病诊断中心联合实验室,广东 韶关 512005)
为建立猪鼻支原体快速诊断方法,根据猪鼻支原体P69基因序列设计2 对引物,建立了猪鼻支原体套式 PCR 诊断方法,对建立的方法进行特异性、敏感性检测,同时进行临床检测。结果表明,应用建立的套式PCR方法对猪鼻支原体DNA的检出限为 1.4×10-5ng/μL,与常见感染猪的细菌、病毒均无交叉反应。利用建立的套式PCR方法对 23 份临床样品进行检测,阳性检出率为73.9%。本研究建立的猪鼻支原体套式PCR具有特异性强、敏感性高等优点,可用于猪鼻支原体的临床诊断。
猪鼻支原体; 套式PCR; 诊断
猪鼻支原体(Mycoplamsahyorhinis)是寄居在猪上呼吸道中的正常菌群,在猪免疫力下降时,能够引起猪关节炎、胸膜炎、腹膜炎、咽鼓管炎等多发性浆膜炎,甚至能够引起猪的肺炎,是引起猪地方性肺炎的重要病原[1-2]。猪鼻支原体一般由大猪或母猪传染给小猪,该病原引起的多发性浆膜炎一般多发生在3~10 周龄小猪,一旦猪群中有感染病例,会很快在猪群中传播。目前,猪鼻支原体的感染在国内外猪群中已经相当普遍[3-5]。越来越多的研究表明,人的一些癌症的发生与体内的猪鼻支原体存在相关性[6-8],这更加引起了国内外学者的广泛关注。
猪鼻支原体引起多发性浆膜炎和多发性关节炎[9-11],临床上易与副猪嗜血杆菌病等多种疾病混淆,使鉴别诊断难度增大,一般以分离到病原体作为确诊依据。但猪鼻支原体的分离培养程序复杂,花费时间长,分离率较低,容易耽误治疗时机,且易出现假阴性结果。因此,急需建立一种敏感、快速的分子生物学诊断方法。鉴于此,本研究探索了猪鼻支原体套式PCR检测技术,以期为快速诊断与预防猪鼻支原体的感染提供重要的技术手段。
1 材料和方法
1.1 菌株
猪鼻支原体 CVCC361 标准菌株购自北京豫鼎鑫捷科技有限公司,副猪嗜血杆菌(Hps)、猪传染性胸膜肺炎放线杆菌(App)、猪链球菌(SS)、猪肺炎支原体(Mhp)、猪瘟病毒(CSFV)、猪流感病毒(SIV)、猪圆环病毒(PCV)由韶关学院动物疫病诊断中心联合实验室保存。
1.2 试剂
DNA提取试剂盒、TaqDNA酶、dNTP、DL5000 DNA Marker购自北京艾德莱生物科技有限公司。
1.3 引物
根据 GenBank 公布的猪鼻支原体P69基因序列,采用引物设计软件(Oligo 7)设计 2 对引物,其中,外套引物 P1、P2的扩增长度为 1 295 bp,内套引物 P3、P4 的扩增长度为 871 bp。引物序列如下, P1:5′-CTATTCGTTATTGTGCCTTGGG-3′、P2:5′-TTCTGTTCTTTCTCCTGCTTGG-3′;P3:5′-AGAAAGCAACATTCGCTGAACCAC-3′、P4:5′-TAATAAAGACCCGCCAACTGAACCT-3′,均由生工生物工程(上海)股份有限公司合成。
1.4 DNA提取
分别用细菌和病毒基因组 DNA 提取试剂盒提取猪鼻支原体和其他菌株或毒株的基因组。待检病料经研磨、煮沸10 min 后离心,上清作为模板。
1.5 套式 PCR 反应方法
第 1 次PCR反应体系:10×PCR Buffer(Mg2+Free)2.5 μL,25 mmol/L MgCl22.0 μL,2.5 mmol/L dNTP 2.0 μL,TaqDNA聚合酶0.2 μL,10 μmol/L上、下游引物各 0.5 μL,猪鼻支原体DNA模板提取液 1 μL,灭菌超纯水补至总体积 25 μL。反应程序经优化确定为:95 ℃ 预变性2 min;94 ℃ 变性30 s,56 ℃ 退火30 s, 72 ℃ 延伸1 min,30 个循环;72 ℃ 延伸 10 min。再以第 1 次PCR扩增产物为模板(生理盐水为空白对照),采用同样条件用内套引物进行第 2 次 PCR 扩增[12]。扩增产物采用 1%琼脂糖进行电泳检测。
1.6 特异性试验
以猪肺炎支原体、副猪嗜血杆菌、猪传染性胸膜肺炎放线杆菌、猪链球菌、猪瘟病毒、猪流感病毒、猪圆环病毒的基因组 DNA 或 cDNA 为模板,采用相同的引物和反应条件进行套式 PCR 扩增,检测方法的特异性。
1.7 敏感性试验
测定前述方法提取的猪鼻支原体的基因组DNA含量,用灭菌蒸馏水进行101—1010倍倍比稀释,分别以这10 个梯度稀释的DNA作为模板,按上述的套式PCR方法进行 2 次扩增,采用 1%琼脂糖进行电泳检测2 次扩增产物,从而确定反应的敏感性。
1.8 套式 PCR 方法对临床样品的检测
应用建立的套式 PCR 方法对粤北地区采集的 23 份猪肺组织样品进行检测,以检验建立的套式PCR诊断方法的临床应用效果。
2 结果与分析
2.1 特异性试验结果
特异性试验结果(图1、图2)显示,第1次和第2次 PCR分别只能扩增出猪鼻支原体大小为 1 295 bp和 871 bp 的片段,与预期大小相符。而其他对照细菌、毒株均未扩增出目的片段,表明建立的套式 PCR 诊断方法特异性好。

M:DL5000 DNA Marker; 1:猪鼻支原体; 2:猪肺炎支原体; 3:副猪嗜血杆菌; 4:猪传染性胸膜肺炎放线杆菌; 5:猪链球菌; 6:猪瘟病毒; 7:猪流感病毒; 8:猪圆环病毒; 9:空白对照。图2同图1 第1次PCR特异性试验结果
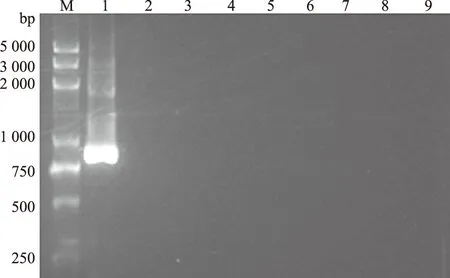
图2 第2次PCR特异性试验结果
2.2 敏感性试验结果
从猪鼻支原体菌液中提取DNA,质量浓度为14 ng/μL。 敏感性试验结果如图3、图4所示,第1次PCR扩增产物检测极限为 0.14 ng/μL,而第2次PCR扩增产物检测极限为1.4×10-5ng/μL。套式 PCR 检测的敏感性是普通PCR 的104倍,表明该套式 PCR 检测方法具有很高的敏感性。
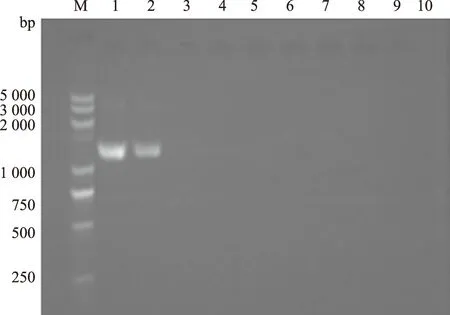
M:DL5000 DNA Marker; 1—10分别表示猪鼻支原体DNA 稀释倍数依次为101—1010。图4同图3 第1次PCR 的敏感性试验结果
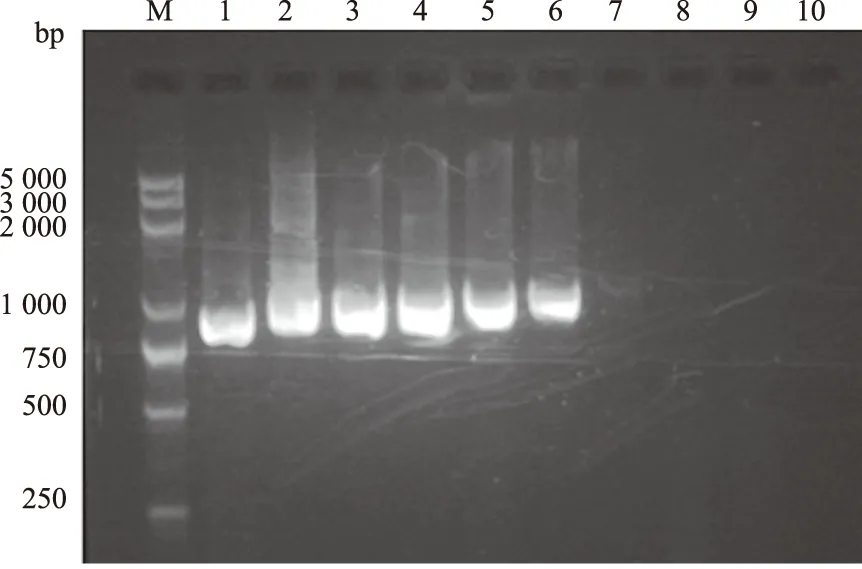
图4 第2次PCR 的敏感性试验结果
2.3 临床样品检测结果
利用建立的猪鼻支原体套式 PCR 诊断方法共检测了 23 份临床疑似猪鼻支原体感染的病料,检出阳性病料样品 17 份,阳性检出率为73.9%。
3 结论与讨论
鉴于猪鼻支原体对规模化养殖场具有极大危害,为防控该病,有必要加强对该病原的快速、准确诊断。由于猪鼻支原体的分离培养程序复杂,花费时间长,分离率较低,且易出现假阴性结果。因此,通过分离鉴定来确诊猪鼻支原体存在弊端,常规分离鉴定方法并不适合该病的快速准确诊断。免疫学检测及分子生物学检测常用于猪鼻支原体的诊断,如陈冬杰等[13]建立的猪鼻支原体抗体间接ELISA检测方法,可以检测血清中猪鼻支原体的抗体水平,具有较高的特异性和敏感性。 PCR 方法具有特异性强、灵敏度高的特点,常被应用于猪鼻支原体早期感染的检测,具有常规分离诊断方法无法比拟的优势。但Makhanon 等[14]研究表明,猪鼻支原体普通单套 PCR 的敏感性较低,不能满足临床样品检测的要求。本研究根据GenBank上已收录的猪鼻支原体P69基因序列,设计合成2 对引物,经过 PCR 反应条件的优化,建立了猪鼻支原体的套式 PCR快速诊断方法。检测结果显示,对照菌株的扩增结果均为阴性;第1次 PCR 检测的灵敏度为0.14 ng/μL,而第2次PCR 检测的灵敏度达到1.4×10-5ng/μL,表明该套式 PCR 诊断方法具有很高的敏感性。由于套式 PCR 方法检测的敏感性远高于普通 PCR,甚至可与荧光定量 PCR 方法相当,而所用设备、试剂与普通 PCR一样,不需要荧光定量 PCR 检测方法所要求的特殊设备与试剂,更适合基层使用。
本研究建立的套式 PCR 诊断方法具有良好的准确性、特异性、敏感性,并且待检病料不需繁杂的DNA提取过程,只需研磨、煮沸后直接检测,可以在短时间内快速检测出低含量的猪鼻支原体,为猪鼻支原体的快速检测及早期发现和治疗奠定了基础。
[1] Lin J H,Chen S P,Yeh K S,etal.Mycoplasma hyorhinis in Taiwan:Diagnosis and isolation of swine pneumonia pathogen[J].Vet Microbiol,2006,115(1/2/3):111-116.
[2] 王占伟,熊琪琰,邵国青.猪鼻支原体与猪地方性肺炎[J].中国人兽共患病学报,2012,28(10):1036-1038.
[3] 杨丹,曹允考.猪鼻支原体致病性研究进展[J].畜牧兽医科技信息,2014(8):13-14.
[4] Lobo E,Poveda C,Suarez A,etal.Mycoplasmas hyorhinis in different regions of Cuba:Diagnosis[J].Braz J Microbiol,2011,42(2):721-725.
[5] 章红兵.猪场应重视猪鼻支原体感染[J].养猪,2016(2):111-112.
[6] Ketcham C M,Anai S,Reutzel R,etal.p37 induces tumor invasiveness[J].Mol Cancer Ther,2005,4(7):1031-1038.
[7] Namiki K,Goodison S,Porvasnik S,etal.Persistent exposure to mycoplasma induces malignant transformation of human prostate cells[J].PLoS One,2009,4(9):e6872.
[8] 曹军,李建平,程伟,等.猪鼻支原体P40 蛋白在肾癌组织中的表达及意义[J].西安交通大学学报(医学版),2008,29(5):556-558,565.
[9] 初振华.猪鼻支原体引起的多发性浆膜炎和关节炎的防制措施[J].畜牧兽医科技信息,2007(9):55.
[10] 王桂昌.猪鼻支原体引起的多发性浆膜炎和关节炎的防治[J].农村实用科技信息,2008(8):28.
[11] 余秋阳.一例猪鼻支原体引起的多发性浆膜炎病的分析及防治措施[J].山东畜牧兽医,2013(3):25-26.
[12] 李和平,吴发兴,李晓成,等.猪繁殖与呼吸综合征的套式PCR方法建立及应用[J].华北农学报,2009,24(1):115-118.
[13] 陈冬杰,危艳武,张志慧等.猪鼻支原体抗体间接ELISA检测方法的建立及应用[J].中国兽医科学2014,44(11):1140-1144.
[14] Makhanon M,Tummaruk P,Thongkamkoon P,etal.Comparison of detection procedures ofMycoplasmahyopneumoniae,Mycoplasmahyosynoviae,andMycoplasmahyorhinisin lungs,tonsils,and synovial fluid of slaughtered pigs and their distributions in Thailand[J].Trop Anim Health Prod,2012,44(2):313-318.
Establishment and Application of Nested PCR Assay for Detection ofMycoplamsahyorhinis
PENG Ling,LIU Boting,YANG Xufu
(Yingdong College of Life Science,Shaoguan University/Joint Laboratory of Animal Infectious Diseases Diagnostic Center-Harbin Veterinary research Institute of Chinese Academy of Agriculture Science,Shaoguan 512005,China)
In order to develop a rapid detection mehthod forMycoplamsahyorhinis,two pairs of primers were designed according to theP69 gene sequence ofMycoplamsahyorhinisin the study,and the nested PCR method forMycoplamsahyorhinisdetection was established.And then the specifity,sensitivity and clinical tests were carried out.The results showed that the sensitivity of the assay was reached to 1.4×10-5ng/μL,and the detection method had no cross reaction with common bacterium and virus DNA from pig.In addition,twenty-three clinical specimens were detected by the nested PCR assay and the results demonstrated the positive rate was 73.9%.The nested PCR assay established in this study had the advantages of high specificity and high sensitivity,and could be used in clinical diagnosis ofMycoplamsahyorhinis.
Mycoplamsahyorhinis; nested PCR; detection
2016-11-10
韶关市科技计划资助项目(2014CX/K294);粤北生猪生产及疫病防控协同创新发展中心资助项目;广东省公益研究与能力建设专项资金资助项目(2014A020208140)
彭 凌(1975-),男,江西奉新人,副教授,硕士,主要从事动物疫病防控、病原学及分子流行病学研究。 E-mail:penglingfx@126.com
S852.62
A
1004-3268(2017)04-0121-03

