液相色谱-串联质谱法检测血清中15种甾体激素的动态变化
童鸿斌, 童海江, 卢德赵*
(1. 浙江中医药大学, 浙江 杭州 310053; 2. 绍兴第二医院检验科, 浙江 绍兴 312000)
研究论文
液相色谱-串联质谱法检测血清中15种甾体激素的动态变化
童鸿斌1, 童海江2, 卢德赵1*
(1. 浙江中医药大学, 浙江 杭州 310053; 2. 绍兴第二医院检验科, 浙江 绍兴 312000)
建立了用液相色谱-串联质谱检测血清中15种甾体激素的方法。在血清样品中加入含内标的乙腈沉淀蛋白质后,用100 mmol/L盐酸羟胺衍生,经Agilent-C18柱(50 mm×3.0 mm, 2.7 μm)分离,内标法定量。质谱分析采用电喷雾电离(ESI)正离子扫描,多反应监测(MRM)模式检测。数据显示,13种激素在0.05~20 ng/mL范围内线性关系良好(相关系数(R2)不小于0.995 6),检出限不大于1 ng/mL;皮质醇及脱氢表雄酮硫酸酯在50~2 000 ng/mL范围内线性关系良好(R2不小于0.997 9),检出限不大于0.5 ng/mL。将该方法应用于女性月经周期激素变化规律的研究,结果表明,15种甾体激素在一个完整的月经周期内有不同特征的动态变化,其中雄激素在滤泡期的后期达到最高值,孕(雌)激素在黄体期达到最高值,而皮质激素则波动不明显。该方法灵敏度高、重复性好,为临床诊疗提供了参考。
液相色谱-串联质谱;激素;月经周期
女性的体内激素水平不仅与生殖息息相关[1,2],其失衡还与高雄激素血症及肾上腺酶失活等多种疾病具有紧密的联系[3,4]。然而,由于激素水平受到个体差异及物理、病理等因素的影响[5],因此难以对其进行准确衡量。此外,女性体内的激素还受到生理周期的影响,如雌二醇及孕酮在女性月经周期内具有显著的波动[6],且卵巢周期性分泌的激素水平与乳腺生理性结构改变相关[7]。然而,激素水平的波动直接影响临床诊断结果的判断,何时对女性体内各种激素进行检测是一个非常重要的科学问题[8]。
目前的研究表明,虽有对女性周期内激素如黄体生成激素、卵泡生成激素、雌二醇及孕酮等在月经周期内波动变化的报道,然而研究的激素种类有限[8-10]。同时,这类研究大部分是基于酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)或者放射免疫分析(radioimmunoassay, RIA)等间接检测方法[10-13]。已有多篇报道指出,间接检测方法由于受到基质效应、交叉反应等影响[14-16],相较于GC-MS、LC-MS等方法,检测值明显偏高[17]。另外,间接方法的检测结果还受到试剂盒品牌的影响[14],导致不同医院之间的结果不完全一致,造成了一定的资源浪费。
HPLC、GC-MS等方法是近年来开发的检测更为灵敏、检出限更低的方法,其虽然能够检测体内的激素,然而这两类方法在样本前处理上比较复杂。另外,激素本身低挥发性的化学特性也限制了GC-MS的应用。相较于GC-MS, LC-MS不仅更加适用于分析难挥发性物质,同时兼具分离速度快、结果重复性高和检测灵敏度高等特点,近年来在激素检测方面应用较为广泛。Keelan等[18]运用LC-MS/MS方法检测了1 415例单胎妊娠新生儿脐带血中的雄激素水平,发现该类样本中雄激素受到胎儿、母体及产科相关其他因素的影响。周雪妍等[19]开发了血清中雌酮、雌二醇的LC-MS检测方法,并应用该方法对不同月经周期状态下的雌酮和雌二醇进行测定。Haring等[20]及Damgaard-Olesen等[21]则主要进行了男性血清中激素的研究。Keefe等[22]比较了月经周期内多囊卵巢综合征(polycystic ovary syndrome, PCOS)患者与正常人13种激素水平的差异,但是,该研究并未阐明女性月经周期内甾体激素的变化情况。目前,也未见其他较全面的关于女性月经周期甾体激素的相关报道。
本研究开发了一种同时检测人体血清中15种甾体激素的LC-MS检测方法,对女性周期内的激素进行了全面的检测,以期确立女性激素检测的合理时间窗口,并为临床研究提供基础。
1 实验部分
1.1 仪器与材料
Agilent 1290液相色谱仪,Agilent 6495质谱仪(美国Agilent公司)。
睾酮(testosterone, T)、孕酮(progesterone, P4)、17α-羟孕酮(17α-hydroxyprogesterone, 17-OHP)、皮质醇(cortisol, CORT)、11-脱氧皮质醇(11-deoxycortisol, S)、皮质酮(corticosterone, F)、雄烯二酮(androstenedione, Adione)、还原胆烷醇酮(etiocholanolone, Etio)、脱氧皮质酮(deoxy-corticosterone, DOC)、二氢睾酮(dihydrotestosterone, DHT)、脱氢表雄酮(dehydroepiandrosterone, DHEA)、雄酮(androsterone, Andro)、孕烯醇酮(pregnenolone, P5)、雌酮(estrone, E1)、脱氢表雄酮硫酸酯(dehydroepiandrosterone sulfate, DHEAS)购自Sigma Aldrich(德国); d3-T、d9-P4、d8-17-OHP、d4-F、d3-DHT、d6-DHEA、d4-E1及d6-DHEAS购自Toronto Research Chemicals Inc公司(加拿大)。HPLC纯的甲醇、乙腈购自Merck公司(德国);其他试剂为分析纯,购自国药集团(上海)。实验用水为去离子水(CNW公司)。
1.2 含内标沉淀剂及标准溶液的配制
含内标沉淀剂:取适量同位素标准品溶于乙腈配制成高浓度混合内标储备液,于-20 ℃下保存,用时将储备液用乙腈稀释成含内标沉淀剂,其中,d3-T、d9-P4、d8-17-OHP的质量浓度为2 ng/mL; d4-F、d3-DHT、d6-DHEA、d4-E1、d6-DHEAS的质量浓度分别为50、3、6、0.1、500 ng/mL。
标准品溶液的配制:准确称取13种激素(除CORT及DHEAS)标准品100 mg,分别用甲醇定容至10 mL,再混合成各激素均为10 μg/mL的标准储备液;根据实际样本的情况,CORT及DHEAS需要配制到较高浓度,因此这2种化合物的混合标准储备液单独配制,其质量浓度为10 μg/mL;所有储备液都保存于-20 ℃,存放时间不超过6个月。分别取适量标准储备液,用甲醇分别定容至1 mL,得到不同质量浓度的参比溶液(R1~R6)。其中,13种激素(除CORT及DHEAS)的质量浓度分别为0.05、0.5、2、5、10、20 ng/mL; CORT及DHEAS的质量浓度分别为50、200、300、600、1 000、2 000 ng/mL。
1.3 样本采集及前处理
血清采集自2015年9~10月25例年龄为22~47周岁的女性志愿者,其中20~25岁13例,26~30岁6例,大于30岁6例。各年龄段的身体质量指数(BMI)计算通过体重(kg)除以高度(m)的平方获得,其数值分别为20.98±0.31、21.62±0.50及21.67±0.45。排除标准:吸烟史、酗酒史、正在减肥者、内分泌紊乱者以及参与高强度体育锻炼者。研究从女性月经来潮第一天开始计算,从第3天开始每3天进行一次血样采集,共采集样本10次。将采集的样本离心,取血清分装后保存于-80 ℃,统一分析。
分析时,血清于4 ℃下解冻,涡旋混匀后取150 μL于1.5 mL离心管中,加入600 μL含内标沉淀剂,超声2 min,涡旋震荡30 s;混合液在4 ℃下以15 000 r/min离心10 min,取上清液700 μL冻干;将其复溶于50 μL 100 mmol/L盐酸羟胺水溶液中,60 ℃水浴衍生30 min,离心后取上清液供LC-MS分析。每个实际样本中取50 μL,混匀后作为质控(QC)样本用于监控分析序列的重复性和稳定性,每10个测试样品插入一个QC样本,预处理方法同上。
1.4 色谱-质谱条件
色谱条件:色谱柱为Agilent-C18柱(50 mm×3.0 mm, 2.7 μm)(美国Agilent公司)。柱温为35 ℃,进样量为5 μL。流动相为0.1%(v/v)甲酸水溶液(A)和乙腈(B),流速0.4 mL/min。梯度洗脱程序:0~7 min, 90%A~5%A; 7~10 min, 5%A~70%A; 10~10.1 min, 70%A~90%A,并保持至14 min。
质谱条件:ESI正离子模式,多反应监测(MRM)模式。质谱离子化参数:喷嘴压力344.74 kPa (50 psi); 干燥气(N2)流速18 L/min;鞘气温度380 ℃;鞘气流速11 L/min;离子源温度250 ℃;喷雾电压5.5 kV。各激素的碰撞电压(collision energy, CE)见表1。
1.5 数据采集与处理
各个激素的峰面积通过MassHunter Quantitative Analysis软件(美国Agilent公司)进行积分得到,采用内标法,以参比溶液R1~R6构建标准曲线,血清中各种激素的定量结果根据内标法计算得到。由于激素的绝对含量存在较大的个体差异,以每个人在月经周期内单个激素的总量进行归一化计算,以百分含量进行下一步数据处理。
实验数据聚类分析采用MeV4.9.0软件(美国Dana-Farber Cancer Institute),多元统计分析采用SIMCA-P 13.0软件(瑞典Umetrics公司)。单变量统计分析采用GraphPad Prism 6.01软件(美国GraphPad Software公司)。

表 1 15种甾体激素的保留时间和质谱条件
T: testosterone; P4: progesterone; 17-OHP: 17α-hydroxyprogesterone; CORT: cortisol; S: 11-deoxycortisol; F: corticosterone; Adione: androstenedione; Etio: etiocholanolone; DOC: deoxy-corticosterone; DHT: dihydrotestosterone; DHEA: dehydroepiandrosterone; Andro: androsterone; P5: pregnenolone; E1: estrone; DHEAS: dehydroepiandrosterone sulfate. *Quantitation ion.
2 结果与讨论
2.1 流动相的选择
激素易溶于甲醇、乙腈等有机溶剂,首先分别考察了甲醇和乙腈作为B相溶剂时的分离效果,结果发现,乙腈分离杂质峰少,分离效果优于甲醇。比较了0.1%(v/v)甲酸水、0.1%(v/v)乙酸水和10 mmol/L乙酸铵溶液(pH=2.0)3种不同pH水相溶液与乙腈组合的流动相体系的分离效果和灵敏度,结果发现,当A相为0.1%(v/v)甲酸水溶液时,15种激素的分离效果和灵敏度最优。因此,流动相确定为(A)0.1%(v/v)甲酸水溶液和(B)乙腈。1.4节条件下的MRM色谱图见图1。
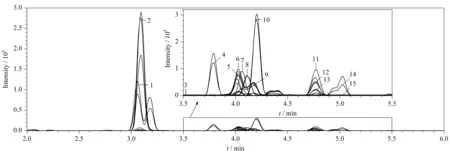
图 1 15种甾体激素标准品的色谱图Fig. 1 Chromatograms of the 15 steroid standards1. DHEAS; 2. CORT; 3. F; 4. S; 5. DHEA; 6. DOC; 7. E1; 8. Adione; 9. 17-OHP; 10. T; 11. Andro; 12. Etio; 13. DHT; 14. P4; 15. P5.
2.2 方法学评价
2.2.1 标准曲线与线性范围
本实验以内标法进行定量。将待测样本中检测到的各激素的峰面积与其相对应的同位素内标的峰面积之比(Y)对样本中各激素的质量浓度(X,ng/mL)进行线性回归,得到各激素的线性方程。13种激素在0.05~20 ng/mL范围内线性关系良好(相关系数(R2)≥0.995 6), CORT及DHEAS在50~2 000 ng/mL范围内线性关系良好(R2>0.9979)。按3倍信噪比计算,检出限均小于1 ng/mL(见表2)。
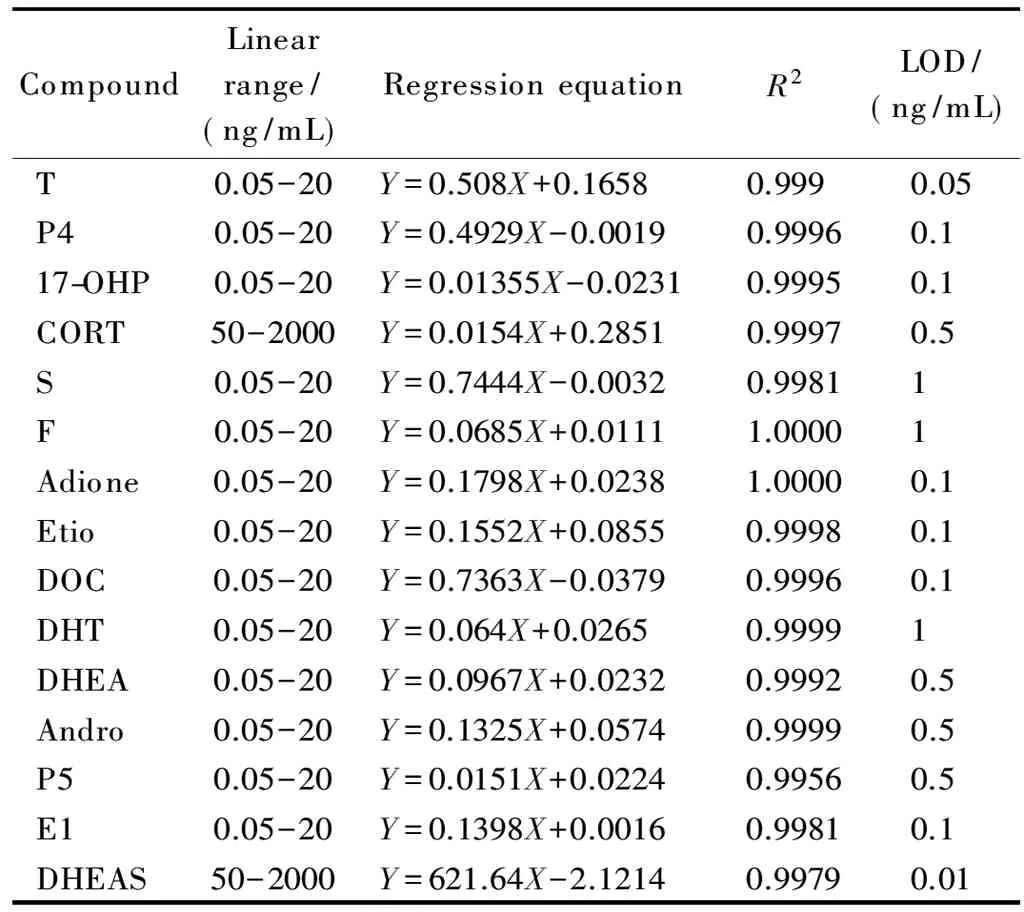
表 2 15种目标物的线性范围、回归方程、相关系数和检出限
Y: peak area ratio of analyte to internal standard;X: mass concentration, ng/mL.
2.2.2 精密度和回收率
计算同一天内的6份平行QC样本的相对标准偏差(RSD),将其作为日内精密度;连续测试3天、每天3份平行QC样本,计算9个测试结果的RSD,作为日间精密度。15种甾体激素的日内精密度≤18.36%,日间精密度≤16.03%(见表3)。
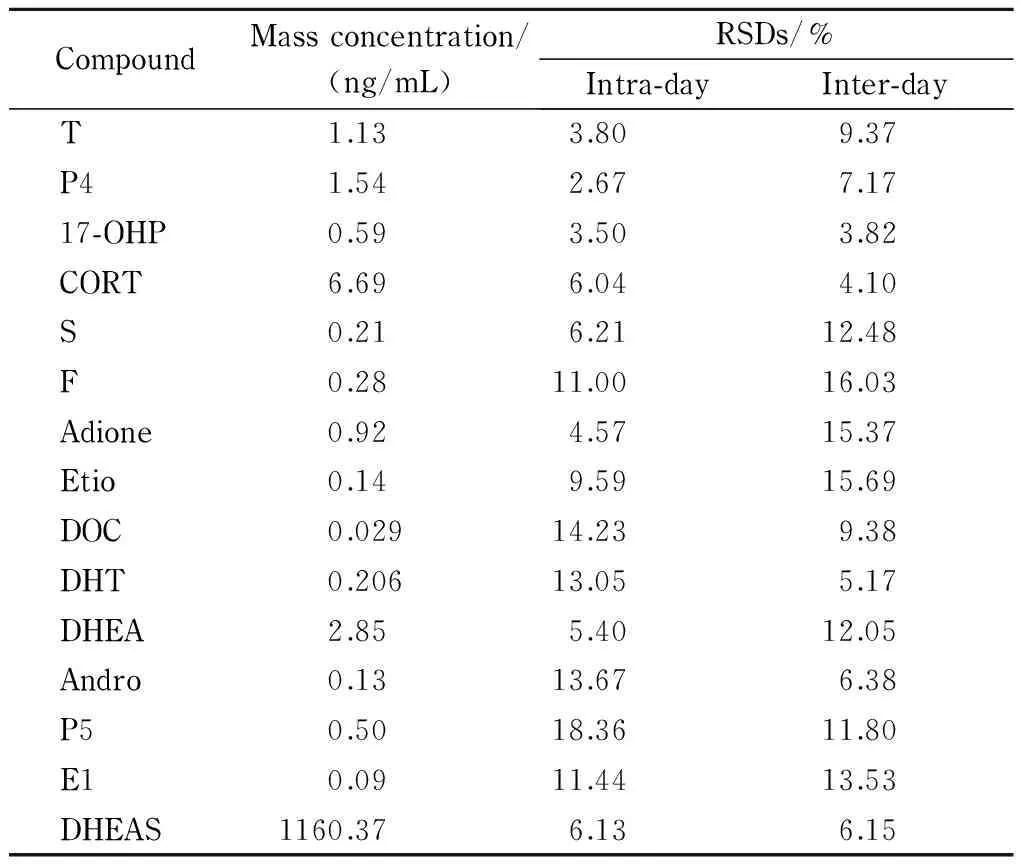
表 3 15种甾体激素的日间和日内精密度
同时,在空白胎牛血清中分别添加按照人体血液样本浓度范围的高、中、低3种不同质量浓度的标准溶液,其中CORT和DHEAS加标质量浓度为200、600、1000 ng/mL,其余13种激素加标质量浓度为0.5、2、10 ng/mL。所获得的检测结果扣除本底之后与加入量对比,进行方法回收率的验证,回收率在75%~112%。
2.3 女性月经周期内激素水平变化规律研究
2.3.1 滤泡期及黄体期激素水平的比较
采用偏最小二乘判别分析(PLS-DA)对第6天(滤泡期)及第24天(黄体期)激素归一化数据进行分析,研究这两个月经周期的激素差异。得分图和载荷图见图2,主成分数为2,R2Y和Q2为0.597和0.406,采用交叉验证,R2Y和Q2的截距分别为0.159和-0.223,表明模型没有过拟合。从得分图可以看出,这两个时期的激素水平存在显著的差异。载荷图则表明,黄体期P4、17-OHP、P5、DOC及E1等激素含量较滤泡期显著上升。这说明这些激素在黄体期都呈现了不同程度的升高,与之前报道的结果一致[10,16,23]。
2.3.2 激素的周期性变化规律研究
对整个月经周期的激素数据采用MeV基于皮尔森相关系数进行分层聚类分析,结果见图3。性质相近的激素具有较为相似的变化规律,如孕激素P4与17-OHP、皮质激素CORT与S、雄激素T与Adione具有较好的相关性,而这些变化类似的激素在甾体激素代谢通路中处于连续并相邻的位置[23]。
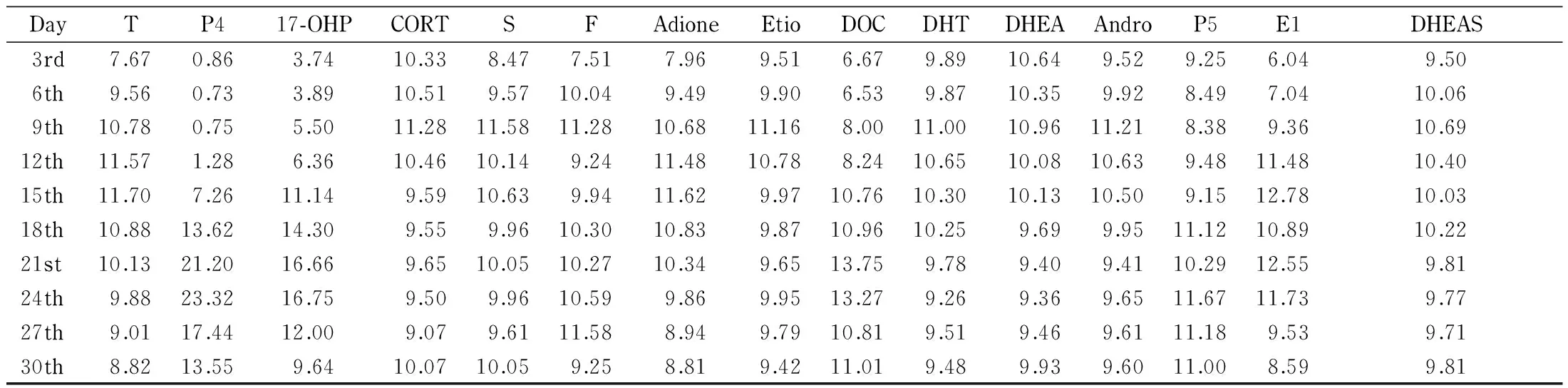
表 4 生理周期内激素百分含量的动态变化(n=15)

图 2 滤泡期及黄体期激素的PLS-DA(a)得分图及(b)载荷图Fig. 2 (a) Score plot and (b) loading plot of partial least squares-discriminant analysis (PLS-DA) in follicular phase and luteal phase

图 3 15种甾体激素的聚类关系图Fig. 3 Plot of hierarchical clustering of the 15 steroids
15种激素的百分含量均值(RSD: 3.58%~25.41%)在一个完整的周期内都有不同特征的动态变化(见表4),15种激素在生理周期内达到最高值及最低值的时间也有所不同。
结合图3的聚类分析结果可以看出不同类型的激素在月经周期内存在共性的变化规律,进一步选取了性激素T、孕激素P4及皮质激素S的均值进行周期性分析(见图4)。可以发现,雄激素在滤泡期的后期(第12~15天)达到最高值,孕(雌)激素在黄体期(第21~24天)达到最高值,而皮质激素则波动不明显。
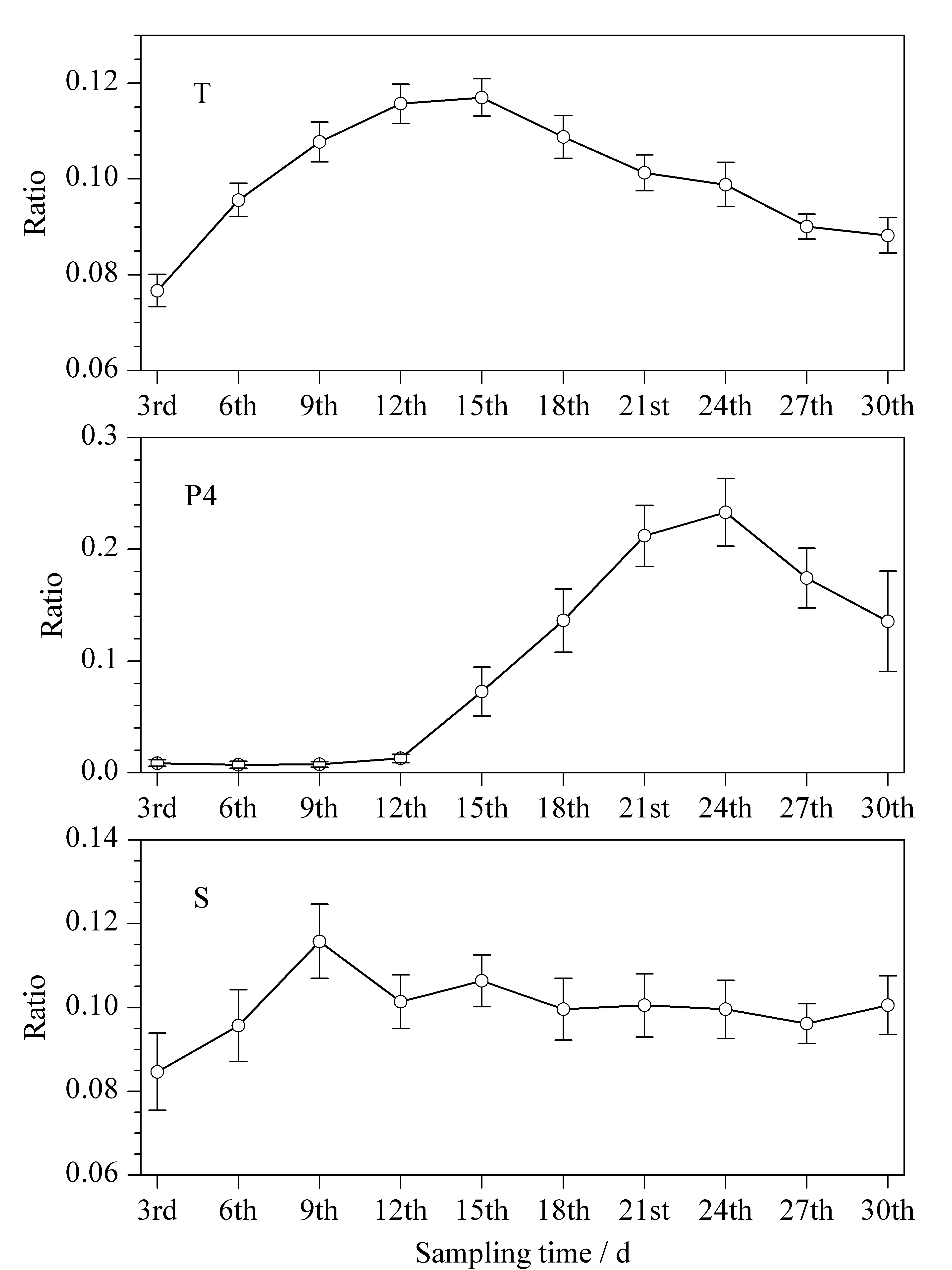
图 4 T、P4及S在女性月经周期内的波动(n=25)Fig. 4 Changes of T, P4 and S during a menstrual cycle of women (n=25)
激素含量随月经有周期性的变化,采样时间点的差异可能导致较大的变异,针对不同的激素选择在其波动最小时间段内进行检测,则可能获得较为稳定的检测结果。月经周期内激素含量波动情况通过计算 |Xn-Xn-1|+ |Xn+1-Xn|(采样顺序号n=2,3…,9;X为检测结果归一后的百分含量)进行比较,获得在6天内波动最小时间点。结果表明, 17-OHP、DOC、DHT的波动最小时间范围为第3天左右;P4的波动最小时间范围为第6天左右;CORT、Etio的波动最小时间范围为第18天左右;S和F的最小波动时间范围为第21天左右;DHEA、DHEAS的波动最小时间范围为第24天左右; T、Adione、Andro、P5及E1的波动最小时间范围为第30天左右。
3 结论
本研究建立了同时测定血液中15种甾体激素的LC-MS分析方法。该方法具有灵敏度高、重复性好等优点。同时,通过对女性月经周期内激素波动变化的分析,确定了15种甾体激素在周期内发生的规律性波动,为临床女性激素检测及研究提供实验依据。
[1] Mihm M, Gangooly S, Muttukrishna S. Anim Reprod Sci, 2011, 124(3/4): 229
[2] Yang X S. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2015, 24(18): 153
杨喜顺. 中国民族民间医药, 2015, 24(18): 153
[3] Kushnir M M, Blamires T, Rockwood A L, et al. Clin Chem, 2010, 56(7): 1138
[4] Li D J, Ma N, Guo Y L. Journal of Practical Gynecologic Endocrinology, 2015, 2(5): 81
李大菊, 马娜, 郭玉灵. 实用妇科内分泌杂志, 2010, 2(5): 81
[5] Dasharathy S S, Mumford S L, Pollack A Z, et al. Am J Epidemiol, 2012, 175(6): 536
[6] Lynch W J, Sofuoglu M. Exp Clin Psychopharmacol, 2010, 18(6): 451
[7] Zhou Y Z, Jiang Y X, Sun Q, et al. Acta Academiae Medicinae Sinicae. 2001, 23(6): 609
周远征, 姜玉新, 孙强, 等. 中国医学科学院学报, 2001, 23(6): 609
[8] Howards P P, Schisterman E F, Wactawski-Wende J, et al. Am J Epidemiol, 2009, 169(1): 105
[9] Brink H V, Robertson D M, Lim H, et al. J Clin Endocrinol Metab, 2015, 100(12): 4553
[10] Roos J, Johnson S, Weddell S, et al. Eur J Contracept Reprod Health Care, 2015, 20(6): 438
[11] Behre H M, Kuhlage J, Gassner C, et al. Hum Reprod, 2000, 15(12): 2478
[12] Key T J, Appleby P N, Reeves G K, et al. Br J Cancer, 2011, 105(5): 709
[13] Versura P, Giannaccare G, Campos E C. Curr Eye Res, 2015, 40(2): 162
[14] Benton S C, Nuttall M, Nardo L, et al. Clin Chem, 2011, 57(7): 1074
[15] Thienpont L M, Uytfanghe K V, Blincko S, et al. Clin Chem, 2008, 54(8): 1290
[16] Rothman M S, Carlson N E, Xu M, et al. Steroids, 2011, 76(1/2): 177
[17] Santen R J, Lee J S, Wang S, et al. Steroids, 2008, 73(13): 1318
[18] Keelan J A, Mattes E, Tan H, et al. PLoS One, 2012, 7(8): e42827
[19] Zhou X Y, Chen R G, Wei Q L, et al. Chinese Journal of Clinical Laboratory Science, 2015, 33(5): 328
周雪妍, 陈仁国, 魏群利, 等. 临床检验杂志, 2015, 33(5): 328
[20] Haring R, Schurmann C, Homuth G, et al. PLoS One, 2015, 10(5): e0127466
[21] Damgaard-Olesen A, Johannsen T H, Holmboe S A, et al. Clin Chim Acta, 2016, 454: 82
[22] Keefe C C, Goldman M M, Zhang K, et al. PLoS One, 2014, 9(4): e93805
[23] Fanelli F, Gambineri A, Belluomo L, et al. J Clin Endocrinol Metab, 2013,98(7): 3058
[24] Wikipedia: 17β-Hydroxysteroid Dehydrogenase. [2016-11-12]. https://en.wikipedia.org/wiki/17%CE%B2-Hydroxysteroid_dehydrogenase
Monitoring of dynamic changes of 15 steroids in serum by liquid chromatography-tandem mass spectrometry
TONG Hongbin1, TONG Haijiang2, LU Dezhao1*
(1.ZhejiangChineseMedicalUniversity,Hangzhou310053,China;2.DepartmentofClinicalLaboratory,theSecondHospitalofShaoxing,Shaoxing312000,China)
A liquid chromatography-tandem mass spectrometry (LC-MS/MS) method was developed for the determination of 15 steroids. Acetonitrile containing internal standard was added to the serum samples to precipitate the proteins. Then the derivatization of the samples was conducted with 100 mmol/L hydroxylamine hydrochloride. The separation of the samples was performed on an Agilent-C18 column (50 mm×3.0 mm, 2.7 μm), and quantified with internal standard method. The steroids were determined by multiple-reaction monitoring (MRM) with electrospray ionization (positive mode) MS. The 13 steroids showed linear relationships from 0.05 to 20 ng/mL (R2≥0.995 6) with limits of detection no more than 1 ng/mL; cortisol and dehydroepiandrosterone sulfate showed linear relationships from 50 to 2 000 ng/mL (R2≥0.997 9) with limits of detection less than 0.5 ng/mL. The method was used for the monitoring of the dynamic changes of steroids in a menstrual cycle of women. The 15 steroids fluctuated with different properties, in which androgens reached the peak in late follicular phase, progesterone (estrogens) reached the peak in luteal phase, while the changes of cortical steroids were not so evident. The method is sensitive and repeatable. The data in this project can provide some references for clinical practice.
liquid chromatography-tandem mass spectrometry (LC-MS/MS); steroids; menstrual cycle
10.3724/SP.J.1123.2016.09015
2016-09-05
浙江省医药卫生科技计划项目(2014KYB285);浙江省中医药科技计划(2012ZA066).
Foundation item: Project of Medical and Health Technology Program of Zhejiang Province (No. 2014KYB285); Traditional Chinese Medical Science and Technology Program of Zhejiang Province (No. 2012ZA066).
O658
A
1000-8713(2017)04-0421-06
* 通讯联系人.E-mail:ludezhao@126.com

