根茎类中药精准煮散饮片探索实例—制何首乌*
白俊其,黄志海,黄 娟,宫 璐,肖水明,李西文,徐 江**,丘小惠**
(1. 广州中医药大学第二附属医院/广东省中医药科学院/中国中医科学院广东分院 广州 510006;2. 中国中医科学院中药研究所 北京 100700)
根茎类中药精准煮散饮片探索实例—制何首乌*
白俊其1,黄志海1,黄 娟1,宫 璐1,肖水明2,李西文2,徐 江2**,丘小惠1**
(1. 广州中医药大学第二附属医院/广东省中医药科学院/中国中医科学院广东分院 广州 510006;2. 中国中医科学院中药研究所 北京 100700)
目的:本文对制何首乌精准煮散饮片用药形式进行探索研究。方法:比较制何首乌饮片及煮散饮片的出膏率;比较3批制何首乌饮片及采用相同饮片制备的煮散饮片质量的均一性,并对其化学指纹图谱进行相似度评价,采用相对峰面积比较共有峰含量和质量均一性。应用ITS2序列作为DNA条形码对何首乌原药进行鉴定。结果:制何首乌精准煮散饮片出膏率为原饮片的2.5倍;3批原饮片煎煮液二苯乙烯苷平均含量为3.56±2.61 g·mg-1,RSD为73.28%,煮散饮片煎煮液二苯乙烯苷平均含量为13.23±0.37 g·mg-1,RSD为2.82%;煮散饮片与原饮片的指纹图谱相似度基本一致,但煮散饮片各共有峰的含量、均一性明显提高。ITS2序列对何首乌药材可实现准确鉴定。结论:制何首乌煮散饮片显著提高煎煮率及质量均一性,可节约资源,提高临床疗效。
制何首乌 精准煮散饮片 煎出率 均一性
何首乌为蓼科植物何首乌Fallopia multiflora(Thunb.)Harald的干燥块根,始载于《开宝本草》,其生品具有解毒、消痈、润肠通便之功效,炮制品(制何首乌)具有补肝肾、益精血、乌须发、强筋骨的功效[1]。种质种源、种植方法、采收加工、炮制工艺等因素均可能使制何首乌饮片的质量参差不齐[2],饮片质量的不均一,极大地影响其临床应用的疗效及稳定性,也无法获取可靠的临床数据。
中药煮散是传统中药的药用形式,是将中药粉碎成一定粒度与水共煎,去渣取汁制成的中药液体制剂。通过将药材粉碎,制成煮散,有利于提高药材生物利用度,提高中药均一性,减少药材使用量,具有省材、省时之特点[3-5]。但是,由于在粉碎加工过程中破坏了药材原有形态,丧失了部分品质鉴别的性状特征,导致“辨药之难”,阻碍了应用与监管,后逐步被中药饮片所取代[6,7]。
随着中药质量控制技术的不断发展,多种技术的应用可有效解决传统煮散的 “辨药之难”问题,实现煮散饮片的精准化鉴定与检测。“精准煮散饮片”的概念与思路方法[8]是基于传统中药煮散用药方式,经标准化和规范化工艺将中药饮片的形状规格微小化、均匀化处理,可使饮片批量规模稳定化,批内质量均一化,实现准确、高效的自动化分装、调剂、煎煮流程,提高临床汤剂用药的精准性。本研究对根茎类中药制何首乌精准煮散饮片推广应用的合理性及优越性进行研究。
1 实验材料
1.1 主要仪器及试剂
美国Waters 2695型高效液相色谱仪系统、W2998 DAD检测器、Empower 色谱工作站(美国Waters公司);BT 125D型十万分之一分析天平(瑞士METTLER-TOLEDO公司);Centrifuge 5430R高速台式冷冻离心机(德国Eppendorf公司);中药材粉碎机(台湾荣聪铁工厂);2720 Thermal Cycler PCR仪(美国Applied Biosystems);DYY-8C型电泳仪(北京市六一仪器厂);JY04S-3C型凝胶成像分析系统(北京君意东方电泳设备有限公司);MX-RL-E型混合仪(大龙兴创仪器有限公司);DP305植物基因组DNA提取试剂盒(北京天根生化科技有限公司);DL 2000 DNA Marker(日本TaKaRa公司);Glodview(上海赛百盛基因技术有限公司);Tris-HCl(上海麦克林生化科技有限公司,生产批号:T818979);Tris(美国 Sigma公司,生产批号:M6250、V900483);β-巯基乙醇、琼脂(美国 Sigma公司,生产批号:V900500);引物由上海美吉生物科技有限公司合成;2×Taq PCR Mix酶(北京艾德莱生物科技有限公司);乙腈、甲酸均为色谱纯(美国Fisher公司);超纯水由Millipore制得。

图1 制何首乌饮片形态图
1.2 受试药物
二苯乙烯苷(含量≥98%,上海源叶生物科技有限公司,生产批号:B20185);何首乌(产地:德庆,生产批号:160301301、20160801;产地:高州,批号:20160817),制何首乌由本实验室按照现行版《中国药典》(一部)制何首乌项下方法和前期研究结果[9]自行炮制。
2 实验方法
2.1 原饮片与煮散饮片出膏率比较
制何首乌煮散饮片制备方法如下:取制何首乌饮片(生产批号:160301301),粉碎后过筛,得到5-10目(2-4 mm)、10-24目(0.8-2 mm)、24-65目(0.25-0.8 mm)等不同粒径范围的煮散饮片。
称取原饮片及不同粒径范围煮散饮片各100 g,采用标准汤剂煎煮法[10]进行提取。分别加7倍量水,浸泡30 min,煮沸后保持30 min,过滤,滤渣再加6倍量水煎煮30 min。合并滤液,减压浓缩至100 mL,即为相当于制何首乌饮片1 g·mL-1的药液。精密量取25 mL溶液,蒸干,得干浸膏重量,计算出膏率。
2.2 原饮片与煮散饮片均一性比较
分别取3个批次制何首乌饮片各200 g,充分混合后,粉碎,用10目、65目筛网过筛,即得10-65目粒径范围制何首乌煮散饮片(图1)。不同批次原饮片各取50 g(S1:批号160301301,S2:批号20160801,S3:批号20160817);取制何首乌煮散饮片,均匀摊平,画格分为9份,随机选取3份(S4-S6),从每份中分别称取50 g。
上述6份样品分别按标准汤剂煎煮法进行提取。合并提取液,定容至500 mL,即相当于饮片0.1 g·mL-1的药液。精密量取药液并用水稀释5倍,采用0.22 μm滤膜过滤,取10 μL进样。
2.3 指纹图谱检测方法
2.3.1 色谱条件的建立
色谱柱:Welch ODS-C18柱(5 μm,250×4.6 mm);流动相:0.1%甲酸水(A)-乙腈(B),梯度洗脱(5%→65%);流速:1 mL·min-1,检测波长:280 nm;柱温:25 ℃;洗脱时间:30 min;进样体积:10 μL。
2.3.2 对照品溶液的制备
精密称取二苯乙烯苷对照品适量,加甲醇配制成含二苯乙烯苷1 mg·mL-1的对照品溶液,依次稀释成12.5、25、50、100、200及400 μg·mL-1系列对照品溶液,采用0.22 μm滤膜过滤,备用。
2.3.3 供试品溶液的制备
精密量取适量饮片提取液,用水稀释成相当于制何首乌饮片0.02 g·mL-1的样品供试品溶液,采用0.22 μm滤膜过滤,备用。
2.3.4 线性关系考察
按照“2.3.1”项下色谱条件进样分析。以对照品峰面积(Y)对浓度(X)进行线性回归,计算回归方程,考察二苯乙烯苷在上述色谱条件下的线性关系。
2.4 DNA 条形码鉴定
选取何首乌饮片样本约40 mg,用液氮进一步磨碎,改良的CTAB法提取何首乌基因组总DNA。ITS2序列扩增采用正向引物ITS2 F:5′-ATGCGATACTTGG TGTGAAT-3′,反向引物:ITS3 R: 5′-GACGCTTCTCCAGACTACAAT-3′,进行扩增。PCR反应体系为25 μL,包括2×Taq PCR Mix酶12.5 μL,正向、反向引物各1 μL(2.5 μmol·L-1),模板DNA 2.0 μL(约30-100 ng),加ddH2O补足至25 μL。扩增程序:94℃变性5 min;94℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s(40个循环);72 ℃延伸10 min。PCR扩增产物采用1.2 %琼脂糖凝胶电泳进行检测,将电泳条带清晰、明亮、单一的PCR产物送测序公司进行双向测序[10]。
2.5 数据处理
采用SPSS17.0软件进行数据分析,组间比较时,采用独立样本t检验,P<0.05为差异有统计学意义。
HPLC图谱采用国家药典委员会中药色谱指纹图谱相似度评价系统软件(2004 A版),生成指纹图谱共有模式,计算样品的相似度。标定共有峰,以二苯乙烯苷为参照峰,计算共有峰的相对保留时间与相对峰面积。
所得序列采用CodonCode Alinger 6.02软件进行校对拼接,去除低质量区并采用基于隐马尔可夫模型的HMMer注释方法去除两端5.8S和28S区段,获得完整的ITS2序列。利用软件MEGA 6.06分析比对,分析ITS2序列特点。以条形码附加二维码的方式展示主导单倍型序列特征,左侧部分为DNA序列转换的彩色条形码图片,右侧二维码图片为QRcode的编码方式进行编码,扫描可读取序列信息[11,12]。
3 实验结果
3.1 原饮片与煮散饮片出膏率比较
出膏率考察结果表明,与原饮片比较,制何首乌不同粒径煮散饮片的出膏率均大幅度提高,为原饮片的2.5倍以上,具有显著性差异;但不同粒径煮散饮片间出膏率无显著性差异,本实验选10-65目为精准煮散饮片,具体结果见表1。
3.2 色谱条件考察
将对照品溶液及供试品溶液按“2.3.1”项下色谱条件进行进样,发现该色谱条件下二苯乙烯苷分离度良好,对照品及提取液色谱图见图2。以对照品峰面积(Y)对浓度(X)进行线性回归,回归方程为:二苯乙烯苷(280 nm),Y=12 173X-68 128(R2= 0.999 9),表明二苯乙烯苷在12.5-400 μg·mL-1浓度范围内线性关系良好。
3.2 饮片均一性评价
以二苯乙烯苷为考察指标,测定其在原饮片及煮散饮片中的含量,结果见表2。结果显示,混合制成煮散饮片后指标成分煎出率明显提高,达3.7倍,结果有显著性差异(P<0.05);其含量均值的RSD值也明显减小,表明饮片质量及饮片均一性均有所提高。
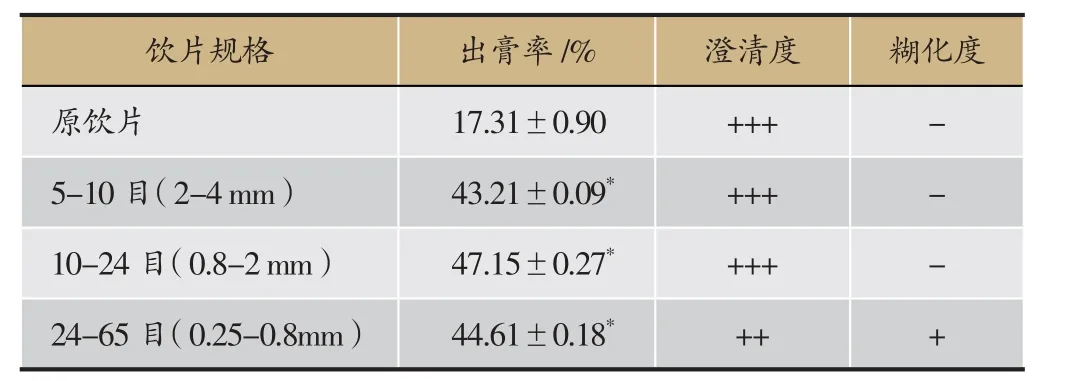
表1 制何首乌原饮片与精准煮散饮片出膏率(n=3)
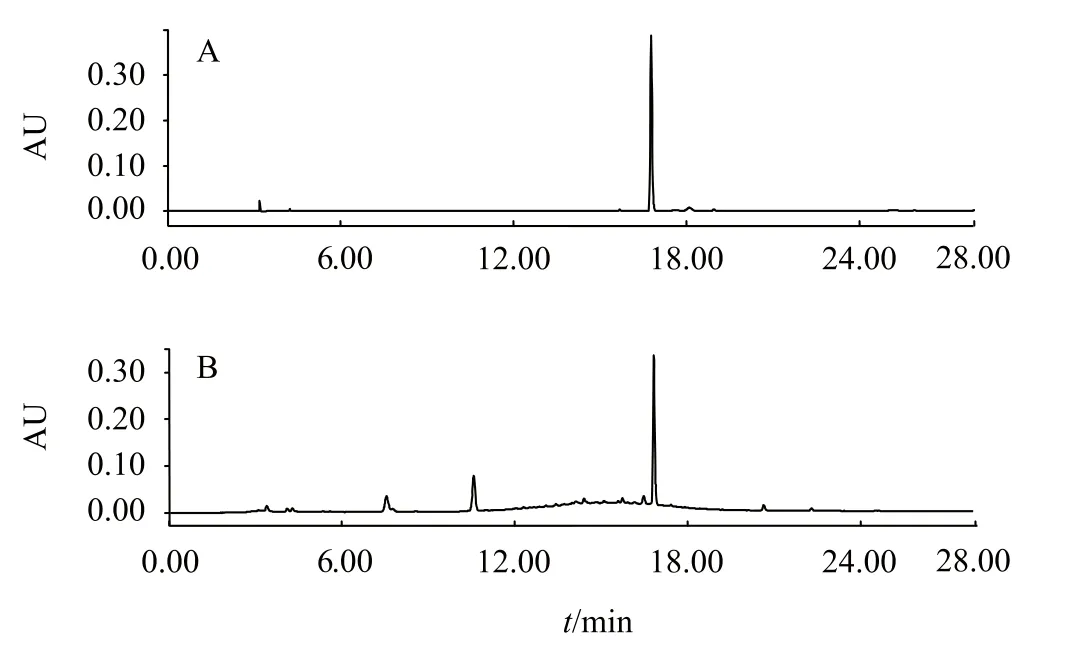
图2 二苯乙烯苷对照品(A)和制何首乌水提液(B)色谱图
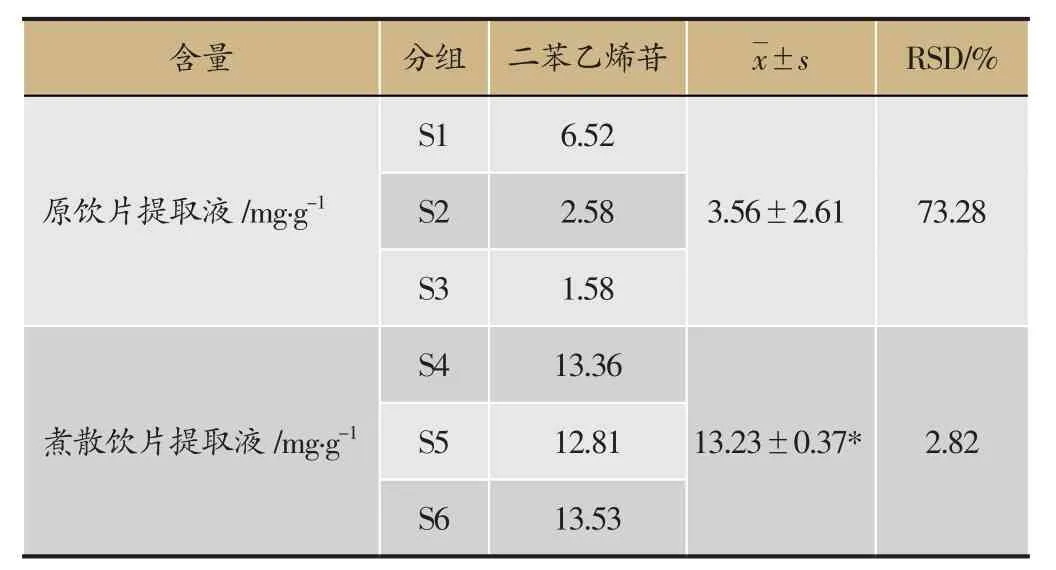
表2 原饮片与精准煮散饮片提取液中二苯乙烯苷含量(n=3)
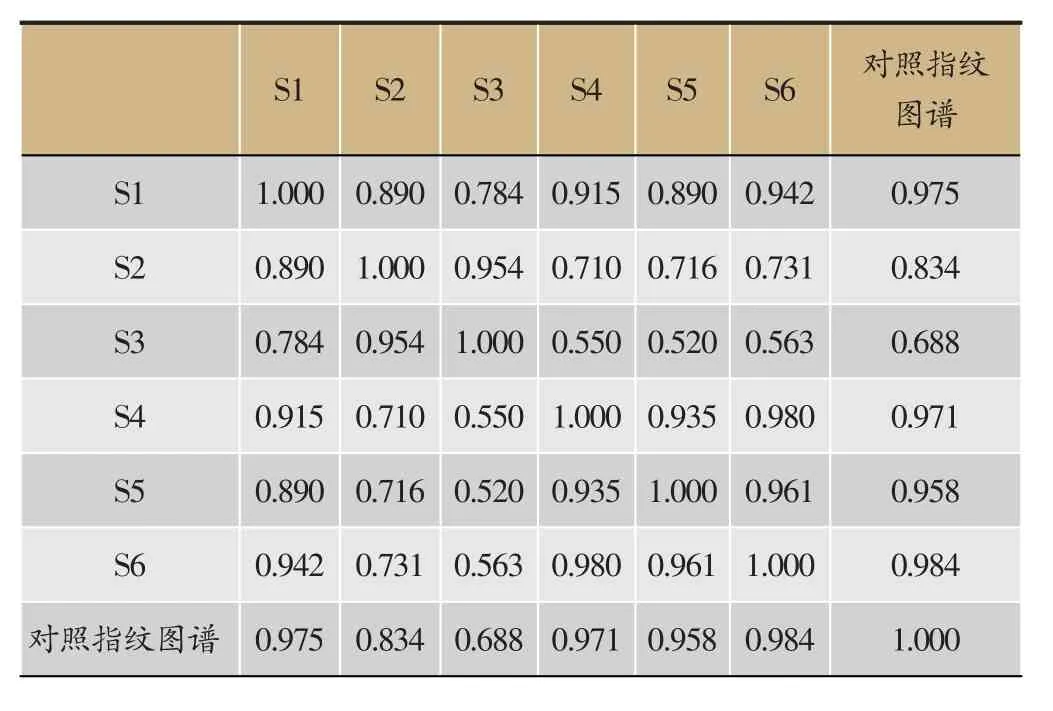
表3 制何首乌指纹图谱相似度评价结果
3.3 指纹图谱研究
3.3.1 指纹图谱及相似度评价
按照“2.3.1”项下方法,对制何首乌饮片水提液进行指纹图谱的测定,结果见图3。以制何首乌原饮片为参照谱,进行自动匹配并计算指纹图谱相似度,结果见表3。原饮片相似度在0.784以上,而精准煮散饮片相似度较高,均达到0.935以上,进一步表明制何首乌精准煮散饮片均一性明显提高。
3.3.2 指纹图谱共有峰的标定
本研究以何首乌原饮片中二苯乙烯苷(tR= 16.894 min)的平均峰面积为参考峰,计算制得精准煮散饮片与原饮片各共有峰的相对峰面积(表4)。结果表明,煮散饮片与原饮片比较,6个共有峰相对峰面积均明显升高,均一性也明显提高,进一步说明制何首乌精准煮散饮片能提高有效成分的浸出率。
3.4 ITS2序列分析
应用MEGA6.06分析何首乌3条ITS2序列特征,有1个变异位点,为88位点的G-A变异。何首乌序列比对后长度均为193 bp,典型序列特征见图4。BLAST搜索结果显示,各样品相似性最高的为何首乌Fallopia multiflora,与其最相似序列的相似度为100%。
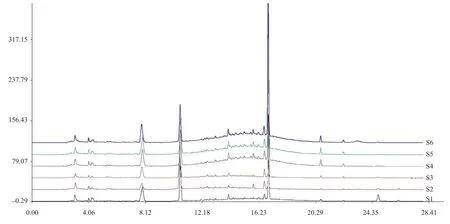
图3 原饮片及精准煮散饮片HPLC指纹图谱
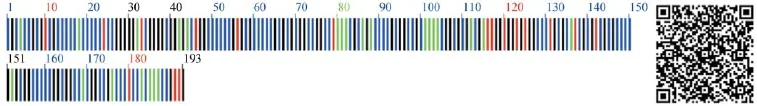
图4 何首乌ITS2主导单倍型序列
4 讨论
本研究采用标准汤剂煎煮法[13]提取,水煎液中大黄素及大黄素甲醚含量极低。因此,本实验仅以二苯乙烯苷作为考察指标成分。
对制何首乌进行的DNA扩增结果显示为阴性,究其原因,制何首乌经高温长时间炮制而成,在炮制过程中往往导致DNA的严重降解,致使无法扩增出相应片段。但是,有研究报道[14]制何首乌可以扩增出ITS2片段,这可能与何首乌的炮制工艺参数有关,炮制的时间和方法不同,导致DNA降解的程度不同而最终影响到扩增结果。因此,对于制何首乌的DNA条形码是否与其炮制程度相关,有必要进一步研究。同时,何首乌药材品种来源单一[1],且制何首乌煮散饮片仍保留了饮片原有的外观色泽、气味等鉴别性状,结合指纹图谱等检测技术,即可实现对其质量有效控制的目的。
何首乌为根茎类饮片,粉性足者为佳,虽经高温炮制烘干后质地坚硬,但破碎时仍易产生大量细粉,细粉掺杂在精准煮散饮片中易导致糊化,筛去细粉导致生产制何首乌精准煮散饮片的得率降低,所以制何首乌破碎时需用剪切式粉碎仪,将制何首乌切割成大小不等的颗粒状饮片即可。
表4 共有峰相对峰面积比较(±s,n= 3)
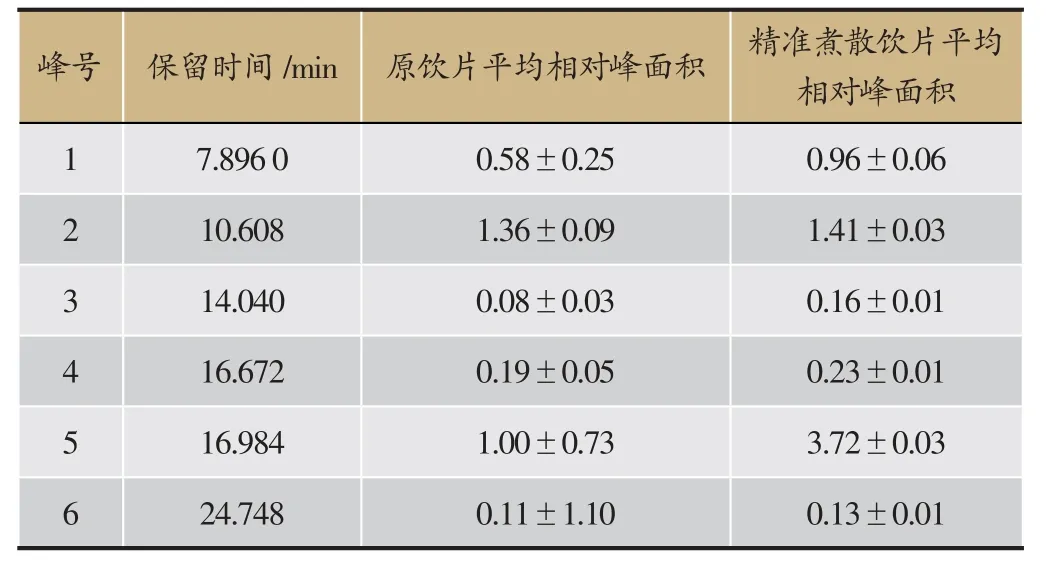
表4 共有峰相对峰面积比较(±s,n= 3)
峰号保留时间/min原饮片平均相对峰面积精准煮散饮片平均相对峰面积1 7.896 0 0.58±0.25 0.96±0.06 2 10.608 1.36±0.09 1.41±0.03 3 14.040 0.08±0.03 0.16±0.01 4 16.672 0.19±0.05 0.23±0.01 5 16.984 1.00±0.73 3.72±0.03 6 24.748 0.11±1.10 0.13±0.01
制何首乌煮散饮片较原饮片的药物成分煎出率、质量均一性均显著提高,这应该与饮片自身质地及形制、规格有关。从有效节约中药资源,提高临床疗效等方面考虑,制何首乌煮散饮片的推广应用,无疑是一种有益的尝试。
1 国家药典委员会. 中华人民共和国药典(一部). 北京:中国医药科技出版社, 2015:76.
2 刘振丽, 宋志前.不同地区制何首乌中二苯乙烯苷含量测定及稳定性考察. 中成药,2002,24(9):684-685.
3 唐安玲, 宋英, 李圆圆等. 续断煮散颗粒煎煮工艺正交试验与溶出曲线的研究. 中成药,2015,37(2):430-433.
4 刘伟玲. 黄柏煮散颗粒制备工艺研究. 中国执业药师, 2015,12 (7):20-23.
5 李文. 金银花煮散颗粒的药学研究. 泸州:泸州医学院硕士学位论文, 2012.
6 徐海波. 中药煮散源流考. 河北中医药学报, 1999,14(4):11-13.
7 穆兰澄, 曹京梅. 中药煮散的历史沿革与现代研究概述. 中国实验方剂学杂志,2008,14(7):74-75.
8 陈士林,黄志海,丘小惠,等. 中药精准煮散饮片. 世界科学技术-中医药现代化, 2016, 18(9):1430-1440.
9 丘小惠,宋艳刚,孙景波,等. 不同炮制工艺制首乌对大鼠血虚模型的作用研究. 中药材, 2008, 31(1):14-17.
10 辛天怡,雷美艳,宋经元. 中药材DNA条形码鉴定研究进展. 中国现代中药, 2015, 17(2):170-176.
11 辛天怡,李西文,姚辉,等. 中药材二维DNA条形码流通监管体系研究. 中国科学:生命科学, 2015, 45(7):695-702.
12 陈士林,宋经元. 本草基因组学. 中国中药杂志,2016, 40(21):3881-3889.
13 陈士林,刘安,李琦,等. 中药饮片标准汤剂研究策略. 中国中药杂志, 2016,40(8):1367-1375.
14 黎洁文. 基于ITS2序列分析的何首乌PCR-RFLP和AS-PCR的分子鉴别研究. 广州:广州中医药大学硕士学位论文, 2015.
Comparison of Precise Powder Decoction Pieces and Original Traditional Chinese Medical Slices of Rhizomatic——A Case Study on Fallopia multiflora Radix Preparata
Bai Junqi1, Huang Zhihai1, Huang Juan1, Gong Lu1, Xiao Shuiming2, Li Xiwen2, Xu Jiang2, Qiu Xiaohui1
(1. The Second Affiliated Hospital of Guangzhou University of Chinese Medicine / Guangdong Provincial Academy of Chinese Medical Sciences / China Academy of Chinese Medical Sciences Guangdong Branch / Guangzhou 510006, China; 2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China)
This study aimed at investigating the drug preparation of precise powder decoction pieces (PPDP) system,Fallopia multifloraradix preparata (FMRP) was employed in this study. Different specifications of PPDP were prepared, their extract rates were in contrast with the original pieces. Compared the quality uniformity of three batches between FMRP original slices and its PPDP extraction, the similarity of the chemical fingerprints was evaluated, and the contents of common peaks and quality uniformity were compared by relative peak areas. ITS2 sequence was taken as a DNA barcode to identifyF. multifloraradix (FMR). As a result, the extract rate of PPDP was 2.5 times as much as the original slices. The average content of stilbene glucoside from the three original slices and the PPDP extraction were 3.56±2.61 and 13.23±0.37 mg·g-1, respectively; while the RSD were 73.28% and 2.82%. The similarity of the fingerprints of the PPDP extraction was almost the same as that of the original slices, but the content and the uniformity of the common peaks of the PPDP extraction were significantly improved. Thus, FMR was accurately identified using ITS2 sequences. It was concluded that the PPDP considerably improve the decocting rate and quality uniformity, indicating that PPDP could save resources and improve the clinical efficacy.
Fallopia multifloraradix preparata, precise powder decoction pieces, decocting rate, uniformity
10.11842/wst.2017.01.014
R283.3
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-12-23
修回日期:2017-01-05
* 国家发展改革委、中医药管理局中药标准化项目(ZYBZH-Y-SH-38)子课题:制首乌饮片标准研究,负责人:丘小惠;广东省中医院专项(2015KT1817):岭南中草药DNA条形码分子鉴定和生态适宜性研究,负责人:黄志海;中国中医科学院中医药健康服务专项(ZZ0908067):200种岭南中草药DNA条形码研究,负责人:黄志海。
** 通讯作者:徐江,博士,助理研究员,主要研究方向:中药分子生物学研究;丘小惠,硕士,研究员,主要研究方向:中药物质基础研究。

