多靶点诱导治疗增殖性和膜性狼疮肾炎的有效性和安全性临床研究
黄金平 喻彦之 高武 陈文 华杜鹃 吴屹哲 蒋金玉
多靶点诱导治疗增殖性和膜性狼疮肾炎的有效性和安全性临床研究
黄金平 喻彦之 高武 陈文 华杜鹃 吴屹哲 蒋金玉
目的 探讨多靶点诱导治疗增殖性和膜性狼疮肾炎的有效性和安全性。方法 将32例患者随机分为多靶点治疗组和环磷酰胺(cyclophosphamide,CTX)组。诱导期初定24周,若24周内未达完全缓解,诱导期延长至36周。2组患者均采用静脉甲基泼尼松龙冲击后口服泼尼松治疗。多靶点治疗组采用霉酚酸酯1 000 mg/d(体质量低于50 kg的患者750 mg/d),分2次,早、晚餐前口服;他克莫司起始剂量4 mg/d(体质量低于50 kg的患者3 mg/d),分2次,早、晚餐前(间隔12 h)口服,服药7 d后开始检测血药浓度,目标血药谷浓度达到5~7 ng/ml。CTX组CTX首次剂量0.75 g/m2,此后根据具体情况调整在0.5~1.0 g/m2,每4周1次。所有患者入选前2周内均在B超引导下行经皮肾穿刺术,肾组织常规行HE、PAS、PASM、Masson染色,半定量评分肾组织狼疮活动性病理指数及慢性化病理指数。治疗36周后常规检测血清巨细胞病毒抗体。当患者出现细菌感染迹象时,根据临床需要选择胸部CT、B超、细菌培养等检查,以明确感染部位及细菌种类。结果 多靶点治疗组24周完全缓解率显著高于CTX组(62.50%比18.75%,P<0.01),36周完全缓解率显著高于CTX组(68.75%比31.25%,P<0.05)。Kaplan-Meier生存函数分析显示多靶点治疗组较CTX组更短时间获得部分缓解和完全缓解(P<0.01)。多靶点治疗主要的不良反应为CMV感染(占43.75%)。结论 多靶点诱导治疗增殖性和膜性狼疮肾炎有效性优于传统的CTX治疗,虽然巨细胞病毒感染风险较高,但无需特殊处理。
狼疮肾炎;多靶点治疗;环磷酰胺;霉酚酸酯;他克莫司
狼疮肾炎(lupus nephritis,LN)是系统性红斑狼疮(systemic lupus erythematosus,SLE)的一种常见并发症。随着类固醇激素联合免疫抑制剂[如环磷酰胺(cyclophosphamide,CTX)、霉酚酸酯(mycophenolate mofetil,MMF)和钙调磷酸酶抑制剂(calcineurin inhibitors,CNIs)]被广泛用于弥漫增殖性LN的诱导治疗,LN的预后有了很大的进展[1],但仍有相当一部分LN患者疗效不满意。我国学者率先在国际上提出了针对导致不同组织损伤的多种免疫途径使用具有不同免疫抑制剂效应的多种药物联合应用-多靶点疗法[2],但其有效性和安全性尚不明确。本研究旨在通过随机对照研究探讨多靶点诱导治疗增殖性和膜性LN的有效性和安全性。
资料与方法
一、研究对象
选择2014年5月至2016年5月在湖北医药学院附属随州医院肾内科住院的患者32例,诊断符合1997年美国风湿病协会SLE诊断标准,年龄18~60岁,性别不限;入组前2周内接受肾穿刺活检,确诊为增殖性和(或)膜性LN。根据2003国际肾脏学/肾脏病理协会(ISN/RPS)分类标准,病理类型包括Ⅲ型、Ⅳ型、Ⅴ型、Ⅴ+Ⅲ型、Ⅴ+Ⅳ型,慢性化病理指数(chronic index,CI)<4分。32例患者蛋白尿≥1.5 g/24 h,血清肌酐<265.2 μmol/L。本研究获随州市中心医院伦理委员会批准;患者本人或其法定代表人或见证人签署书面知情同意书。
排除标准:①近3个月内使用过CTX、MMF、他克莫司(tacrolimus,TAC)等免疫抑制剂;②妊娠、精神异常或预期依从性差;③有结核、肝炎等传染病、重要脏器衰竭、严重感染或其他严重并发症;④肝功能异常:丙氨酸转氨酶或天冬氨酸转氨酶超过正常值上限2倍或者糖代谢异常;空腹血糖超过6.1 mmol/L或餐后血糖超过7.8 mmol/L;⑤血白细胞<3×109/L,血小板<50×109/L;⑥对治疗药物过敏。
二、分组
32例患者中,男性5例,女性27例,平均年龄(35.7±13.7)岁。将32例患者随机分为2组,多靶点治疗组和CTX组,每组16例。2组基线特征在性别、年龄、SLEDAI评分、尿蛋白定量、eGFR、血浆白蛋白、抗dsDNA、病理类型、AI和CI方面均无显著性差异。(表1)
三、方法
2组诱导期治疗共24周,若24周未达完全缓解,诱导期延长至36周。所有患者均接受静脉甲基泼尼松龙冲击治疗(0.5 g静滴,每日一次,共3 d),冲击治疗后口服泼尼松(起始剂量为0.6~0.8 mg·kg-1·d-1,最大剂量40 mg/d),4周后减量,每2周减5 mg/d至20 mg/d,再每2周减2.5 mg/d,直至每日10 mg维持。
多靶点治疗组采用MMF 1 000 mg/d(体质量低于50 kg的患者750 mg/d),分2次,早晚餐前口服;TAC起始剂量4 mg/d(体质量低于50 kg的患者3 mg/d),分2次,早晚餐前(间隔12 h)口服,服药7 d后开始检测血药浓度,目标血药谷浓度达到5~7 ng/ml。
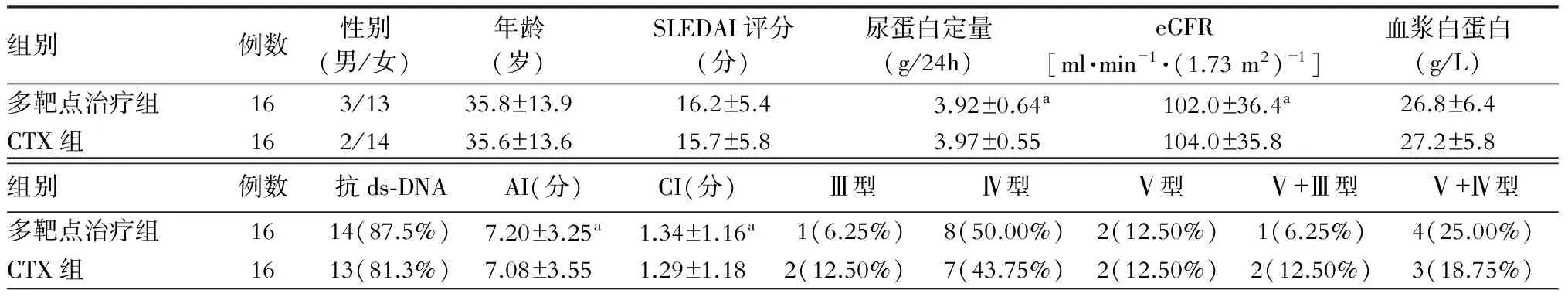
表1 多靶点治疗组和CTX组基线特征比较
注:与CTX组比较,aP>0.05
CTX组:CTX首次剂量按体表面积 (body surface area,BSA) 计算(0.75 g/m2),此后根据具体情况调整在0.5~1.0 g/m2, BSA(m2)=[身高-0.587]×1.5,每4周1次。CTX总量不超过9 g。治疗时将CTX溶于250 ml生理盐水中静脉滴注60~90 min,24 h内充分水化,要求患者定时排尿。
四、观察指标
治疗前了解患者的病史和实验室检查结果,包括性别、年龄、系统性红斑狼疮疾病活动度评分(systemic lupus erythematosus disease activity index,SLEDAI)评分、尿蛋白定量、估算肾小球滤过率(estimated glomerular filtration rate,eGFR)、血浆白蛋白、抗-dsDNA、血清巨细胞病毒(cytomegalovirus,CMV)抗体等。所有患者入选前2周内均在B超引导下行经皮肾穿刺术,肾组织常规行HE、PAS、PASM、Masson染色,半定量评分肾组织狼疮活动性病理指数(active index,AI)及CI。所有患者治疗36周后常规检测血清CMV抗体,当患者出现发热、咳嗽、腹痛、尿路刺激症状等细菌感染迹象时根据临床需要选择胸部CT、B超(肝、胆、胰、脾、泌尿系)、细菌培养(血、尿、痰)等检查,以明确感染部位及细菌种类。
五、疗效判断标准
入选患者治疗效果的判断标准参考文献[3]。
(1)完全缓解(complete remission,CR):尿蛋白定量<0.3 g/24 h,尿沉渣检查正常,血清白蛋白≥35 g/L,血肌酐(SCr)正常或上升不超过正常范围15%,无肾外狼疮活动。
(2)部分缓解(partial remission,PR):尿蛋白定量≥0.3 g/24 h,尿蛋白下降超过基础值50%,同时血清白蛋白≥30 g/L,肾功能稳定,无肾外活动。
(3)无缓解(no remission,NR):没有达到CR和PR的标准。
六、统计学处理
采用SPSS 19.0统计软件分析,所有数据以均数±标准差表示,计数资料采用t检验,计量资料应用卡方检验;应用Kaplan-Meier法计算实现PR和CR的概率,采用Log-rank检验分析两曲线间的差异,P<0.05为差异有统计学意义。
结 果
一、临床疗效
多靶点治疗组与CTX组比较,PR和CR均升高。(表2)
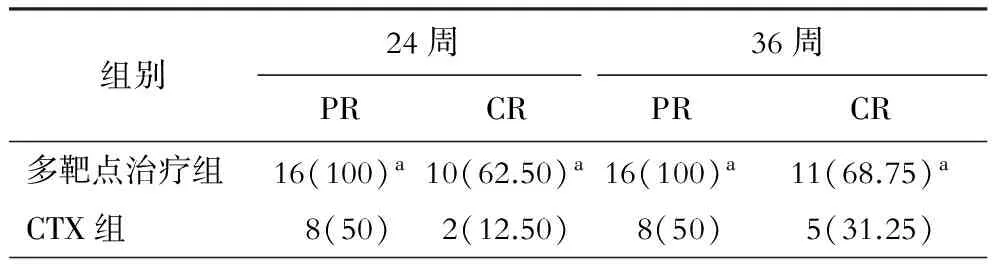
表2 2组患者治疗24周和36周时PR和CR比较[例(%)]
注:与CTX组比较,aP<0.05
二、生存函数曲线分析
生存函数比较显示,多靶点治疗较CTX治疗能更早获得PR和CR,有显著性差异。(图1)
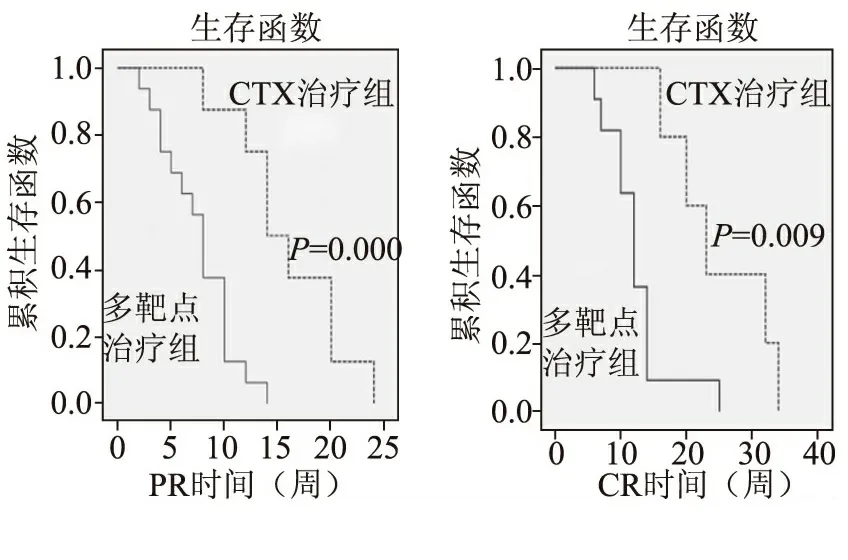
图1 2组患者生存函数曲线分析
三、预后
多靶点治疗巨细胞病毒感染风险高,但仅有血清CMV抗体阳性,均无临床症状,未作特殊处理。2组中各1例皮肤感染均为真菌,各1例泌尿系统感染均为大肠杆菌。多靶点治疗组1例肺部感染为肺炎克雷伯杆菌,CTX组2例肺部感染分别为绿脓杆菌和金黄色葡萄球菌,同样多靶点治疗易出现消化道症状,但无显著差异,经对症处理可耐受。(表3)

表3 2组患者不良反应发生率的比较[例(%)]
注:与CTX组比较,aP<0.05,bP>0.05
讨 论
CTX联合激素治疗方案明显提高了LN患者的生存率[1,4],但不同的病理类型对CTX的治疗反应存在较大区别[5-6]。部分患者容易复发甚至对治疗无任何反应[7],且不良反应较多[8],尤其是性腺毒性风险高[9]。MMF对性腺毒性比CTX小,被用作增殖性狼疮肾炎的诱导治疗药物,对于活动性增殖性狼疮肾炎的诱导治疗,MMF和CTX效果相似[10]。CNIs例如TAC、环孢素A也被作为治疗LN的替代CTX的药物。但CNIs治疗活动性狼疮肾炎与CTX或者MMF效果也相似[11]。由于SLE和LN是多克隆免疫异常所致,单用激素或免疫抑制剂治疗效果不佳,联合应用激素、TAC以及MMF的多靶点治疗近年来得到重视[2-12]。
本研究应用临床对照试验比较了多靶点和静脉注射环磷酰胺诱导治疗增殖性和膜性LN的疗效,结果显示多靶点疗法对Ⅲ、Ⅳ、Ⅴ、Ⅴ+Ⅲ和Ⅴ+Ⅳ型LN有较好诱导疗效,部分缓解率达到了100%,完全缓解率达到68.8%,与鲍浩等[2]的研究提示完全缓解率达63.3%相似,而CTX组部分缓解率和完全缓解率分别只有56.3%和37.5%,并且通过生存函数曲线研究,多靶点疗法较传统静脉注射CTX疗法能更早获得PR和CR。
多靶点治疗对于增殖性和膜性LN效果明显的机制尚不清楚。目前普遍认为,LN的不同病理形态可能源于LN的不同发病机制。在SLE患者中,免疫反应的Th1/Th2型具有异质性,LN的增生和新月体形成是由Th1型免疫反应引起的,与迟发型超敏反应效应细胞、巨噬细胞、T细胞的浸润以及Fibrin沉积有关,而膜型LN与Th2免疫反应有关,通常无迟发型超敏反应效应细胞浸润,与IgG4沉积有关[13]。TAC能穿透细胞膜进入细胞内,与FK506结合蛋白结合,抑制胞内活化T淋巴细胞核转录因子入核,一方面阻断抑制了T细胞的活化和增殖。另一方面,阻断了此复合物所诱导的多种细胞因子的转录[14]。TAC还抑制T辅助淋巴细胞,减少SLE患者B细胞产生的大量自身抗体白细胞介素10[15],并减少抗dsDNA的生成,减轻LN肾脏病理进展。TAC还抑制LN发病中起重要作用的树突状细胞成熟,以致树突状细胞在胞内加工、处理抗原能力减退,诱导免疫耐受[16]。TAC还可抑制肾小球内皮细胞增殖、稳定足细胞骨架,减少蛋白尿[17],并且收缩入球小动脉进一步减少蛋白尿的生成[18]。MMF是MPA的一种前体药,而MPA是一种5'肌苷酸脱氢酶的阻滞剂,抑制T、B细胞对有丝分裂原刺激产生的增殖反应,并能通过多种途径保护血管内皮细胞[19]。另外,MPA也抑制树突状细胞成熟,降低它给T淋巴细胞的抗原呈递能力[20]。不同的免疫反应参与了LN、CNI和5'肌苷酸脱氢酶抑制剂的协同作用能诱导这种疾病的早期缓解。
本研究也比较了多靶点和静脉注射环磷酰胺诱导治疗增殖性和膜性LN的不良反应,结果显示多靶点治疗的细菌、真菌感染与静脉注射环磷酰胺无显著差异,与Liu等[21]的研究相似。但多靶点治疗的CMV感染发生率较高(占43.75%),Hidekazu等[22]的研究也显示多靶点治疗患者CMV感染发生率达40%。Yoshimura等[23]对于肾移植术后患者的研究显示,使用MMF组CMV感染发生率18.4%。Wu等[24]同样对于肾移植术后患者的研究显示,患者血清CMV-DNA阳性与TAC浓度显著相关。Rodríguez-Serrano等[25]的研究显示,使用TAC的肝移植患者CMV感染的发生率为15.9%。本研究中CMV感染发生率达43.75%,考虑与激素、TAC、MMF不良反应叠加有关,但均因未出现明显临床症状未给予抗病毒治疗。多靶点治疗消化道症状发生率较高(占50%),但与CTX组比较无显著差异。Rathi等[26]的研究发现,使用MMF的患者有52%出现消化道症状,而使用CTX的患者消化道症状发生率仅为4%。Szeto等[27]亦报道应用TAC治疗膜性LN消化不良发生率较高(8/18)。但本研究中消化道症状并没有因为多靶点治疗联合应用MMF和TAC而明显增加,并且经对症处理后,患者均能耐受。多靶点治疗患者中白细胞减少的发生率较低,与鲍浩等[2]的研究一致,但较CTX治疗无显著差异。
综上所述,多靶点治疗能更早、更有效地提高LN患者治疗的缓解率,白细胞下降风险较低,消化道症状经过适当处理均能耐受。虽然CMV病毒感染风险较高,但无严重并发症发生。但本研究样本量较少,观察时间有限,也未对Ⅲ、Ⅳ、Ⅴ、Ⅴ+Ⅲ和Ⅴ+Ⅳ型各亚组进行具体比较,多靶点治疗的有效性和安全性以及导致的CMV感染后的后果尚需进一步多中心大样本研究。
[1] Hogan J, Appel GB. Update on the treatment of lupus nephritis[J]. Curr Opin Nephrol Hypertens, 2013, 22(2): 224-230.
[2] 鲍浩, 刘志红, 胡伟新, 等. 多靶点诱导治疗增殖性和膜性狼疮性肾炎前瞻对照性临床研究[J]. 肾脏病与透析移植杂志, 2009, 18(3): 201-206.
[3] 中华医学会. 狼疮肾炎. 见: 陈香美, 主编. 临床诊疗指南. 肾脏病学分册[M]. 第1版. 北京: 人民卫生出版社, 2011. 58-66.
[4] 谭红阳, 许弄章. 狼疮性肾炎免疫抑制剂治疗研究进展[J]. 安徽医药, 2014, 18(2): 2221-2225.
[5] Mok CC, Yap DY, Navarra SV, et al. Overview of lupus nephritis management guidelines and perspectivefrom Asia[J]. Int J Rheum Dis, 2013, 16(6): 625-636.
[6] Brugos B, Sebestyen L, Tarr T, et al. Use of cyclophosphamide and other immunosuppressive drugs in the treatment of patients with lupus nephritis[J]. Pharmazie, 2014, 69(6): 442-444.
[7] Yap DY, Chan TM. Treatment of lupus nephritis: practical issues in Asian countries[J]. Int J Rheum Dis, 2015, 18(2): 138-145.
[8] Karim YDDP. The NIH pulse cyclophosphamide regime: the end of an era[J]. Lupus, 2004, 13(1): 1-3.
[9] Ntali S, Bertsias G, Boumpas DT. Cyclophosphamide and lupus nephritis: when, how, for how long?[J]. Clin Rev Allergy Immunol, 2011, 40(3): 181-191.
[10]Karim MY, Pisoni CN, Khamashta MA. Update on immunotherapy for systemic lupus erythematosus-what's hot and what's not![J]. Rheumatology(Oxford), 2009, 48(4): 332-341.
[11]Li X, Ren H, Zhang Q, et al. Mycophenolate mofetilor tacrolimus compared with intravenous cyclophosphamide in the induction treatment for active lupus nephritis[J]. Nephrol Dial Transplant, 2012, 27(4): 1467-1472.
[12]Ikeuchi H, Hiromura K, Takahashi S, et al. Efficacy and safety of multi-target therapy using a combination of tacrolimus, mycophenolate mofetil and a steroid in patients with active lupus nephritis[J]. Mod Rheumatol, 2014, 24(4): 618-625.
[13]Holdsworth SR, Kitching AR, Tipping PG. Th1 and Th2 T helper cell subsets affect patterns of injury andoutcomes in glomerulonephritis[J]. Kidney Int, 1999, 55(4): 1198-1216.
[14]Westhoff TH, Vander GM. Tacrolimus in the treatment of idiopathic nephritic syndrome[J]. Expert Opin Investig Drugs, 2007, 16(5): 1099-1110.
[15]Zhang Q, Shi SF, Zhu L, et al. Tacrolimus improvesthe proteinuria remission in patients with refractory IgA nephropathy[J]. Am J Nephrol, 2012, 35(4): 312-320.
[16]Lee YR, Yang IH, Lee YH, et al. Cyclosporin A and tacrolirflus, but not rapamycin, inhibit MHC-restricted antigen presentation pathways in dendritic cells[J].Blood, 2005, 108(6): 3951-3955.
[17]Nonaka K, Ubara Y, Suwabe T, et al. Intractable nlemhranous lupus nephritis showing selective improvement of subepithelial deposits with tacrolinms therapy: a case report[J]. Clin Nephrol, 2013, 80(2): 140-145.
[18]Faul C, Donnelly M, Mersche-Gomez S, et al. The actin cytoskeleton of kidney podocytes is a direct target of the antiproteinuric effect of cyclosporine A[J]. Nat Med, 2008, 14(9): 931-938.
[19]Huang Y, Liu Z, Huang H, et al. Effects of mycophenolic acid on endothelial cells[J]. Int Immunopharmacol, 2005, 5(6): 1029-1039.
[20]Villarroel MC, Hidalgo M, Jimeno A. Mycophenolate mofetil: an update[J]. Drugs Today(Barc), 2009, 45(7): 521-532.
[21]Liu Z, Zhang H, Liu Z, et al. Multitarget therapy for induction treatment of lupus nephritis: a randomizedtrial[J]. Ann Intern Med, 2015, 162(1): 18-26.
[22]Hidekazu I, Keiju H, Satoshi T, et al. Efficacy and safety of multi-target therapy using a combination of tacrolimus, mycophenolate mofetil and a steroid in patients with active lupus nephritis[J]. Mod Rheumatol, 2014, 24(4): 618-625.
[23]Yoshimura N, Ushigome H, Akioka K, et al. The beneficial effect of high-dose mizoribine combined with cyclosporine, basiliximab, and corticosteroids on CMV infection in renal transplant recipients[J]. Clin Exp Nephrol, 2013, 17(1): 127-133.
[24]Wu CZ, Chen XQ, Wang ZY, et al. Simultaneous monitoring of CMV and BKV by quantitative PCR in renal transplant recipients[J]. J Virol Methods, 2014, 210(12): 40-44.
[25]Rodríguez-Serrano M, Snchez-Lzaro I, Almenar-Bonet L, et al. Does the calcineurin inhibitor have influence on cytomegalovirus infection in heart transplantation?[J]. Clin Transplant, 2014, 28(1): 88-95.
[26]Rathi M, Goyal A, Jaryal A, et al. Comparison of low-dose intravenous cyclophosphamide with oral mycophenolate mofetil in the treatment of lupus nephritis[J]. Kidney Int, 2016, 89(1): 235-242.
[27]Szeto CC, Kwan BC, Lai FM, et al. Tacrolimus for the treatment of systemic lupus erythematosus with pure class V nephritis[J]. Rheumatology(Oxford), 2008, 47(11): 1678-1681.
Clinical study on the efficacy and safety of treatment of both proliferative and membranous lupus nephritis with multi-target therapy
HUANGJin-ping,YUYan-zhi,GAOWu,CHENWen,HUADu-juan,WUYi-zhe,JIANGJin-yu.
DepartmentofNephrology,SuizhouHospital,HubeiUniversityofMedicine,Suizhou441300,China
Objective To investigate the efficacy and safety of treatment of both proliferative and membranous lupus nephritis with multi-target therapy.Methods Thirty-two patients were randomly divided into multi-target therapy group and cyclophosphamide(CTX) group. The induction course of treatment was initially set to 24 weeks, and it was prolonged to 36 weeks if subjects did not achieve complete remission within 24 weeks. Two groups of patients were treated with intravenous methylprednisolone after oral prednisone therapy. Tacrolimus(TAC) was given at 4 mg/d, and mycopholatemofetil(MMF) 1.0 g/d. CTX was given monthly 0.75 g/m2BSA. All enrolled patients were subjected to renal puncture 2 weeks before therapy. Lupus activity index(AI) and chronic index(CI) were estimated by semi-quantitative scores in the renal tissue. After 36 weeks of treatment, serum cytomegalovirus(CMV) antibody was tested. When patients had signs of bacterial infection, B ultrasound, chest CT, and bacterial culture were performed to identify the site and bacterial species of infection according to the clinical needs.Results The complete remission rate in the multi-target therapy group was significantly higher than that in the CTX group after both 24 weeks(62.50% vs. 18.75%,P<0.01) and 36 weeks(68.75% vs. 31.25%,P<0.05), respectively. Kaplan-Meier analysis showed that subjects in the multi-target group achieved both partial and complete remission earlier than in the CTX group(P<0.01). CMV infection(43.75%) was the major adverse effect of multi-target therapy.Conclusions Multi-target therapy is superior to CTX therapy for both proliferative and membranous lupus nephritis. Although the risk of CMV infection is high, the patient is well tolerated.
Lupus nephritis; Multi-target therapy; Cyclophosphamide; Mycophenolate mofetil; Tacrolimus
10.3969/j.issn.1671-2390.2017.02.007
随州市2015年医学科研项目(No.2015SMR002)
441300 随州,湖北医药学院附属随州医院肾内科
2016-12-06
2017-01-15)

