别嘌醇对慢性肾脏病合并无症状高尿酸血症患者肾功能的影响
王垚 于博
别嘌醇对慢性肾脏病合并无症状高尿酸血症患者肾功能的影响
王垚 于博
目的 探讨别嘌醇在慢性肾脏病(chronic kidney disease,CKD)早期合并无症状高尿酸血症患者中降尿酸治疗的临床效果。方法 选取2014年2月至2015年2月在扬州市第一人民医院肾内科确诊为CKD 2~3a期且合并无症状性高尿酸血症的患者87例,随机分为别嘌醇治疗组和对照组,对照组和治疗组常规给予低盐、低脂、低优蛋白、低嘌呤饮食,控制血压、血糖等基本治疗,别嘌醇治疗组另再给予别嘌醇200 mg/d口服。治疗1年后观察2组患者血压、估算肾小球滤过率(estimated glomerular filtration rate,eGFR)下降和蛋白尿情况。结果 别嘌醇治疗组中有3例(占7.14%)患者因皮疹退出治疗,治疗后血尿酸水平(280.21±72.58)μmol/L较治疗前的(515.28±114.13)μmol/L明显降低(P<0.01)。eGFR治疗前水平为(73.46±18.38)ml·min-1·(1.73 m2)-1、治疗后水平为(70.37±20.11)ml·min-1·(1.73 m2)-1,治疗前、后无明显变化(P>0.05),而对照组1年后血尿酸水平较治疗前的(545.43±89.56)μmol/L升高为(487.02±78.57)μmol/L(P<0.01)。eGFR治疗前水平为(70.43±20.65)ml·min-1·(1.73 m2)-1,治疗后水平明显下降为(64.21±17.42)ml·min-1·(1.73 m2)-1(P<0.05);别嘌醇治疗组24 h尿蛋白定量治疗后为(0.48±0.12) g/24h,较治疗前水平(0.62±0.43) g/24h轻度下降,但差异无统计学意义(P>0.05)。对照组24 h尿蛋白定量治疗前水平(0.60±0.47) g/24h、治疗后水平(0.64±0.37) g/24h,治疗前、后无变化(P>0.05)。2组患者治疗后收缩压分别为(125.21±10.08) mmHg、(128.45±9.64) mmHg,较治疗前收缩压(155.44±12.12) mmHg、(157.42±14.12) mmHg显著降低;治疗后舒张压分别为(80.45±9.23) mmHg、(82.27±6.25) mmHg,较治疗前的(88.56±10.21) mmHg、(86.45±11.56) mmHg均显著降低(P<0.05),但组间比较无统计学差异(P>0.05)。结论 CKD 2~3a期合并无症状高尿酸血症患者给予别嘌醇降尿酸治疗可延缓肾功能减退。
别嘌呤醇;慢性肾脏病;高尿酸;估算肾小球滤过率
尿酸是嘌呤代谢终产物,慢性肾衰竭患者均有不同程度的高尿酸血症(hyperuricemia,HUA)。随着慢性肾脏病(chronic kidney disease,CKD)患者的估算肾小球滤过率(estimated glomerular filtration rate,eGFR)下降,尿酸排出减少,CKD患者合并HUA的患病率明显增加。近年来的研究结果显示,HUA是慢性肾衰竭的独立危险因素,可加重原有肾脏疾病病情。HUA通过引发血管内皮细胞功能紊乱、血管平滑肌细胞增生、间质炎性反应、氧化应激激活以及肾脏血管对肾素的敏感性增加而发挥肾脏毒性作用,最终导致入球小动脉硬化、肾间质和肾小管纤维化,促进肾衰竭的发生和发展。然而对于合并无症状HUA的患者是否需要常规降尿酸治疗目前尚有争议。为了评估降尿酸治疗对该类患者的可行性,我们选择合并无症状HUA的 CKD 2~3a期患者,除常规治疗外,分为别嘌醇治疗组和对照组,观察降尿酸治疗对肾功能减退、蛋白尿以及血压等指标的影响。
资料与方法
一、一般资料
选取2014年2月至2015年2月在扬州市第一人民医院肾内科确诊为CKD 2~3a期且合并无症状性HUA的患者87例,男48例,女39例,根据随机数字表法随机分为别嘌醇治疗组和对照组。
(1)CKD 2~3a期诊断标准:根据K/DOQI指南分期标准:①CKD 2期:轻度肾功能受损,GFR 60~89 ml·min-1·(1.73 m2)-1;②CKD 3a期:中度肾功能受损,GFR 45~59 ml·min-1·(1.73 m2)-1。
(2)HUA诊断标准:男性血尿酸>420 μmol/L,绝经前女性血尿酸>360 μmol/L,绝经后女性血尿酸>420 μmol/L。采用简化的肾脏病膳食改良试验公式计算eGFR=170×血肌酐-0.999×(年龄)-0.176×(血清尿素氮)-0.170×(血清白蛋白)0.318×0.762(女性)。血肌酐、尿素氮、白蛋白的单位为mg/dl。
(3)入组患者均符合以下条件:患者原发病明确,无痛风发作、尿酸性肾结石等HUA相关临床症状,近期3个月病情稳定;排除高尿酸性肾病,排除急性感染、肿瘤、结石、梗阻等疾病,排除近3个月应用干扰尿酸代谢的药物如速尿、碳酸氢钠等。依从性较强,可定期复诊并配合观察,且知情同意。
二、方法
按照以上分组,记录患者年龄、性别、原发病等一般情况,检测血压、血清尿素氮、血肌酐、血尿酸、24 h尿蛋白定量等观察指标,患者清晨空腹抽血,2 ml左右血样在室温下静置30 min后,4 000 r/min离心10 min分离血清,送我院检验科检测血尿素氮、血肌酐、尿酸水平(日立全自动生化检验仪)。留取24 h尿液,从晨起7时到次日7时,留取前先排空膀胱,将尿液收集在一干净塑料容器中,记下尿量,混匀取10 ml送检测尿白蛋白,计算24 h尿蛋白定量。所有指标均按仪器及试剂盒说明进行。2组患者常规低盐、低脂、低优蛋白、低嘌呤饮食,控制血压、血糖等基本治疗相同。血管紧张素受体阻滞剂(angiotensin receptor blocker,ARB)起始给予缬沙坦80 mg/d[80 mg/片,国药准字H20040217,北京诺华制药有限公司(国产)],如患者无明显咳嗽、高钾血症、低血压等情况出现,常规加量至160 mg/d。2组患者均无口服及静脉给予碳酸氢钠等其他干扰尿酸代谢的治疗。别嘌醇治疗组给予别嘌醇50 mg/d(100 mg/片,国药准字H31020334,上海信谊万象药业股份有限公司)口服,如无明显皮疹,腹泻等不良反应,逐渐加量至200 mg/d。治疗目标为血尿酸降至正常,血尿酸达标后仍继续服用别嘌醇。初始治疗时每两周检测肾功能及血尿酸等指标,达标后每个月复查一次相关指标。对照组不予降尿酸治疗,每月复查相关指标。
三、统计学处理
应用SPSS 16.0统计软件分析,计量资料以均数±标准差表示,组间比较采用t检验,计数资料比较采用卡方检验,P<0.05为差异有统计学意义。
结 果
一、2组患者一般情况的比较
别嘌醇治疗组中,男23例,女19例,年龄范围35~67岁,平均(53.5±12.4)岁。原发病:慢性肾小球肾炎20例,糖尿病肾病8例,高血压性肾损害10例,多囊肾病2例,狼疮肾炎2例。对照组中,男25例,女20例,年龄范围37~68岁,平均(50.7±17.6)岁。原发病:慢性肾小球肾炎23例,糖尿病肾病12例,高血压性肾损害8例,多囊肾病2例。2组性别、年龄以及原发病、收缩压、舒张压、肾功能、血尿酸、24 h尿蛋白比较,差异无统计学意义(P>0.05)。(表1)
二、2组患者治疗前、后的临床指标比较
别嘌醇治疗组患者有3例(占7%)因明显皮疹、过敏终止实验。别嘌醇治疗组患者治疗后血尿酸较治疗前明显下降(P<0.01),治疗前、后eGFR无明显差异(P>0.05);治疗后24 h尿蛋白较治疗前减少,但差异无统计学意义(P>0.05)。对照组中,治疗后血尿酸水平升高(P<0.05),eGFR明显下降(P<0.05),24 h尿蛋白治疗前、后无明显统计学差异。2组患者治疗后,收缩压和舒张压均明显下降(P<0.05),但别嘌醇治疗组与对照组治疗后比较,收缩压及舒张压无明显差异。(表2)
讨 论
CKD在全球的发病率逐年增加,目前已经成为继心脑血管疾病、肿瘤、糖尿病之后又一个威胁人类健康的重要疾病。HUA是CKD的并发症之一,痛风的发病率在CKD的患者中显著高于正常人群。CKD患者出现HUA的病因除了患者本身嘌呤代谢异常以外,大多与患者GFR下降导致的肾脏尿酸排出减少有关,很少有临床症状,引发痛风者少见。临床医生对血尿酸轻度升高(血尿酸水平420~600 μmol/L)患者的治疗多持保守态度[1]。近年来,大量的基础以及临床研究证实HUA为肾功能减退的独立危险因素,对于慢性肾衰竭合并无症状的HUA是否需要治疗、开始治疗的时机以及目标血尿酸的水平还存在着很大的争议。为此,本研究选取CKD 2~3a期无症状的HUA患者为研究对象,分为别嘌醇治疗组和对照组,2组患者ARB、控制血压血糖、促进毒素排除等基础治疗相同。在一年观察期以后可以看到,别嘌醇治疗组患者GFR下降受到抑制,蛋白尿有减轻的趋势,但差异无统计学意义,可能与样本量少有关,提示降尿酸治疗在CKD 2~3a期合并无症状HUA的患者中有明确的治疗价值。

表1 各组患者的一般情况比较
注:与对照组比较,aP>0.05
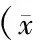
表2 2组患者治疗前、后临床指标的比较±s)
注:与治疗前比较,aP<0.05,bP<0.01;与对照组治疗后比较,cP<0.05
近年来,越来越多的研究证实,HUA是肾功能减退的独立危险因素。一项纳入16 186例血清尿酸>70 mg/L,且既往未使用过降尿酸药物的患者,观察期为36个月的队列研究发现,在经治疗达到目标血清尿酸水平≤60 mg/L的患者中,终点事件减少37%(定义为eGFR下降大于基线的30%)[2]。一项韩国的流行病学数据表明,无症状HUA患者较尿酸正常人出现慢性肾衰竭的几率明显升高[3]。当患者血尿酸大于6 mg/μl时,慢性肾衰竭的风险明显上升[4]。在CKD合并HUA患者中,尿酸与超敏C反应蛋白、血管性血友病因子水平呈正相关,提示尿酸与微炎症、血管内皮损伤有关,在CKD中发挥了不良作用[5]。在2型糖尿病患者中,HUA是出现微量白蛋白尿和肾功能减退的独立危险因素[6-7],而降低尿酸水平可以延缓肾功能减退。国外应用非布司他治疗痛风的研究证实,痛风患者中尿酸每降低1 mg/μl,可以获得1.2 ml·min-1·(1.73 m2)-1的eGFR 保护[8]。本研究的数据与前期国内外的研究结果一致,针对CKD 2~3a期合并无症状HUA的患者,降尿酸治疗可以明显延缓肾功能减退。
HUA可以过度激活肾素-血管紧张素系统,导致入球小动脉收缩,减少肾小球的灌注,增加环氧化酶2的活性,进一步引起入球小动脉平滑肌细胞的增殖。我们的研究设计中,2组患者均常规口服ARB类药物,别嘌醇治疗组仍表现出肾素-血管紧张素系统抑制以外的肾脏保护作用。通过回顾文献,高尿酸血症一方面通过肾脏内局部微晶体的形成造成肾功能损害,另一方面通过改变肾小球血流动力学参与肾脏损害。尿酸作为一种抗氧化剂,参与体内多种氧化产物反应,尿酸进入内皮细胞中,通过降低氮氧合酶的活性来影响一氧化氮的产生和释放,导致内皮功能的紊乱[9]。尿酸还可以激活细胞中MAPK途径,激活核转录因子κB、血小板源性生长因子和活化蛋白转录因子1来促进平滑肌细胞的增殖[10]。尿酸作为一种炎症因子,参与诱导趋化因子的表达和肾组织炎性反应,并促进高血压的发生等环节加速肾脏的衰竭。在动物实验中,HUA可以导致入球小动脉损伤,血管壁增厚,管腔闭塞等方式导致肾小球高压力、低灌注以及小管间质的损伤。在HUA动物试验模型中可以出现明显的肾脏纤维化,伴有肿瘤坏死因子α、转换生长因子β、血红素加氧酶1明显升高,予别嘌醇处理可部分逆转上述病变。临床活检的标本也证实,HUA可通过介导肾血管透明样变性和血管壁增厚来加重肾脏损伤[11]。
HUA是高血压和心血管疾病的独立危险因素,痛风患者跟一般人群相比较而言更易患高血压(25%~50%)、轻中度肾脏疾病(20%~60%)和心血管疾病(90%)[12]。本研究中,2组患者在治疗后都得到了有效的血压控制,但2组治疗后血压并无统计学差异,降尿酸治疗并未获得额外的血压控制方面的获益,这与其他研究者的结果并不一致[13],分析可能的原因有以下几个方面:HUA并发高血压的发病和肾素-血管紧张素系统的激活有关,2组患者均应用足量的ARB治疗,阻断肾素-血管紧张素的过度激活;慢性肾衰竭患者高血压发病率较高,且根据原发病的不同,发病机制有差异;患者的降压治疗具体方案存在个体化差异。如进一步评估降尿酸治疗是否可以获得额外血压获益,需控制相关可能导致结果偏倚的因素进一步研究。
别嘌醇是常用的降低血清尿酸水平药物,作为黄嘌呤氧化酶的异构体,能竞争性结合底物,通过有效抑制黄嘌呤脱氢酶及黄嘌呤氧化酶的活性来抑制由黄嘌呤和次黄嘌呤向尿酸和黄嘌呤的生物转化,进而控制患者体内血尿酸水平。因别嘌醇可广泛抑制嘌呤-嘧啶通路中的大量酶的活性,诱发诸多不良反应,限制了其广泛应用[14],别嘌醇的不良反应主要为药疹(96.85%);其次是发热、肝、肾功能损害、血液系统损害等,停药后多可自行缓解[15]。口服别嘌醇片后2~6 h血药浓度达峰值,约70%在肝脏代谢成活性的氧嘌呤醇;血中半衰期为1~3 h,氧嘌呤醇半衰期为12~30 h。别嘌醇主要经肾排泄, 约10%以原形、70%以代谢物随尿液排出[15],在合并有肝肾功能不全时应减量或慎用。降尿酸药物的不良反应在慢性肾功能不全患者中的发生率显著高于单纯HUA患者,这也是无症状HUA患者是否需要降尿酸治疗的重要争议点之一。本研究中,别嘌醇治疗组有3例患者出现明显皮疹,发生率为7.14%,显著高于无合并CKD的患者,皮疹患者因不良反应立即终止别嘌醇治疗,停药后皮疹自行消退,未出现严重不良反应。如需系统评估在CKD患者中别嘌醇不良反应的发生率及用药风险,需大样本多中心的研究数据来进一步评价。因此,建议在合并HUA的CKD 2~3a期患者,别嘌醇的治疗从最小剂量开始,维持量应少于常规用量,且治疗过程中需仔细观察,及时发现和处理不良反应,大多早期不良反应都能及时终止,预后较好。在CKD患者中,可以考虑应用非布司他,较别嘌醇治疗,肾脏相关不良反应较少,但由于其价格昂贵,限制其在临床中的应用。
综上所述,在CKD 2~3a期合并无症状HUA的患者中,降尿酸治疗可以有效延缓GFR的下降,保护残余肾功能。别嘌醇具有降尿酸治疗疗效确切,不良反应较少,不良反应可控,价格低廉等优点,值得推广。本研究尚存在一些不足之处:样本量较小,观察时间较短以及在慢性肾衰竭患者随着GFR的下降,别嘌醇应用中的不良反应几率明显增加等因素,还需要进一步大样本多中心数据评估慢性肾衰竭患者中降尿酸治疗的实用价值。
[1] Sivera F, Andres M, Carmona L, et al. Multinational evidence based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3e initiative[J]. Ann Rheum Dis, 2014, 73(2): 328-335.
[2] Levy GD, Rashid N, Niu F, et al. Effect of urate lowering therapies on renal disease progression in patients with hyperuricemia [J]. J Rheumatol, 2014, 41(5): 955-962.
[3] Ryoo JH. The association between uric acid and chronic kidney disease in Korean men: a 4-year follow-up study[J]. J Korean Med Sci, 2013, 28(6): 855-860.
[4] Chen YC. A preliminary investigation of the association between serum uric acid and impaired renal function[J]. Chang Gung Med J, 2009, 32(1): 66-71.
[5] 苏筠霞, 王文革, 刘明龙, 等. 慢性肾衰竭高尿酸血症患者炎症因子、 内皮功能与心脏功能改变的相关性[J]. 兰州大学学报(医学版), 2012, 38(1): 57-60.
[6] Yan D. Uric acid is independently associated with diabetic kidney disease: a cross-sectional study in a Chinese population[J]. PLoS One, 2015, 10(6): e0129797.
[7] 高超, 陈星华, 潘阳彬, 等. 2型糖尿病患者血尿酸与尿蛋白水平的相关性研究[J]. 中华肾脏病杂志, 2014, 30(1): 35-40.
[8] Whelton A. Preservation of renal function during gout treatment with febuxostat: a quantitative study[J]. Postgrad Med, 2013, 125(1): 106-114.
[9] Gersch C. Inactivation of nitric oxide by uric acid[J]. Nucleosides Nucleotides Nucleic Acids, 2008, 27(8): 967-978.
[10]Filiopoulos VD, Hadjiyannakos, Vlassopoulos D. New insights into uric acid effects on the progression and prognosis of chronic kidney disease[J]. Ren Fail, 2012, 34(4): 510-520.
[11]Kohagura K. An association between uric acid levels and renal arteriolopathy in chronic kidney disease: a biopsy-based study[J]. Hypertens Res, 2013, 36(1): 43-49.
[12]苏军霞, 李建华. 高尿酸血症与慢性肾衰竭的研究进展[J]. 甘肃医药, 2011, 30(7): 401-404.
[13]田政湘, 李泉清, 张黎. 慢性肾脏病并发高尿酸血症别嘌呤醇治疗的相关临床研究[J]. 湖南师范大学学报(医学版), 2015, 12(5): 54-56.
[14]杨雪, 薛愉, 邹和建. 非布司他临床应用及不良反应[J]. 药物不良反应杂志, 2014, 16(3): 168-170.
[15]Hamburger M. 2011 recommendations for the diagnosis and management of gout and hyperuricemia[J]. Postgrad Med, 2011, 123(6 Suppl 1): 3-36.
[16]杭永付, 高杰. 别嘌醇与秋水仙碱联用致血尿[J]. 药物不良反应杂志, 2012, 14(6): 384-385.
Effect of allopurinol on renal function in chronic kidney disease patients with asymptomatic hyperuricemia
WANGYao,YUBo.
TheAffiliatedHospitalofYangzhouUniversity, (YangzhouNO.1People'sHospital,NephrologyDepartment,EmergencyDepartment),Yangzhou225007,China
Objective To investigate the effect of allopurinol treatment on renal function in chronic kidney disease (CKD) patients with asymptomatic hyperuricemia.Methods Select the patients whom diagnosed CKD 2~3a phase with asymptomatic hyperuricemia from February 2014 to February 2015 in nephrology department of yangzhou NO.1 people's hospital. All patients were randomly divided into allopurinol treatment group and control group. Both groups treated with low salt, low fat, low protein and low purine diet, control blood pressure and blood glucose. Allopurinol treatment group received allopurinol 200 mg per day, the control group was not given uric acid lowering treatment. One year after the treatment, observing two groups of eGFR, albuminuria and blood pressure in patients.Results In allopurinol treatment group, 3 patients withdrawal due to rash, the incidence rate is 7.14%. Allopurinol treatment significantly lower blood uric acid levels after 1 year later(515.28±114.13 vs 280.21±72.58,P<0.01), the eGFR has no obvious change before and after the treatment(73.46±18.38 vs 70.37±20.11,P>0.05), while control group's blood uric acid higher(487.02±78.57 vs 545.43±89.56,P<0.05)and eGFR decline dramatically in a year later(70.43±20.65 vs 64.21±17.42,P<0.05). In allopurinol treatment group, the level of proteinuria decreased slightly(0.62±0.43 vs 0.48±0.12,P>0.05), but there was no statistical significance(P>0.05), in the control group, albuminuria have no difference before and after treatment(0.60±0.47 vs 0.64±0.37,P>0.05). Systolic blood pressure(155.44±12.12 vs 125.21±10.08,P<0.05; 157.42±14.12 vs 128.45±9.64,P<0.05) and diastolic blood pressure(88.56±10.21 vs 80.45±9.23,P<0.05; 86.45±11.56 vs 82.27±6.25,P<0.05) were significantly lower than before after treatment in both groups, but there was no statistical difference between the two groups(P>0.05).Conclusions Allopurinol slowed the decline of eGFR in CKD 2~3a phase with asymptomatic hyperuricemia.
Allopurinol; Chronic kidney disease; Hyperuricemia; Estimated glomerular filtration rate
10.3969/j.issn.1671-2390.2017.02.004
225007 江苏省扬州大学附属医院(扬州市第一人民医院)肾内科(王垚),急诊科(于博)
2016-06-26
2017-01-18)

