湖寒杂交后代母羊多羔主效基因FecB检测
李东红,马友记,许开云
(1.甘肃农业大学动物科学技术学院,兰州730070;2.甘肃肉羊繁育生物技术工程实验室,民勤733300;3.武威市畜牧兽医科学研究院,甘肃武威733000)
遗传育种与繁殖
湖寒杂交后代母羊多羔主效基因FecB检测
李东红1,2,马友记1,2,许开云3
(1.甘肃农业大学动物科学技术学院,兰州730070;2.甘肃肉羊繁育生物技术工程实验室,民勤733300;3.武威市畜牧兽医科学研究院,甘肃武威733000)
该研究以小尾寒羊、湖羊、湖寒杂交羊为实验素材,以FecB基因为候选基因,探讨多胎基因在3种羊群体中的变化规律。结果表明:小尾寒羊、湖羊、湖寒杂交羊FecB基因均有BB、B+、++三个基因型,其中小尾寒羊的基因型频率分别为0.47(70)、0.30(44)、0.23(34),湖羊的分别为0.71(117)、0.23(37)、0.06(10),湖寒杂交羊的分别为0.28(70)、0.63(156)、0.08(20);经测序发现,在746 bp处发生A→G的突变。通过对FecB的检测,为下一步湖寒杂交后代母羊选育提供了理论依据。
绵羊;FecB基因;主效基因;检测
绵羊的多胎性状属于经济性状,直接影响其养殖效益。近年来,绵羊多胎基因成为国内外研究的热点之一[1]。文献报道,FecB是影响绵羊多胎性状的主效基因之一。FecB是1980年在布鲁拉美利奴羊中发现的[2],后来证实该基因确实存在并影响绵羊排卵率和繁殖力,1989年正式被绵、山羊遗传命名委员会命名为FecB基因[3]。FecB基因编码区第746位上发生了突变位点,由A→G的改变,引起了第249位氨基酸由谷氨酰胺变为精氨酸[4]。FecB基因在绵羊中的分布范围狭小,只有在湖羊、小尾寒羊和一些杂种羊中可以检测到该基因[5]。研究发现,FecB基因对卵泡颗粒细胞的发育具有促进作用[1]。Piper认为,FecB基因多一个拷贝数可以增加1.6个卵,因此FecB被称为排卵率的“促使者”[6]。Davis等研究发现,FecB每增加一个拷贝,排卵率增加90%[7]。本研究应用PCR-RFLP方法对湖寒杂交后代母羊的FecB基因进行检测,并与产羔数进行关联分析,以期为研究绵羊多胎性及分子育种机理提供理论依据。
1 材料与方法
1.1 材料
实验动物来自甘肃省民勤县中信牧业养殖专业合作社,主要的品种:湖羊、湖寒杂交羊、小尾寒羊,总共558只。采用颈静脉采血,加肝素抗凝,采血后上下颠倒防止血液凝固,-20℃保存备用。
1.2 方法
1.2.1 DNA提取 基因组DNA的提取参照常规酚-氯仿抽提法提取血液基因组DNA。
1.2.2 引物设计 引物按照NCBI上Ovis Areas PRLR mRNA序列设计,利用Primer Premier 5.0软件设计引物,之后在NCBI上对引物进行Blast检测。设计的引物序列信息如表1,引物送到上海生工生物工程公司合成。

表1 候选基因引物序列信息
1.2.3 PCR反应条件 PCR扩增体系(20 μL):10 μL2× Taq PCR Mastermix,上下游引物(10 pmol/μL)各1 μL,模板1μL,ddH2O7μL,各成分加完以后,短暂离心后PCR。
FecB PCR扩增条件:94℃预变性5 min;94℃变性30 s;60℃退火30 s;33个循环,72℃延伸30 s;72℃延伸5 min;4℃保存。
1.2.4 产物的回收与测序 根据RFLP分析结果,挑选出不同带型的PCR产物各2个,用2%的琼脂糖凝胶进行检测,利用PCR产物回收试剂盒回收,并将回收后的产物送至上海生工生物工程技术服务有限公司进行测序。
1.3 数据统计与分析
采用Popgene32、PIC计算软件对群体的纯合度(Ho)、杂合度(He)、有效等位基因数(Ne)和多态信息含量(PIC)进行分析,并评价该群体的遗传多样性指标。
2 结果与分析
2.1 PCR扩增结果与分析
利用表1中引物序列对FecB基因进行PCR扩增,结果见图1。由图1可见,在100bp和150bp之间有1条特异性片段,与预期扩增片段大小一致,可以进行RFLP分析。

图1 FecB基因PCR扩增结果
2.2 FecB基因的PCR-RFLP结果
用AvaⅡ限制性内切酶对FecB基因的PCR产物进行检测,当746位点上发生A→G突变时,就会使AvaⅡ酶产生酶切位点;由于个体不同会导致基因型之间也存在差异,FecB基因共检测出3种不同的类型:第1种:在此位点没有突变出现,也就是说AvaⅡ限制性内切酶没有切出酶切位点,只有一个片段(140 bp)和扩增片段大小一样,例如图2中7、8泳道,此基因型被命名为野生型(+型);第2种:酶切后出现酶切位点,大小为110 bp,如图2中5、6泳道,此基因型被命名为纯合突变型(BB型);第3种:酶切后切出2条片段,大小分别为140 bp和110 bp,如图2中1~4泳道,此基因型被命名为杂合型(B+型)。

图2 FecB基因扩增产物AvaⅡ酶切结果
2.3 FecB基因的遗传学结构分析
由表2可知,3种基因型(BB、B+和++)均可在小尾寒羊、湖羊、湖寒杂交后代母羊群体中检测到,BB型为优势基因型,B基因为优势等位基因。由表3可知,小尾寒羊属于中度多态(0.25<PIC<0.5),χ2适合性检验表明小尾寒羊群体处于Hardy-Weinberg平衡状态(P>0.05);湖羊属于低度多态(P<0.25),χ2适合性检验表明湖羊处于Hardy-Weinberg平衡状态(P>0.05);湖寒杂交属于中度多态(0.25<PIC<0.5),χ2适合性检验表明,湖寒杂交羊处于Hardy-Weinberg非平衡状态(P<0.05)。
2.4 生物信息学分析
对候选基因进行了生物信息学分析。检测到FecB基因分子量为6 613.73 Da;编码58个氨基酸;28种疏水性氨基酸;12种极性氨基酸;理论等电点为pI=6.30;pH=7.0时,电荷为-0.817;Arg、Leu、Ser在氨基酸中含量最多,占氨基酸总数的12.1%;其次是Val、Pro、Gly、Ala、Thr,占氨基酸总数的8.6%;Ile占氨基酸总数的6.9%;Asp、Asn、Glu、Lys、His、Cys、Gln、Phe、Tyr占氨基酸总数的5.2%;含量最少的是Met,占氨基酸总数的3.4%。使用DNAMAN软件将绵羊FecB基因的mRNA序列与山羊、牛、狗、猪、鼠和人类序列进行同源性对照,结果显示与山羊(Capra hircus,NCBI登录号:NM-001285575.1)、牛(Bos taurus,NCBI登录号:NM-001105328.1)、猪(Sus scrofa,NCBI登录号:NM-001039745.1)、狗(Canis Iupus,NCBI登录号:NM-001145151.1)、鼠(Mus musculus,NCBI登录号:NM-0011277218.1)、人类(Homo sapiens,NCBI登录号:NM-001256792.1)的相似性分别是,与山羊的同源性最高为98.81%,其次是与牛的同源性为98.21%,与猪和人类的同源性对比分别为93.24%、93.04%,与狗和鼠的同源性对比分别为92.58%、88.93%,这也表明与山羊的亲缘关系最近,与鼠的亲缘关系较远。
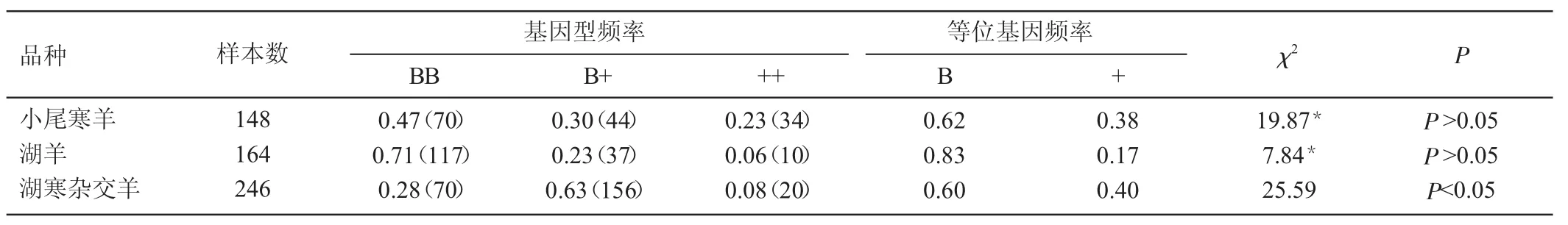
表2 FecB基因在羊群体中的基因频率和基因型频率

表3 FecB基因在羊群体中的Ho、He、Ne、PIC
3 讨论与小结
绵羊的高繁殖力性能一直受到研究者的关注,目前在多羔绵羊品系中发现多个候选基因,其中以Booroola Merino羊的多羔机制了解的最为清楚[8]。FecB性状仅在雌性中表达,并且直到初情期之后才能准确度量,所以运用DNA检测比基于产羔数或排卵率的选择具有明显优势。DNA检测能同时用于雄性和雌性,可从生后不久的羔羊中收集样本,如果需要也可以检测胚胎。当表型不是很好地与基因型相关联时,例如具有隐性等位基因的位点,外显率不完全时,或当基因是遗传印记(genetic imprinting)的时候,DNA检测将为育种方案提供更快的变化[1]。
Davis等检测了世界21个羊种群(家系),仅在中国湖羊和小尾寒羊中发现FecB突变[5]。本研究通过对246个湖寒杂交群体样本量的酶切检测,结果显示FecB基因在湖寒杂交羊中均可检测到3种基因型(BB、B+和++),B+型为优势基因型,B基因为优势等位基因。湖寒杂交属于中度多态(0.25<PIC<0.5)。χ2适合性检验表明,湖寒杂交羊处于Hardy-Weinberg非平衡状态(P<0.05)。说明FecB基因可能是湖寒杂交羊多羔性能的主效基因之一。中国有31个地方绵羊品种,只有少数是多羔品系,其中较为著名的是小尾寒羊(产羔率261.0%)和湖羊(产羔率228.92%)。湖寒杂交羊高繁殖力的分子机理研究,对这一优势资源的保护与开发,以及培育肉用多羔绵羊新品系具有重要意义。
本实验应用PCR-RFLP研究了FecB基因在小尾寒羊、湖羊、湖寒杂交后代母羊的遗传规律,发现FecB基因中的BB型的频率呈降低趋势,揭示了多胎主效基因代际之间的变化特征。
[1]张利平.Booroola羊多胎基因FecB的研究进展[J].中国草食动物,2004,24(S1):48-50.
[2]Piper L R,B M Bindon.The Booroola Merino and the performance of medium non-Peppin crosses at Armidale[J].CSIRO,Melbourne,1982:9-19.
[3]顾招兵,毛华明.绵羊FecB基因研究进展[J].中国畜牧兽医,2005,32(11):28-31.
[4]陈晓勇,敦伟涛,田树军,等.FecB基因对绵羊生产性能影响的研究进展[J].中国草食动物科学,2012,32(4):59-65.
[5]Davis G H,Balakrishnan L,Ross I K,et al.Investigation of the Booroola(FecB)and Inverdale(FecXI)mutationsin 21 prolific breeds and strains of sheep sampled in 13 countries[J].Animal Reproduction Science,2006,92(1):87-96.
[6]Piper LR,Bindon BM,Davis GH.Genetics ofreproduction in Sheep[M].London:Buttenworths,1985:115-125.
[7]Davis G H,Dodds K G,Wheeler R,et al.Evidence that an imprinted gene on the X chromosome increases ovulation rate in sheep[J]. BiologyofReproduction,2001,64(1):216-221.
[8]任艳玲,沈志强,李敏,等.洼地绵羊FecB基因多态性与其产羔数关系的研究[J].中国畜牧兽医,2011,38(7):159-161.
Detection on Fecundity FecB Gene of Hu Sheep,Small-tail Han Sheep and Their Crossbred Ewes
Li Donghong1,2,Ma Youji1,2,Xu Kaiyun3
(1.College ofAnimal Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;2.Sheep BreedingBiotechnologyEngineeringLaboratory,Minqin 737200,Gansu,China;3.Wuwei AcademyofAnimal Husbandryand VeterinaryScience,Wuwei 733000,Gansu,China)
Inorder toexplorethevariationoffecunditygeneintheflockofHusheep,Small-tailhansheepandtheir crossbredewes,the FecB gene were detected.The results showed that the FecB gene had three gene types of BB,B+and++.The gene type frequencies of the FecB gene in Small-tail han sheep were 0.47(70),0.30(44)and 0.23(34),respectively;the gene type frequencies of the FecB gene in Hu sheep were 0.71(117),0.23(37)and 0.06(10),respectively,the gene type frequencies of the FecB gene in their crossbred ewes were 0.28(70),0.63(156)and 0.08(20),respectively.The sequence analysis showed that there was a mutation at 746 bp(A→G).This detection would provide a theoretical basis for the further breedingofhybrid offspring.
sheep;FecB gene;major gene;detection
S826.2
A
2095-3887(2017)02-0001-03
10.3969/j.issn.2095-3887.2017.02.001
2017-02-16
甘肃省科技重大专项计划(1602NKDH020);国家肉羊产业技术体系项目(CARS-39)
李东红(1990-),在读硕士。
马友记(1976-),教授,主要从事绵山羊繁育与疫病防治工作。

