葛根素通过p38MAPK通路抑制MC3T3-E1成骨细胞凋亡*
于冬冬,赵丹阳
(1.辽宁中医药大学附属医院 骨一科,辽宁 沈阳110032;2.辽宁省沈阳市第一人民医院神经内科,辽宁 沈阳110041)
葛根素通过p38MAPK通路抑制MC3T3-E1成骨细胞凋亡*
于冬冬1,赵丹阳2
(1.辽宁中医药大学附属医院 骨一科,辽宁 沈阳110032;2.辽宁省沈阳市第一人民医院神经内科,辽宁 沈阳110041)
目的 探索葛根素(PUE)抑制地塞米松(DEX)诱导的MC3T3-E1细胞凋亡的机制。方法 MC3TEE1细胞培养传代,MTS法检测不同浓度的PUE及DEX对MC3T3-E1细胞增殖活性的影响,免疫荧光检测PUE对细胞凋亡的抑制作用,Western blot检测p38MAPK、p-p38MAPK的蛋白表达情况。Real time PCR检测Caspase-3的基因表达情况。ELISA检测加入p38MAPK通路抑制SB203580后对凋亡的影响。结果 MTS显示10-7、10-8mol/L浓度的PUE作用24 h后明显增加细胞的增殖活性,10-6、10-7mol/L浓度的DEX作用48 h后抑制细胞增殖并诱导细胞凋亡,免疫荧光显示加入10-8mol/L的PUE后细胞凋亡受到抑制。Western blot结果显示,加入DEX后,p-p38MAPK的表达上调,DEX和PUE共同处理后,DEX诱导的p-p38MAPK的磷酸化受到抑制。Real time PCR显示,DEX处理后Caspase-3 mRNA基因表达明上调,而DEX和PUE共同作用后,Caspase3 mRNA基因表达下调。ELISA显示DEX处理后,细胞的凋亡明显增加。加入PUE+DEX处理后,细胞的凋亡受到抑制,基本恢复到正常的水平。SB203580+DEX共同处理后,细胞凋部分被抑制。结论 葛根素抑制地塞米松诱导的MC3TE-E1细胞凋亡通过p38MAPK通路。
葛根素;地塞米松;凋亡;p38MAPK
糖皮质激素(glucocorticoids,GCs)被广泛应用于临床,其长期应用存在较高的骨丢失及骨折的风险,临床上称之为GCs诱导的骨质疏松(glucocorticoidinduced osteoporosis,GIOP),GIOP最主要的原因是骨的形成受到抑制[1]。大量或长期应用GCs抑制成骨细胞的成熟和分化,促进成骨细胞的凋亡。葛根素(puerarin,PUE),是传统中药葛根的主要异黄酮,在治疗各种疾病中已得到广泛应用[2-6]。研究发现,葛根素具有抗细胞凋亡的作用,如肝细胞、肾细胞和神经细胞[7-9]。葛根素能否抑制地塞米松(dexamethasone,DEX)诱导的成骨细胞凋亡及其抗凋亡机制是本研究的重点。
1 材料与方法
1.1 药物与试剂
葛根素(溶于无水乙醇,储存浓度10-5mol/L,置入-20℃冰箱冷冻保存,南京狄尔格公司),地塞米松(Dexamethasone,溶于无水乙醇,储存浓度10-5mol/L,置入-20℃冰箱冷冻保存,Sigma公司),a-MEM培养基(Hyclone),细胞增殖与毒性检测(MTS)试剂盒(Promega,美国),细胞凋亡酶联免疫吸附剂测定(enzyme-linked immunosorbentassay,ELISA)试剂盒(罗氏公司,德国),p38MAPK、p-p38MAPK抗体(Cell signaling公司,美国),Real time PCR试剂盒(TaKaRa,大连),细胞免疫固定液、细胞免疫洗涤液、抗荧光淬灭封片液、DAPI染液、BCA蛋白浓度检测试剂盒均购自碧云天有限公司。
1.2 主要仪器
倒置相差显微镜(Olympus,日本),PCR仪器(Mx 3000P real time PCR system,Applied Biosystems,美国),培养箱(Sanyo,日本),免疫荧光显微镜(Nikon,日本)。
1.3 实验方法
1.3.1 MC3T3-E1细胞培养 小鼠成骨细胞株MC3T3-E1,购自美国American Type Culture Collection(ATCC)。细胞培养方法[10],a-MEM培养基:含10%胎牛血清,用20 mmol/L羟乙基哌嗪乙磺酸(hydroxyethyl piperazine ethanesulfonic acid,HEPES),100 u/ml青霉素,链霉素100 μg/ml,50 μg/ml的抗坏血酸,在37℃、5%二氧化碳CO2孵箱内进行培养。2次/周换液,细胞传代培养用0.05%胰蛋白酶和0.01%的乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)。
1.3.2 MTS测定PUE及DEX对细胞增殖活性的影响 细胞分组:空白组、培养基组、对照组、10-6~10-10mol/L的PUE组及DEX组。细胞平铺(5× 103个细胞/孔)96孔平板中,每孔总体积应为100μl,培养24 h后,按分组加入不同浓度的PUE 及DEX,细胞经处理(PUE 24 h、DEX 48 h)后,每孔加20μl CellTiter 96 AQueous One Solution Reagent。在37℃,5%CO2的细胞培养箱中孵育2 h。490 nm读取吸光度值。OD值=(PUE处理后细胞OD值或对照组细胞OD值-培养基组OD-空白组OD值),n>3。
1.3.3 免疫荧光检测DEX诱导hFOB1.19细胞的凋亡 细胞分组:①对照组;②DEX(10-6mol/L);③DEX(10-6mol/L)+PUE(10-8mol/L)。MC3T3-E1细胞(3×104细胞/孔)铺于6孔板中,细胞达到70%融合后。①加入培养基;②加入DEX处理48 h;③PUE预处理24 h后加入DEX处理48 h,吸除培养基。磷酸盐缓冲溶液(phosphate buffered solution,PBS)清洗细胞3 min×2,每孔加入细胞免疫固定液1 ml,固定60 min,PBS清洗细胞3 min×2,加入细胞免疫洗涤液1 ml(含Trixon 100),冰浴2 min。PBS清洗细胞3 min×2,每孔加入1 ml DAPI染液,避光孵育5 min后,加入抗荧光淬灭封片液封片后,免疫荧光显微镜下观察并计数。细胞凋亡率=每视野凋亡细胞/每视野细胞总数,n>3。
1.3.4 Western blot检测 p38MAPK、p-p38MAPK抗体蛋白表达 细胞分组:DEX(10-6mol/L)对蛋白表达影响(对照组,DEX处理后5、30及60 min),PUE(10-8mol/L)对DEX处理后蛋白的表达影响(对照组,DEX组,DEX+PUE组控,细胞处理方法同1.3)。细胞加入裂解液提取蛋白,冰上放置40 min,4℃ 12 000 r/min离心40 min,取上清液,BCA法定量蛋白。取20 μg蛋白样品,于10%聚丙烯酰胺凝胶上行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE),电泳结束后100 V电转印至聚偏(二)氟乙烯(polyvinylidene difluoride,PVDF)膜上。将PVDF膜放入封闭液中37℃封闭1h,稀释一抗4℃孵育过夜。PBS洗膜3次,加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的稀释二抗孵育,37℃震摇1 h,洗膜。增强化学发光法(enhanced chemiluminescence,ECL)曝光成像,扫描入电脑。
1.3.5 Real time Quantitative PCR测定Capsase-3 mRNA表达 在Genebank搜索到目的基因,用Premier 5设计引物并合成。MiniBEST Universal RNA Extraction Kit(TaKaRa)提取总RNA,按照Prime Scrip RT master Mix kit(TaKaRa)cDNA第一链合成试剂盒说明书逆转录成cDNA。PCR反应体系20 μl,其中cDNA 1 μl,上下游引物各0.5μl,SYBR Premix Ex Taq(TaKaRa)10μl,双蒸水(ddH2O)补足至20 μl,PCR反应程序为:95℃ 10 min,95℃ 10 s,58℃ 20 s,72℃ 30 s,40个循环;4℃ 5 min。反应结束后采用Mx 3000P real-time PCR system进行定量分析。结果重复3次,与管家基因β-action进行标准化,并与对照组比较后的倍数值。
1.3.6 ELISA检测细胞凋亡情况 细胞分组:对照组、DEX(10-6mol/L)处理组、PUE(10-8mol/L)处理组、DEX(10-6mol/L)+PUE(10-8mol/L)处理组、SB203580(10-5mol/L)组、SB203580(10-5mol/L)+DEX (10-6mol/L)组,将细胞以每孔1 ml细胞悬浮液(1× 104细胞)接种于24孔板内,按住分组的要求,预处理PUE 24 h、SB203580 3 h后再加入DEX 48 h后,去上清液,加入细胞0.5ml lysis buffer(室温30 min),15 000 r/min(室温10 min),转移上清液20 μl和80 μl immunoreagent(containing anti-histone and anti-DNA)加入streptavidin-coated微孔板(室温2 h)应用incubation buffer洗涤微孔板3次,加入100 μl 的ABTS solution入孔孵育(approx.,室温15 min),待溶液显色后测量405 nm的吸光度值。
1.4 统计学方法
数据处理采用SPSS 11.5统计软件,计量数据以均数±标准差(±s)表示,多组间比较用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PUE促进MC3T3-E1细胞的增殖活性
MC3T3-E1细胞在不同浓度的葛根素作用下24 h,MTS法检测细胞的吸光度值,MTS结果显示葛根素处理后,葛根素增加细胞的增殖活性(F=26.743,10-7mol/L组的t=2.611,10-8mol/L组的t=2.843,与对照组相比较,P=0.001)。其中10-8mol/L葛根素具有最大的促细胞增殖作用。见图1。
2.2 DEX抑制MC3T3-E1细胞的增殖活性
MC3T3-E1细胞在不同浓度的DEX作用下48 h,MTS法检测细胞的吸光度值,MTS结果显示葛根素处理后,DEX能够抑制细胞的增殖活性(F= 12.663,10-6mol/L组的t=3.134,10-8mol/L组的t= 2.714,与对照组相比较,P=0.041)。其10-6mol/L的DEX具有最大的抑制细胞增殖的作用。见图2。

图1PUE增加MC3T3-E1细胞的增殖活性
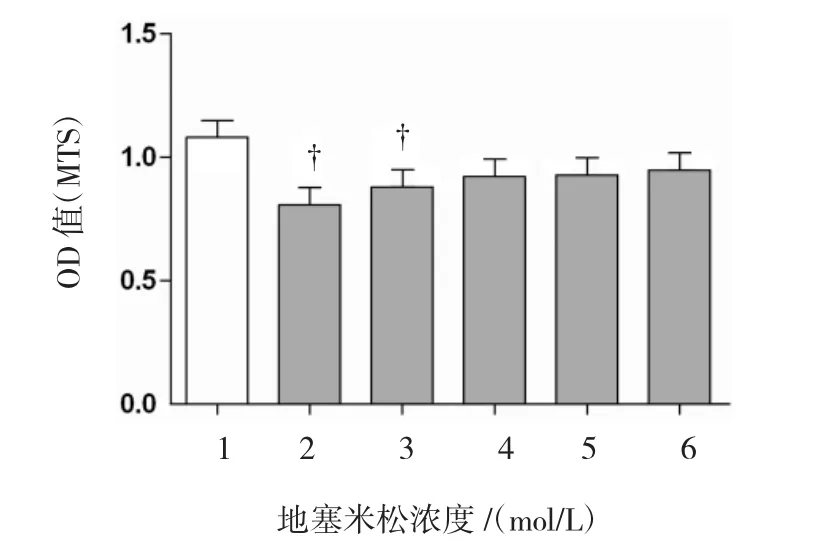
图2DEX抑制MC3T3-E1细胞的增殖活性
2.3PUE抑制MC3T3-E1细胞凋亡
细胞凋亡率:对照组2%,DEX 10-6mol/L 13.1%,DEX 10-6mol/L+PUE 10-8mol/L组5.2%。细胞培养液中加入DEX处理48 h后,DAPI染色细胞核,荧光显微镜下可见对照组细胞的胞核形态大小较为一致,均匀蓝染,加入地塞米松后细胞凋亡增多,细胞凋亡后,细胞核的形态发生变化,核膜的皱缩,细胞核的浓聚,细胞的核的碎裂,凋亡小体的形成。加入PUE后细胞凋亡的数量减少,凋亡受到抑制(见图3)。

图3PUE抑制DEX诱导MC3T3-E1细胞凋亡
2.4 PUE抑制DEX诱导的p38MAPK的磷酸化
Western blot结果显示,加入DEX(10-6M)后,p-p38MAPK的表达逐渐上调,60 min时蛋白的表达最多(t=3.451),与对照组较,差异有统计学意义(P= 0.038),PUE处理后,DEX诱导的p-p38MAPK的磷酸化受到抑制(t=2.142),与DEX单独处理比较,差异有统计学意义(P=0.062),见图4、5。

图4DEX诱导MC3T3-E1细胞p-p38MAPK蛋白表

图5PUE抑制DEX诱导MC3T3-E1细胞p-p38MAPK蛋白表
2.5 PUE抑制DEX处理后的Caspase3的mRNA基因表达
葛根素(10-7mol/L,10-8mol/L)预处理24 h后,再加入DEX(10-5mol/L)作用72 h后,Real time quantitivePCR检测Caspase-3的mRNA表达。结果显示,DEX处理后Caspase-3的mRNA基因表达上调,而PUE作用后,Caspase-3的mRNA基因表达较DEX单独处理下调,但略高于对照组的水平(F=0.961,10-7mol/L组的t=7.612,10-8mol/L组的t=6.425),与对照组相比较,差异有统计学意义(P=0.001)。
Caspase-3,正向引物:5'-TGTGAGGCGGTTGTA GAAGTT-3',反向引物:5'-GCTGCATCGACATCTGT ACC-3'。β-actin,正向引物:5'-ATCATGTTTGAGA CCTTCAACA-3',反向引物:5'-CATCTCTTGCTCGAA GTCCA-3'。见图6。
2.6 p38MAPK通路参与PUE抑制DEX诱导的成骨细胞的凋亡
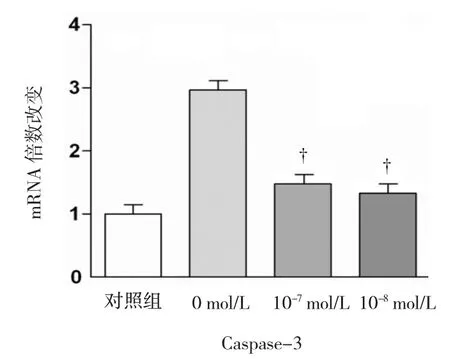
图6 葛根素抑制Caspase-3 mRNA表达

图7PUE抑制DEX诱导的MC3T3-E1细胞的凋亡通过p38MAPK通路
为确定葛根素的作用机制,ELISA测定加和不加入SB203580(p38MAPK通路的抑制)后对细胞凋亡情况的影响。结果显示,DEX处理后,细胞的凋亡增加(F=83.970,t=10.001),与对照组比较,差异有统计学意义(P=0.001)。加入PUE后,细胞的凋亡受到抑制,基本恢复到正常的水平(F=83.970,t=3.114),与DEX组比较,差异有统计学意义(P=0.023),加入SB203580处理后,细胞凋亡凋亡水平下降(F=83.970,t=2.012),与DEX组比较,差异有统计学意义(P= 0.046)。结果说明加入SB203580后,PUE抑制DEX诱导细胞凋亡的作用部分被废除,除p38MAPK通路外还可能存在其他的通路参与PUE调节的成骨细胞凋亡(见图7)。
3 讨论
应用自然的植物化学成分治疗骨质疏松,越来越多的受到人们的重视。中药成分具有取材方便、疗效稳定、副作用小等优点,广泛应用于临床治疗各类疾病。葛根素,是中药葛根的主要异黄酮,能够促进成骨细胞的分化,抑制成骨细胞的凋亡[11-12]。实验结果显示,抑制葛根素能够抑制地塞米松诱导的MC3T3-E1成骨细胞凋亡,通过抑制p38MAPK通路,并能够抑制Caspase-3的激活。
丝裂原活化蛋白激酶(MAPK)是丝/苏氨酸蛋白激酶家族,包括p38,JNK和ERK1/2(p44/p42)。将外部的信号转导到细胞内部,引起细胞核发生反应,在维持细胞形态稳定、增殖、分化和凋亡过程中起着重要的作用。研究显示,p38MAPK通路参与调节细胞的生长、发育、凋亡及应对应激和细胞因子的反应,参与成骨细胞的分化、增殖及糖皮质激素诱导的细胞凋亡[13-16]。该实验结果显示,DEX诱导细胞凋亡的过程中,激活p38MAPK信号转导通路,以此同时,葛根素发挥其抗成骨细胞凋亡作用通过抑制该通路发挥做作用。
丝裂原活化蛋白激酶(MAPK)活化后启动凋亡信号传导通路,细胞外的促凋亡信号通过信号转导机制能够引起内在的凋亡级联反应。内源性及外源性的凋亡通路最终都会聚集在Caspase-3,凋亡执行的蛋白酶,Caspase-3的激活最后导致细胞凋亡[17-18]。作为凋亡程序中最后的执行者,Caspase-3发挥重要的枢纽作用,磷酸化的p38MAPK能够激活Caspase-3的活性,启动了凋亡通路[19-23],活化的Caspase-3又进一步切割不同的底物,导致蛋白酶级联切割放大,最终使细胞走向凋亡[24]。本研究发现,DEX诱导Caspase-3的激活。加入葛根素后,能够抑制Caspase-3的激活,说明葛根素发挥其抗凋亡作用,与抑制Caspase-3的激活有关。
细胞凋亡发生时,由于钙-镁依赖性核酸酶进入核小体间切割DNA,产生180~200 bp或其倍数的核小体片段。而核小体由于与组蛋白形成紧密复合物而不被核酸内切酶切割。应用ELISA法可以特异性的检测细胞溶解物中的核小体片段。实验中,为了评价p38MAPK通路在PUE抑制DEX诱导的细胞凋亡中的药理作用,笔者应用ELISA法进行检测细胞的凋亡情况,结果显示,DEX处理后,细胞的凋亡增加。加入PUE后细胞的凋亡受到抑制,基本恢复到了正常的水平,能够废除DEX诱导的成骨细胞凋亡。细胞预处理 p38MAPK的特异性抑制剂SB203580后,DEX诱导的细胞凋亡部分被抑制。说明加入SB203580后能够降低但不能够废除DEX诱导的促成骨细胞凋亡,也说明p38MAPK信号转导通路是PUE抑制DEX诱导的成骨细胞凋亡通路之一,PUE发挥其抑制凋亡作用,还存在其他的药理学机制。
本实验验证,PUE能够抑制DEX诱导的MC3T3-E1成骨细胞凋亡,通过抑制p38MAPK通路完成。为PUE临床治疗GIOP提供理论基础。
[1] SUZUKI,YASUO.Glucocorticoid induced osteoporosis[J].Nihon Rinsho,2015,73(10):1733-1799.
[2] GE L J,FAN S Y,YANG J H,et al.Pharmacokinetic and pharmacodynamic analysisofferulic acid-puerarin-astragaloside in combination with neuroprotective in cerebral ischemia/reperfusion injury in rats[J].Asian Pac J Trop Med,2015,8(4):299-304.
[3] LIU Y,XUE Q,LI X,et al.Amelioration of stroke-induced neurologicaldeficiency by lyophilized powderofcatapoland cuerarin[J].Int J Biol Sci.2014,10(4):448-456.
[4] CUI S Q,WANG Q,ZHENG Y,et al.Puerarin protects against damage to spatial learning and memory ability in mice with chronic alcohol poisoning[J].Braz J Med Biol Res,2015,48(6): 515-522.
[5] ZHEN O Y,ZHAO M,TANG J M,et al.In vivo pharmacokineticcomparisons of ferulic acid and puerarin after oral administration of monomer,medicinal substance aqueous extract and Nao-De-Sheng to rats[J].Harmacogn Mag,2012,8(32):256-262.
[6] LI X,ZHANG J,GAO Y,et al.Puerarin alleviates burn-related procedural pain mediated by P2X3 receptors[J].Urinergic Signal, 2011,7(4):489-497.
[7] LIU C M,MA J Q,SUN Y Z.Puerarin protects the rat liver against oxidative stress mediated DNA damage and apoptosis induced by lead[J].Exp Toxicol Pathol,2012,64(6):575-582.
[8] LIU C M,MA J Q,SUN Y Z.Puerarin protects rat kidney from lead induced apoptosis by modulating the PI3K/Akt/eNOS pathway[J].Toxicol Appl Pharmacol,2012,258(3):330-342.
[9]LI J,WANG G,LIU J,et al.Puerarin attenuates amyloid beta induced cognitive impairment through suppression of apoptosis in rat hippocampus in vivo[J].Eur J Pharmacol,2010,649(1/2/3): 195-201.
[10] YUAN L Q,LU Y,LUO X H,et al.Taurine promotes connective tissue growth factor (CTGF)expression in osteoblasts through the ERK signal pathway[J].Amino Acids,2007,32(3): 425-430.
[11] DONG W,LIM,JAE G,et al.Effects of dietary isoflavones from puerariae radix on lipid and bone metabolism in ovariectomized rats[J].Utrients,2013,5(7):2734-2746.
[12] WONG R,RABIE B.Effect of puerarin on bone formation[J]. Osteoarthritis Cartilage,2007,15(8):894-899.
[13] CHANDRIKA D M,TANUKA D,RASHMI V P,et al.Mitogenactivated protein kinase phosphatase 1 regulates bone mass,osteoblast gene expression,and responsiveness to parathyroid hormone[J].J Endocrinol,2011,211(2):145-156.
[14] CHANDRASEKARAN S,RAMACHANDRAN A,EAPEN A,et al.Stimulation of periodontal ligament stem cells by dentin matrix protein 1 activates mitogen-activated protein kinase and osteoblast differentiation[J].J Periodontol,2013,84(3):389-395.
[15] REDDI D,BROWN S J,BELIBASAKIS G N.Porphyromonas gingivalis induces RANKL in bone marrow stromal cells:Involvement of the p38 MAPK[J].Microb Pathog,2011,51(6), 415-420.
[16] GE C X,YANG Q,ZHAO G,et al.Interactions between extracellular signal-regulated kinase 1/2 and p38 MAP kinase pathways in the control of RUNX2 phosphorylation and transcriptional activity[J].J Bone Miner Res,2012,27(3):538-551.
[17] HONG-MIN N I,CATHERINE J B,NA L I,et al.Bid regulates murine hepatocyte proliferation by controlling ER calcium homeostasis[J].Hepatology,2010,2(1):338-348.
[18] ANNA L,JULIA S,MARIA T,et al.Interleukin-1β enhances fasL-induced caspase-3/-7 activity without increasing apoptosis in primary mouse hepatocytes[J].PLoS One,2014,9(12): e115603.
[19] CHIKAKO N,HIROSHI K,HIDENORI E,et al.Involvement of mitogen-activated protein kinase 20.pathways in expression of the water channel protein aquaporin-4 after is chemia in rat cortical astrocytes[J].J Neurotrauma,2012,29(14):2404-2412.
[20] THOMAIS M,DAVID J,CHAMBERS.Lung injury after simulated cardiopulmonary bypass in an isolated perfused rat lung preparation:Role of mitogen-activated protein kinase/Akt signaling and the effects of theophylline[J].J Thorac Cardiovasc Surg, 2014,148(5):2335-2344.
[21] HARI K K,MINTU P,SWEATY K.Role of p38 MAP kinase kignal kransduction in kolid kumors[J].Genes Cancer,2013, 4(9/10):342-359.
[22] VIRGINIA P,ANA I R,IVANA B A,et al.Phosphorylation of mitogen-activated protein kinases contributes to interferon γ production in response to mycobacterium tuberculosis[J].J Infect Dis,2013,207(2):340-350.
[23] SHI G X,DOUGLAS A,CAI W K.Ras family small GTPasemediated neuroprotective signaling in stroke[J].Cent Nerv Syst Agents Med Chem,2011,11(2):114-137.
[24] KENNETH M,ZHAO Z C,WANG S H,et al.Oxidant stress and signal transduction in the nervous system with the PI 3-K, Akt,and mTOR cascade[J].Int J Mol Sci,2012,13(11):13830-13866.
Puerarin inhibited MC3T3-E1 human osteoblast clees apoptosis through P38MAPK pathway*
Dong-dong Yu1,Dan-yang Zhao2
(1.Department of Orthopedics,Liaoning University of Traditional Chinese Medicine, Shenyang,Liaoning 110032,China;2.Department of Neurology,Shenyang First People's Hospital,Shenyang,Liaoning 110041,China)
Objective To detect the mechanism of Puerarin inhibited Dexamethasone-induced MC3TE-E1 cells apoptosis.Methods The MC3TE-E1 cells were cultured and passaged,and MTS and immune fluo rescence were used to detect proliferation effect of different concentration of Puerarin and Dexamethasone in MC3TE-E1 cells and the the protect effect of Puerarin in MC3TE-E1 cells respectively.Western blot was used to detect the p38MAPK,p-p38MAPK protein expression.Realtime PCR were used to detect Caspase-3 gene expression.ELISA detection was used to clarified the anti-apoptotic effect of p38MAPK inhibitior, SB203580,on cells apoptosis.Results MTS results showed that 10-7,10-8mol/L puerarin increased the cell proliferation significantly,and the concentration of DEX at 10-6,10-7mol/L after treatment of 48 h inhibited the cell proliferation.Immunofluorescence results showed that 10-8mol/L puerarin could inhibited DEX-induced cells apoptosis.Western blot results showed after DEX treatment,the expression of p-p38MAPK increased,and after DEX and PUE cotreatment,DEX induced p-p38MAPK phosphorylation was inhibited.Realtime PCRshowed gene expression of Caspase-3 mRNA was up-regulated after DEX treatment,while gene expression of Caspase-3 mRNA down-regulated after cultured with DEX and PUE.ELISA showed that cells apoptosis increased after DEX treatment alone,when combined wit PUE,cells apoptosis was reduced to the normal levels, and when combined SB203580 with DEX,cells apoptosis induced by DEX were abolished partially.Conclusions Puerarin inhibits dexamethasone-induced MC3TE-E1 cells apoptosis through p38MAPK pathway.
Puerarin;Dexamethasone;Apoptosis;P38MAPK
R34
A
10.3969/j.issn.1005-8982.2017.05.002
1005-8982(2017)05-0007-06
2015-12-29
辽宁省教育厅(No:L201621)

