人抗酶抑制因子-1的原核表达纯化及多克隆抗体的制备
吕亚丰 杨建林 秦宇 王艳林
(三峡大学医学院 肿瘤微环境与免疫治疗湖北省重点实验室,宜昌 443002)
人抗酶抑制因子-1的原核表达纯化及多克隆抗体的制备
吕亚丰 杨建林 秦宇 王艳林
(三峡大学医学院 肿瘤微环境与免疫治疗湖北省重点实验室,宜昌 443002)
原核表达纯化人抗酶抑制因子-1((antizyme inhibition factor-1,AZIN1),制备并鉴定抗AZIN1多克隆抗体。pET-28a/AZIN1表达质粒转化大肠杆菌BL21(DE3)后,IPTG诱导蛋白表达,利用Ni-NTA 树脂于变性条件下亲和层析纯化人AZIN1蛋白。将重组AZIN1蛋白用作抗原免疫BALB/c小鼠以制备多克隆抗体,ELISA检测抗AZIN1抗体效价,Western bloting、细胞免疫荧光、细胞免疫化学方法检测抗体的应用。结果显示,重组pET-28a/AZIN1表达质粒经酶切及测序鉴定构建正确。细菌内重组AZIN1蛋白可被IPTG诱导表达并以包涵体的形式存在。用亲和层析法能有效纯化原核表达的AZIN1蛋白,该蛋白在小鼠体内能够诱导抗AZIN1特异性抗体产生,血清效价达到1∶640 000。制备抗体能够特异性识别和结合人及小鼠瘤细胞中表达的AZIN1蛋白,并可有效用于AZIN1的Western blotting、细胞免疫荧光和细胞免疫化学分析。成功原核表达和纯化了人AZIN1蛋白并制备了抗AZIN1多克隆抗体,为深入研究AZIN1在调控细胞增殖及在疾病防治中的作用提供了研究基础。
抗酶抑制因子;原核表达;抗体
多胺(腐胺、精脒和精胺)是一类带正电荷的烷基类小分子化合物,广泛存在于真核细胞并参与细胞的增值、分化及凋亡等重要的生理过程,其在细胞内的合成、分解及摄取受到严密的调控以维持体内的多胺代谢稳衡[1,2]。抗酶抑制因子-1(antizyme inhibition factor-1,AZIN1)是细胞内参与多胺代谢调节的重要蛋白因子,它通过与鸟氨酸脱羧酶抗酶(Ornithine decarboxylase antizyme,OAZ)结合而解除后者对多胺合成途径限速酶鸟氨酸脱羧酶(ornithine decarboxylase,ODC)的抑制作用,从而上调细胞内的多胺合成速度[3,4]。近年来研究发现,除参与调控多胺代谢外,AZIN1还可以通过干扰中心体的复制以及直接与细胞周期相关蛋白相互作用而影响细胞的分裂和增殖[5,6],AZIN1表达异常也被发现与细胞增殖异常性疾病,如肿瘤的发生与发展密切相关[7]。鉴于AZIN1在维持多种正常生理功能中的重要性和与疾病发生的密切相关性,本研究旨在建立人AZIN1蛋白原核表达纯化的实验技术,并用原核表达的AZIN1蛋白为抗原制备抗AZIN1多克隆抗体,以期为进一步研究AZIN1在调控细胞增殖及在疾病防治中的作用奠定研究基础。
1 材料与方法
1.1 材料
pET-28a/AZIN1表达质粒、大肠杆菌菌株DH5α和BL21(DE3)由作者实验室保存,限制性核酸内切酶购自美国 Fermentas 公司,兔抗His多克隆抗体为美国Proteintech公司产品;HRP标记的羊抗兔IgG 由北京中杉金桥生物技术有限公司提供;Cy3标记的羊抗鼠IgG购自武汉博士德生物工程有限公司,ECL显色液为美国 Thermo Scientific公司产品;Ni-NTA 树脂为德国 Novagen 公司产品;弗氏不完全佐剂和弗式完全佐剂为购自美国 Sigma-aldrich 公司,其它化学试剂由美国Sigma等公司提供,DNA测序由上海生工公司完成。
1.2 方法
1.2.1 pET-28a/AZIN1质粒鉴定 pET-28a/AZIN1表达质粒转入大肠杆菌DH5α,在含有卡拉霉素的琼脂平板内筛选后,挑取单克隆菌落,接种到含有卡拉霉素的LB液体培养基中,37℃过夜培养,提取质粒后,用限制性酶切及DNA测序鉴定。
1.2.2 人AZIN1蛋白原核表达 将测序正确的重组pET-28a/AZIN1质粒转入大肠杆菌菌株BL21(DE3)中,在含有卡拉霉素的琼脂平板筛选阳性克隆,挑取阳性克隆接种到3 mL含有卡拉霉素的LB液体培养基中,待菌液OD值达到0.6-0.8时,加入IPTG(终浓度为0.5 mmol/L)于37℃振荡培养,分别在IPTG诱导0 h、2 h、4 h、6 h和8 h后取样,700×g离心5 min,收集菌体并重悬于PBS 中(NaCl 137 mmol/L,KH2PO42 mmol/L,Na2HPO410 mmol/L,KCl 2.7 mmol/L),超声裂解细菌后,11 000×g离心,分别取上清和沉淀制样,经SDS-PAGE分析AZIN1融合蛋白的表达情况,由此确定最佳外源蛋白诱导表达条件。
1.2.3 人AZIN1蛋白的纯化及复性 将成功转化pET-28a/AZIN1的BL21(DE3)阳性单克隆菌放大培养(1 000 mL培养液)。待菌液OD值达到0.6-0.8时,IPTG(终浓度为0.5 mmol/L)诱导表达6 h后,700×g离心10 min收集菌体,经高浓度尿素(8 mol/L 尿素,0.1 mol/L Na2HPO4,0.01 mol/L Tris-HCl,pH 8.0)裂解细菌,37℃振荡裂解1 h,离心30 min去不溶性碎片。上清与Ni-NTA树脂杂交2 h后上柱,用洗脱液A(8 mol/L 尿素,100 mmol/L Na2HPO4,10 mmol/L Tris,pH6.3)洗脱杂蛋白,再用洗脱液B(8 mol/L 尿素,100 mmol/L Na2HPO4,10 mmol/L Tris,pH4.3)洗脱目的蛋白。纯化后的蛋白用递减尿素浓度的PBS缓冲液(pH7.4)透析复性,每12 h换1次透析液,透析后的蛋白于-80℃保存备用。
1.2.4 多克隆抗体制备 纯化后的AZIN1蛋白用作抗原免疫Balb/c小鼠,首次免疫取100 g抗原与弗氏完全佐剂等体积乳化,背部皮下多点注射。两周后做3次加强免疫,每次间隔时间两周,加强免疫采用50 g AZIN1蛋白与弗氏不完全佐剂等体积乳化,背部皮下多点注射。末次免疫后1周摘小鼠眼球取血,37℃静置1 h后,4℃,12 000 r/min离心收集血清,加入等体积甘油后-20℃保存备用。
1.2.5 制备的抗血清抗体效价检测 间接ELISA法被用于检测本研究制备的抗血清中AZIN1多克隆抗体效价。纯化的人AZIN1蛋白用包被缓冲液稀释至终浓度为10 g/mL后,加入96孔酶标板,每孔100μL,4℃包被16 h,1%的BSA于37℃封闭2 h,然后加入系列稀释的血清,100 μL/孔,以未免疫小鼠血清为阴性对照,PBS为空白对照,37℃孵育1 h;再加入HRP标记的羊抗兔IgG(1∶5 000 稀释),100 μL/孔,37℃孵育1 h;TMB法显色,2 mol/L硫酸终止反应后,酶标仪检测各孔A450值。以空白对照调零,待测孔A450值与阴性对照孔A450值的比值≥2. 1即判为阳性,以能获得阳性的最大稀释度作为待检血清的抗体效价。
1.2.6 Western blot法鉴定制备的AZIN1抗体 以本实验制备的抗血清为一抗,Western blot法检测人A549肺癌细胞、人Hela宫颈癌细胞以及小鼠B16-F1黑色素瘤细胞中AZIN1蛋白的表达。收集培养细胞,加全细胞裂解液冰上裂解细胞30 min,4℃12 000 r/min离心10 min后收集上清(细胞总蛋白)制样,蛋白样品经SDS-PAGE分离后以200 mA恒流电转移到PVDF膜,膜采用含5%脱脂牛奶的TBST室温封闭2 h。用本实验制备的多克隆抗体为一抗(1∶3 000稀释)4℃孵育过夜,羊抗鼠IgG为二抗室温孵育1 h后TBST漂洗,ECL法显色并记录结果。
1.2.7 细胞免疫荧光法鉴定制备的AZIN1抗体B16-F1细胞置玻片培养,PBS洗涤3次,4%甲醛4℃固定细胞15 min,0.5%的TritonX-100室温通透20 min,PBS洗涤玻片3次后,正常山羊血清室温封闭30 min,每张玻片滴加本实验制备的抗血清(1∶200稀释)后放入湿盒,4℃孵育过夜,PBS洗涤玻片后滴加荧光二抗(1∶200稀释),湿盒中室温避光孵育1 h,洗涤未结合的二抗后,滴加DAPI避光孵育10-15 min(复染细胞核),PBS洗去多余的DAPI,用含有抗荧光淬灭剂的封片剂封片,荧光显微镜观测结果。
1.2.8 细胞免疫化学鉴定抗AZIN1抗体 实验步骤与前述细胞免疫荧光法类似,不同之处为,一抗孵育过夜后,每张玻片滴加辣根过氧化物酶标记的小鼠IgG二抗(1∶200稀释),37℃孵育30 min,PBS洗涤玻片3次,每次5 min。DAB显色1-2 min后自来水清洗,吸干玻片上的水分后加苏木精染色2 min,自来水冲洗,吸干玻片水分后树脂封片,显微镜下观察。
2 结果
2.1 原核表达质粒鉴定
pET-28a/AZIN1质粒经Xho I+Nde I酶切后,用1%的琼脂糖凝胶电泳分离,可见1 350 bp和5 400 bp两个限制性片段(图1),结果与预期一致。酶切鉴定为阳性的重组质粒经DNA测序,证实质粒中插入序列正确,阅读框架对接无误。

图1 pET-28a/AZIN1质粒的酶切鉴定
2.2 人AZIN1蛋白的原核表达和纯化
将重组pET-28a/AZIN1质粒转化入大肠杆菌BL21(DE3)中,IPTG(终浓度为0.5 mmol/L)诱导0-6 h,在不同的时间点取样,经12%的SDS-PAGE分析,结果(图2)显示IPTG诱导后,在相对分子质量50 kD附近有一新蛋白产生,与预期重组蛋白AZIN1的相对分子质量一致,诱导4 h时重组蛋白的表达量最高。超声裂解诱导后的细菌,上清、沉淀分别制样,经SDS-PAGE分析,结果(图3)显示AZIN1蛋白主要存在于超声后沉淀中,提示表达的重组蛋白主要以包涵体的形式存在。由于诱导表达的AZIN1蛋白带有6× His标签,实验采用Ni-NTA亲和层析法对表达菌中的AZIN1蛋白进行纯化。纯化后的蛋白经透析复性后,用SDS-PAGE和Western blotting(抗His标签抗体作为一抗)对其进行纯度和特异性鉴定。结果(图4)显示,大肠杆菌中诱导表达的AZIN1能被Ni-NTA高效纯化。
2.3 抗AZIN1多克隆抗体鉴定
2.3.1 血清效价检测 将纯化的AZIN1蛋白用作抗原包被酶标板,免疫血清等比稀释后作为一抗,ELISA法检测制备抗血清的效价,结果(图5)显示血清抗体效价可达到1∶640 000。

图2 SDS-PAGE分析AZIN1蛋白的诱导表达
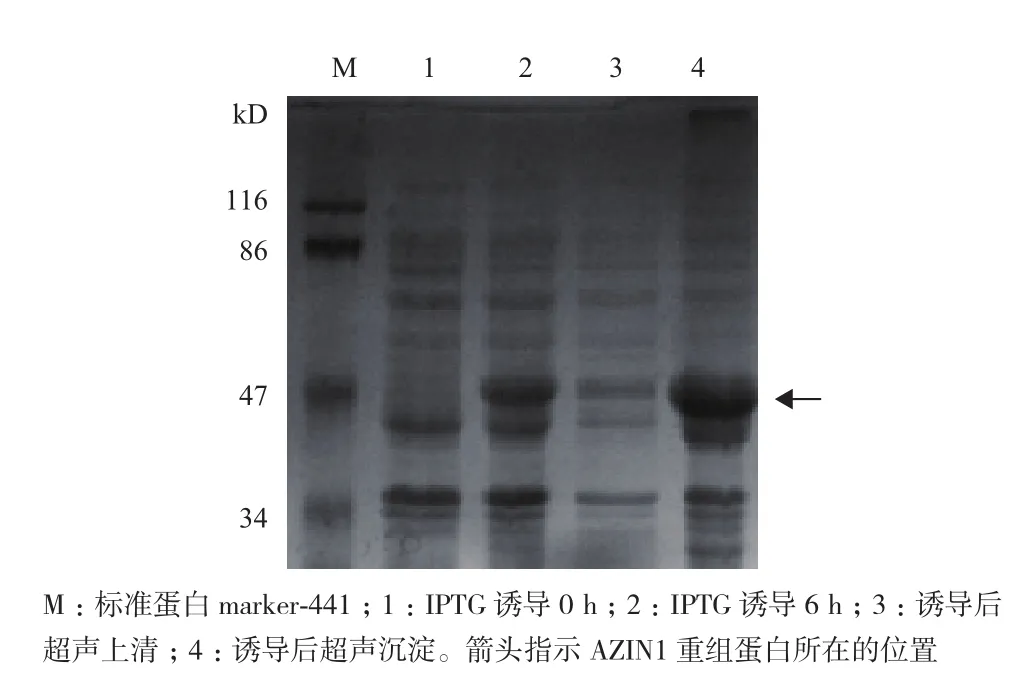
图3 SDS-PAGE分析诱导表达的AZIN1蛋白在细菌内的溶解性
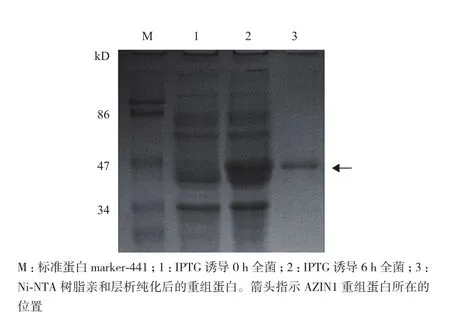
图4 SDS-PAGE分析人AZIN1蛋白的纯化

图5 ELISA分析制备抗血清的效价
2.3.2 制备抗体用于AZIN1的Western bloting检测
以人宫颈癌HeLa细胞、小鼠黑素瘤B16-F1细胞、L929小鼠成纤维细胞裂解物及原核表达的人AZIN1蛋白为抗原,以制备的多克隆抗体为一抗,Western blotting检测样品中的AZIN1蛋白,结果(图6)表明,制备的多克隆抗体能有效识别和结合人和小鼠的的AZIN1蛋白,可用于细胞内源性和原核表达AZIN1蛋白的Western blot检测。

图6 制备抗体用于AZIN1的Western bloting检测
2.3.3 制备抗体用于AZIN1的细胞免疫荧光分析 B16-F1黑色素瘤细胞置玻片培养后,以制备的多克隆抗体为一抗,以Cy3标记的羊抗鼠IgG为二抗,免疫荧光法检测B16-F1细胞内AZIN1蛋白的表达。结果(图7)显示,制备抗体能有效用于AZIN1的细胞免疫荧光分析。
2.3.4 制备抗体用于AZIN1的细胞免疫化学分析 B16-F1黑色素瘤细胞置玻片培养后,以制备的多克隆抗体为一抗,阴性小鼠血清为对照,HRP标记的羊抗鼠IgG为二抗,免疫细胞化学法检测B16-F1细胞内AZIN1蛋白的表达。结果(图8)显示,制备抗体能有效用于AZIN1的细胞免疫化学分析。
3 讨论
天然多胺为所有活细胞的必需组分,参与多种重要的生理功能。研究表明,耗竭多胺将引起细胞生长抑制,而多胺水平异常升高则会导致癌症发生[8,9],因此维持细胞内多胺自稳对正常细胞生命活动意义重大。AZIN1起初作为细胞内调节多胺含量的蛋白质因子而被广泛关注[10],随后研究发现,AZIN1除了通过调节细胞内多胺水平而影响细胞增殖外,还可以通过干扰中心体的复制以及与细胞周期蛋白Cyclin D1相互作用而调控细胞增殖[5,6],由此AZIN1有望成为抗肿瘤治疗的新靶点。

图7 制备抗体用于AZIN1的细胞免疫荧光检测(×400)
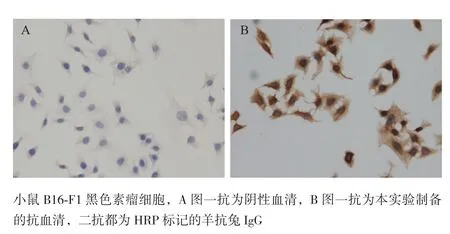
图8 制备抗体用于AZIN1的细胞免疫化学检测(×400)
为获得大量可用作抗原免疫小鼠的AZIN1蛋白,我们将构建的pET-28a/AZIN1原核表达质粒转化入大肠杆菌菌株BL21(DE3)中。分析发现,细菌内AZIN1重组蛋白能被IPTG诱导性表达,且主要以包涵体的形式存在,这可能与AZIN1重组蛋白诱导性表达的速度过快和细菌内浓度过高有关。由于重组AZIN1蛋白的N端带有6×His标签,我们在尿素变性的条件下利用Ni-NTA树脂亲和层析法成功获得高纯度的AZIN1蛋白。为制备抗AZIN1多克隆抗体,我们将纯化后的AZIN1重组蛋白用做抗原免疫BALB/c小鼠,经过1次启动免疫和3次加强免疫后,获得高效价的抗AZIN1多克隆抗体。该多克隆抗体能特异性识别和结合人和小鼠真核细胞中表达的AZIN1蛋白,可有效用于AZIN1的免疫印迹、细胞免疫荧光和免疫细胞化学分析。
4 结论
本实验建立了人AZIN1原核表达纯化技术,成功制备了抗AZIN1多克隆抗体,上述研究结果有助于进一步探索AZIN1在调控细胞增殖中的作用以及作为抗肿瘤药物分子靶点的潜在价值。
[1]Miller-Fleming L, Olin-Sandoval V, Campbell K, et al. Remaining mysteries of molecular biology:the role of polyamines in the cell[J]. J Mol Biol, 2015, 427(21):3389-3406.
[2]Mastracci TL, Robertson MA, Mirmira RG, et al. Polyamine biosynthesis is critical for growth and differentiation of the pancreas[J]. Sci Rep, 2015, 5:13269.
[3]Keren-Paz A, Bercovich Z, Porat Z, et al. Overexpression of antizyme-inhibitor in NIH3T3 fibroblasts provides growth advantage through neutralization of antizyme functions[J]. Oncogene, 2006, 25(37):5163-5172.
[4]Choi KS1, Suh YH, Kim WH, et al. Stable siRNA-mediated silencing of antizyme inhibitor:regulation of ornithine decarboxylase activity[J]. Biochem Biophys Res Commun, 2005, 328(1):206-212.
[5]Murakami Y, Suzuki J, Samejima K, et al. The change of antizyme inhibitor expression and its possible role during mammalian cell cycle[J]. Exp Cell Res, 2009, 315:2301-2311.
[6]Mangold U, Hayakawa H, Coughlin M, et al. Antizyme, a mediator of biquitin-independent proteasomal degradation and its inhibitor localize to centrosomes and modulate centriole amplification[J]. Oncogene, 2008, 27(5):604-613.
[7]Duensing S. Analysis of centrosomes in human cancer[J]. Methods Cell Biol, 2015, 129:51-60.
[8]Kusano T, Berberich T, Tateda C, et al. Polyamines:essential factors for growth and survival[J]. Planta, 2008, 228(3):367-381.
[9]Casero RA, Marton LJ. Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases[J]. Nature Reviews Drug Discovery, 2007, 6(5):373-390.
[10]Olsen RP, Zetter BR. Evidence of a role for antizyme and antizyme imhibitor as regulators of human cancer[J]. Mol Cancer Res, 2011, 9(10):1285-1293.
(责任编辑 狄艳红)
Prokaryotic Expression,Purification and Polyclonal Antibody Preparation of Human Antizyme Inhibition Factor-1
LÜ Ya-feng YANG Jian-lin QIN Yu WANG Yan-lin
(Hubei Key Laboratory of Tumor Microenvironment and Immunotherapy,Three Gorges University Medical College,Yichang 443002)
We aim to carry out prokaryotic expression and purification of human antizyme inhibition factor-1(AZIN1),and to prepare as well as identify polyclonal antibody against AZIN1. Prokaryotic expression vector pET-28a/AZIN1 was transformed into Escherichia coli BL21(DE3),in which the recombinant AZIN1 was expressed by IPTG induction and purified by affinity chromatography with Ni-NTA resin under denaturing condition. The purified recombinant AZIN1 was used as the antigen to prepare the antibody in the BALB/c mice. The titer and specificity of anti-sera were detected by ELISA,Western blot,cell immunofluorescence,and immunochemistry. As results,restriction analysis and DNA sequencing proved that the plasmid pET-28a/AZIN1 was constructed successfully. In E. coli,recombinant AZIN1 protein was expressed by IPTG induction and mainly existed in a form of inclusion body. The AZIN1 protein expressed in the E. coli was effectively purified using affinity chromatography. When used as the antigen to immune mice,this protein induced the production of specific antibody against AZIN1 with serum titer of 1∶640 000. The prepared antiserum specifically recognized and bound to the AZIN1 protein expressed in human or mouse tumor cells. And this antiserum was efficiently used in the analysis for AZIN1 by Western blot,cell immunofluorescence,and cell immunochemistry. In conclusion,the prokaryotic expression and purification of human AZIN1 protein and preparation of polyclonal antibody against AZIN1 were successfully performed in this study. These results provide a basis for further research on the roles of AZIN1 in regulating cell proliferation and in disease prevention and treatment.
antizyme inhibition factor-1;prokaryotic expression;antibody
10.13560/j.cnki.biotech.bull.1985.2017.03.028
2016-07-19
国家自然科学基金项目(81372265)
吕亚丰,男,硕士研究生,研究方向:肿瘤分子生物学;E-mail:yafenglv@yahoo.com
王艳林,男,博士,研究方向:肿瘤分子生物学;E-mail:fzswangyl@ctgu.edu.cn

