核磁共振波谱检查在前列腺癌诊断及病情判断中的应用
刘艳,柏根基
(南京医科大学附属淮安第一医院,江苏淮安223300)
核磁共振波谱检查在前列腺癌诊断及病情判断中的应用
刘艳,柏根基
(南京医科大学附属淮安第一医院,江苏淮安223300)
目的探讨核磁共振波谱检查在前列腺癌诊断及病情判断中的应用价值。方法选择前列腺癌患者32例作为观察组,前列腺增生患者30例作为对照组。两组均行常规MRI及核磁共振波谱检查,观察病灶波谱的曲线特征及枸橼酸盐、胆碱、肌酸的化学位移情况,计算CC/C。CC/C=(胆碱+肌酸)/枸椽酸盐。采用化学发光免疫法检测血清前列腺特异性抗原,根据MRI检查结果计算前列腺体积,并计算前列腺特异抗原密度(PSAD)。绘制CC/C与PSAD单独或联合检测诊断前列腺癌的受试者工作特征(ROC)曲线,比较其诊断效能;分析CC/C与Gleason评分的关系。结果观察组与对照组CC/C分别为1.38±0.30、0.85±0.18,PSAD分别为1.10±0.18、0.29±0.19,两组比较P均<0.05。CC/C联合PSAD诊断前列腺癌的ROC曲线下面积、敏感性及特异性均高于CC/C与PSAD单独诊断。观察组CC/C与Gleason评分呈正相关(r=0.815,P<0.01)。结论核磁共振波谱检查联合PSAD可提高对前列腺癌的诊断效能;有助于对患者的病情判断及预后评估。
前列腺癌;核磁共振波谱;前列腺特异性抗原;前列腺体积;前列腺特异抗原密度;Gleason评分
近年来我国前列腺癌发病率呈上升趋势[1],血清前列腺特异性抗原(PSA)检测有助于其早期诊断,但特异性低。前列腺特异抗原密度(PSAD)是指PSA与前列腺体积的比值,其在前列腺癌早期诊断中特别是在PSA浓度处于临床诊断灰质区(4~20 ng/mL)时的诊断价值高于PSA[2]。研究发现,正常前列腺组织富含枸椽酸盐(Cit),而前列腺癌组织中Cit含量明显降低;胆碱(Cho)是细胞膜的主要成分,前列腺癌细胞增殖速度快,Cho含量升高。磁共振波谱(MRS)是一种无创性的检查方法,可以对前列腺组织代谢情况进行定量分析。 本研究探讨MRS在前列腺癌诊断及病情判断中的作用。
1 临床资料
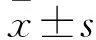
1.2 相关检查及结果
1.2.1 MRI及MRS检查 两组入院后进行常规MRI及MRS检查。检查前2天患者无渣饮食,扫描前1 h禁止剧烈运动,禁止进食并排出宿便,待膀胱适度充盈后进行检查。采用德国西门子VERIO 3.0T超导MRI成像仪,使用相控阵柔软体部线圈进行常规MRI及MRS扫描,常规MRI检查包括T2WI矢状面、冠状面、横断面(抑脂)和T1WI横断面,T1WI:TR 680 ms,TE 16 ms;T2WI:TR 3 000 ms,TE 89 ms,FOV 20 cm×20 cm,层间距3 mm,层厚1 mm。测定前列腺上下径、前后径、左右径,计算前列腺体积。前列腺体积(cm3)=上下径×前后径×左右径×0.52。MRS检查采用3D-CSI序列,参照T2WI图像确定感兴趣区范围,扫描参数:TR 690 ms,TE 120 ms,FOV 22 cm×12 cm,采集时间10 min 20 s。参照T2WI选取感兴趣区(选取时尽量位于病灶中心且不超过病灶边缘,同时避开尿道、钙化、囊变坏死灶等),观察病灶Cit、Cho、肌酸(Cr)的化学位移,以自带软件计算感兴趣区CC/C,CC/C=(Cho+Cr)/Cit。结果显示,观察组及对照组前列腺体积分别为(41.85±24.08)、(52.65±23.65)cm3,CC/C分别为1.38±0.30、0.85±0.18,两组比较P均<0.05。
1.2.2 血清 PSA及PSAD 两组入院后均采集空腹静脉血3 mL,离心后分离血清,采用化学发光免疫法检测血清PSA。观察组与对照组血清PSA分别为(55.17±34.11)、(13.39±6.07)ng/mL,根据血清PSA水平及前列腺体积计算PSAD,PSAD分别为1.10±0.18、0.29±0.19。观察组血清PSA及PSAD均高于对照组,两组比较P均<0.05。
1.3 MRS与PSAD单独或联合检测对前列腺癌的诊断效能 绘制CC/C与PSAD单独或联合诊断前列腺癌的受试者工作特征(ROC)曲线,计算曲线下面积(AUC),并分析其诊断效能。结果显示,CC/C诊断前列腺癌的AUC为0.899,最佳临界值为1.03,敏感性及特异性分别为85.7%、82.0%。PSAD诊断前列腺癌的AUC为0.857,最佳临界值为0.31,敏感性及特异性分别为90.5%、64.0%。CC/C联合PSAD诊断前列腺癌的AUC为0.970,敏感性及特异性分别为90.5%、91.0%。CC/C联合PSAD诊断前列腺癌的AUC、敏感性及特异性均高于CC/C与PSAD单独诊断。
1.4 CC/C与Gleason评分的关系 观察组MRI检查后1周内采用常规“采区12针”法对前列腺进行系统穿刺,采用Gleason分级系统评价前列腺癌组织学分级。Gleason评分越高说明肿瘤恶性程度越高、患者预后越差。Gleason评分<7分定义为低危,≥7分定义为高危,比较低危及高危患者CC/C,并分析CC/C与Gleason分级的关系。结果显示,观察组低危患者13例,高危患者19例,其CC/C分别为1.03±0.65、2.88±1.51,二者比较P<0.05。Spearman相关分析结果显示,观察组CC/C与Gleason评分呈正相关(r=0.815,P<0.01)。
2 讨论
前列腺癌常发生于前列腺外周带,在MRI常规扫描T2WI上常呈低信号,但前列腺炎症、纤维化、钙化等均可呈低信号,且部分发生于中央带及移行带的前列腺癌常难与BPH增生结节相鉴别。MRS是目前惟一无创研究活体器官组织代谢、生化变化及化合物定量分析的方法,其不以信号为标准,可弥补常规MRI的不足,其成像原理是利用MRI化学位移及J-偶联来测定分子组成和空间分布,从而反映组织代谢变化[4]。Cit、Cho、Cr是前列腺组织中较为重要的代谢物质。Cit是精液的主要组成部分,正常及增生的前列腺组织具有分泌和浓缩Cit的作用,所以Cit含量较高;而前列腺癌患者因正常组织破坏较多,分泌和浓缩Cit能力下降,主要表现为MRS的Cit峰值降低。Cho与细胞膜的合成与降解有关,前列腺癌患者癌细胞生长及更新换代比较快,Cho峰值常显著升高。癌组织Cr含量与正常前列腺组织并无明显差异。本研究观察组CC/C明显高于对照组,与既往研究[5~7]结论一致。CC/C诊断前列腺癌的AUC为0.899,最佳临界值为1.03,敏感性与特异性分别为85.7%、82.0%,与叶锦堂等[8]以体素为单位诊断前列腺癌的最佳临界值0.911、敏感性81.4%、特异性83.1%稍有差异。分析原因,可能是与检查设备、感兴趣范围及患者病情不同有关。
PSA是前列腺癌早期筛查的一种较为简易的方法,但前列腺体积增大、前列腺炎等均可引起PSA升高,且当PSA水平为4~20 ng/mL时,其诊断效能较低。有学者认为前列腺体积是影响PSA的因素之一[9]。早期前列腺癌可直接导致PSA水平升高,但对前列腺体积的影响不大,而BPH则由于体积增大而导致PSA水平升高,因此PSAD减弱了前列腺体积对PSA的影响,对前列腺癌的早期诊断具有重要价值[10,11]。本研究结果显示,观察组PSAD明显高于对照组,PSAD诊断前列腺癌的最佳临界值为0.31,敏感性与特异性分别为90.5%、64.0%。叶萍等[12]研究得出PSAD的最佳临界值为0.30,敏感性与特异性分别为88.89%、70.77%,与本研究中的特异性稍有差异,可能与PSAD容易受前列腺体积影响有关。本研究结果显示,CC/C联合PSAD诊断前列腺癌的AUC、敏感性及特异性均高于CC/C与PSAD单独诊断,说明CC/C联合PSAD可提高对前列腺癌的诊断效能;提示在前列腺癌的早期诊断中,特别是患者全身情况较差、不适合穿刺活检时,MRS联合PSAD对其诊断具有重要意义。
Gleason评分是目前应用最广泛的前列腺癌组织学评价系统,是决定前列腺癌患者治疗和预后的重要参考指标[2]。Gleason评分较高预示着肿瘤侵袭性更强,患者预后更差[13]。探讨CC/C与Gleason评分的相关性有助于更好地判断肿瘤的恶性程度,指导治疗,减少过度诊疗。本研究结果显示,观察组CC/C与Gleason评分呈正相关,且低危患者CC/C明显低于高危患者;原因可能是Gleason评分较低的癌组织分化程度较高,细胞异型性较小,其结构、功能与正常前列腺细胞相近,生长代谢速度相对较慢,所以Cho峰值较低;其大部分腺体功能尚好,仍具有分泌和储存Cit的能力,所以Cit峰值降低并不显著;而Gleason评分较高的癌组织分化程度较低,细胞异型性较高,新陈代谢速度较快,Cho则显著增高,且正常的前列腺组织破坏较多,从而导致腺管分泌和储存Cit能力下降,Cit峰值降低较为显著,从而导致Gleason评分较高者CC/C明显高于Gleason评分较低者。与既往研究[14~17]结论一致。
综上所述,CC/C联合PSAD可提高前列腺癌的诊断效能; CC/C与Gleason评分呈正相关,CC/C检测有助于前列腺癌患者的病情判断及预后评估。本研究不足之处为样本量较小,且可能存在选择性偏倚,某些术前的穿刺活检病理可能与术后病理仍有一定差异,因此仍需大量样本研究进行证实。
[1] 叶定伟,朱耀.中国前列腺癌的流行病学概述和启示[J].中华外科杂志,2015,3(4):249-252.
[2] 赵明,滕晓东,何向蕾,等.2014年国际泌尿病理协会前列腺癌分级系统新进展和新的预后分组[J].中华病理学杂志,2016,45(10):673-675.
[3] 刘洋,王涌泉.PSA、PSAD、f/tPSA对前列腺癌的诊断及穿刺后Gleason评分的预测[J].医学研究杂志,2016,45(2):116-120.
[4] 任静,宦怡.前列腺癌功能磁共振成像诊断研究[J].国际医学放射学杂志,2010,33(4):351-355.
[5] 王芳.3.0T体线圈1H-MRS诊断前列腺癌和前列腺增生[J].放射学实践,2013,28(6):673-677.
[6] 周红俐,赵建农,何晓静,等.3T MRI三维氢质子波谱及扩散张量成像用于前列腺癌诊断的初步探讨[J].临床放射学杂志,2014,33(2):229-233.
[7] 王霄英,周良平,丁建平,等.前列腺癌的MR波谱定量分析:与系统穿刺活检病理对照研究[J].中华放射学杂志,2004,38(3):268-272.
[8] 叶锦棠,郭雪梅,王霄英,等.MR波谱分析对前列腺癌诊断效能的研究[J].中华放射学杂志,2009,43(6):616-620.
[9] Wu YS, Na R, Xu JF, et al. The influence of prostate volume on cancer detection in the Chinese population[J]. Asian J Androl, 2014,16(3):482-486.
[10] 孙杨,王绍平.PSA、PSAD、F-PSA/PSA在前列腺癌诊断中的价值分析[J].中国实验诊断学,2016,23(1):113-114.
[11] 沈默,陶志华.血清前列腺特异抗原和前列腺特异抗原密度对前列腺癌诊断价值评价[J].浙江临床医学,2008,10(2):152-153.
[12] 叶萍,钱孝纲.前列腺被膜支动脉阻力指数与前列腺特异性抗原密度在前列腺癌诊断中的价值[J].临床超声医学杂志,2012,14(3):177-179.
[13] Tiwari P, Kurhanewicz J, Madabhushi A. Multi-kernel graph embedding for detection, Gleason grading of prostate cancer via MRI/MRS[J]. Med Image Anal, 2013,17(2):219-235.
[14] 程紫琚,赵阳.MRS诊断前列腺癌准确率与病理切片Gleason评分的相关性研究[J].中国临床医学影像杂志,2012,23(12):860-863.
[15] 赵阳,徐勇,韩悦,等.MR波谱成像对前列腺癌分化程度预估价值的初步研究[J].中华射学杂志,2011,45(10):951-954.
[16] Razi A, Parizi MK, Kazemeini SM, et al. A prospective study of the efficacy of magnetic resonance spectroscopy imaging for predicting locally advanced prostate cancer[J].Turk J Urol, 2015,41(2):67-72.
[17] 卢慧敏,夏春华,高斌.MR波谱分析对前列腺癌G1eason评分的预估价值[J].实用放射学杂志,2014,30(2):263-266.
柏根基(E-mail: hybgj0451@163.com)
10.3969/j.issn.1002-266X.2017.48.033
R737.25
B
1002-266X(2017)48-0094-03
2017-06-26)

