不同浓度NF-κB信号通路抑制剂SN50对体外培养小鼠成骨细胞MC3T3-E1自噬体表达的影响
秦晗 ,徐宏志,龚永庆
(徐州医科大学附属连云港医院,江苏连云港222002)
不同浓度NF-κB信号通路抑制剂SN50对体外培养小鼠成骨细胞MC3T3-E1自噬体表达的影响
秦晗 ,徐宏志,龚永庆
(徐州医科大学附属连云港医院,江苏连云港222002)
目的 观察不同浓度NF-κB信号通路抑制剂SN50培养的小鼠成骨细胞MC3T3-E1中自噬体的表达变化。方法 将体外培养的成骨细胞MC3T3-E1分为实验1、2、3组和对照组。对照组不加药,实验1、2、3组分别加入终浓度为6.25、12.5、25 μg/mL的SN50,继续培养24 h,行单丹( 磺)酰戊二胺(MDC)染色,荧光显微镜下观察各组自噬体表达情况。结果 对照组成骨细胞MC3T3-E1未见明显点状分布的绿色荧光。实验1组可见少许点状绿色荧光。实验2组点状绿色荧光数量较多。实验3组可见大量的点状绿色荧光颗粒散布于成骨细胞的胞质和细胞突起。对照组、实验1组、实验2组、实验3组绿色荧光细胞比例分别为1.0%±0.2%、12.3%±1.5%、26.8%±2.4%、56.8%±5.5%。绿色荧光细胞比例对照组<实验1组<实验2组<实验3组,P<0.05。结论 NF-κB信号通路抑制剂SN50培养的小鼠成骨细胞MC3T3-E1中自噬体表达且呈剂量依赖性升高。
核因子κB;成骨细胞;自噬;自噬体
牙齿萌出是指牙齿由骨腔内移动至骨外、进而突破牙龈, 直至达到功能颌的过程[1]。成骨细胞和破骨细胞之间的动态平衡是牙齿正常萌出通道形成的基础,核因子κB(NF-κB)信号通路是调节二者平衡的重要通路[2],其通过调控RANK/RANKL表达,从而调节成骨、破骨细胞分化信号进而影响牙齿萌出通道的形成,在牙齿萌出过程中发挥着关键作用[3,4]。但是NF-κB调节成骨细胞分化的机制尚不明确。新近有研究发现NF-κB通路调控神经细胞分化的机制可能和抑制细胞周期、激活自噬有关[5],提示我们NF-κB调节成骨细胞分化可能与自噬有关。本研究观察了不同浓度NF-κB信号通路抑制剂SN50培养的成骨细胞MC3T3-E1中自噬体的表达变化。现报告如下。
1 材料与方法
1.1 材料 成骨细胞MC3T3-E1购于中科院上海
1.2 成骨细胞分组及SN50应用方法 将成骨细胞MC3T3-E1用ә- MEM培养基于37 ℃、5%CO2培养箱中静置培养。待细胞生长良好,用0.25%胰蛋白酶消化制成单细胞悬液,以2×104/cm2的密度接种与已置入消毒盖玻片的24孔培养板中。随机分为实验1组、实验2组、实验3组、对照组,每组6孔。对照组不加药,实验1、2、3组分别加入终浓度为6.25、12.5、25 μg/mL的SN50,继续培养24 h。
1.3 细胞自噬体表达观察方法 采用单丹( 磺)酰戊二胺(MDC)染色法。将MDC染色液按体积比稀释10倍。每孔加入100 μL MDC染色液,室温避光染色15~45 min后,弃去染色液,以300 μL的1×Wash Buffer洗3次,再以100 μL的collection buffer覆盖细胞爬片,激光共聚焦显微镜下观察并拍照。激发滤光片波长355 nm。阻断滤光片波长512 nm。
高倍镜(400倍)下计数1 000个细胞,计算绿色荧光细胞占总细胞数的百分比。
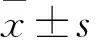
2 结果
对照组成骨细胞MC3T3-E1未见明显点状分布的绿色荧光。实验1组可见少许点状绿色荧光。实验2组点状绿色荧光数量较多。实验3组可见大量的点状绿色荧光颗粒散布于成骨细胞的胞质和细胞突起。对照组、实验1组、实验2组、实验3组绿色荧光细胞比例分别为1.0%±0.2%、12.3%±1.5%、26.8%±2.4%、56.8%±5.5%。绿色荧光细胞比例对照组<实验1组<实验2组<实验3组,P<0.05。
3 讨论
牙齿的萌出是一个多因素过程,在这一过程中既有牙槽骨、牙胚的组织学改变, 又有破骨细胞、成骨细胞、牙胚细胞等细胞学的改变, 还有多种细胞因子的参与,而且这些生物信号分子是通过细胞间、细胞与基质间、基质间的自分泌或旁分泌途径来调控发育进程[6,7]。成骨细胞和破骨细胞之间的动态平衡是保证牙齿正常萌出过程的基础,若这一平衡失调,则可能导致牙齿萌出障碍。牙齿萌出障碍是指牙齿萌出期已过而仍在颌骨内未能萌出的牙齿,其代表性疾病为颅骨锁骨发育不全(CCD)则是多数牙齿萌出永久性的延迟[8]。我们曾对CCD患者进行血清检测发现,在成骨细胞的标志性酶血清骨特异性碱性磷酸酶(B-ALP)升高的同时,伴有破骨细胞的标志性酶-抗酒石酸酸性磷酸酶-5b(TRCAP-5b)升高[9]。提示成骨细胞和破骨细胞不能协调分化可能是该类患者牙齿萌出障碍的主要原因。目前关于牙齿萌出障碍研究的重点主要集中于牙齿萌出过程中破骨细胞的数量和分化的相关分子机制的变化情况。相反,对于密切相关的成骨细胞如何启动分化诱导破骨细胞的聚集、分化、促进牙齿萌出通道的形成,以及在这过程中信号通路情况及是否伴有自噬的发生等分子调控机制的研究则相对较少。
NF-κB信号通路是骨量动态平衡调节的重要通路,其通过对RANK/RANKL表达的调控,调节成骨和破骨细胞的分子信号,在骨基质的形成、发育和改建中发挥关键调控作用[10]。因此,同样也是牙齿萌出通道形成过程中的关键信号通路。破骨细胞核因子κB受体活化因子配体(RANKL)主要由免疫细胞、骨髓间质细胞、成骨细胞、血管内皮细胞及一些肿瘤细胞表达,通常以三聚体复合物的形式存在于细胞质中,可以被许多因素激活,包括炎性细胞因子、生长因子、免疫受体、细菌及其产物脂多糖、病毒与病毒蛋白及某些理化因素等[11]。破骨细胞核因子κB受体活化因子(RANK)是RANKL刺激破骨细胞分化、生存、融合与活化的唯一靶受体。RANK的活化能使细胞骨架重构,改变破骨细胞的形态,如细胞的延展性、移动性等,使破骨细胞移动并黏附到骨吸收区域。位于破骨细胞前体细胞细胞膜表面的RNAK与RNAKL结合后可促进破骨细胞前体细胞的分化与成熟[12,13]。在前期的研究中,我们围绕牙齿萌出过程中破骨细胞和NF-κB信号通路开展了一系列的基础和临床研究。结果显示RANKL的阳性信号广泛表达于成牙本质细胞、牙髓成纤维细胞、牙周韧带成纤维细胞、牙龈成纤维细胞、牙囊细胞、成骨细胞和成釉细胞等多种牙齿、牙周相关细胞。体外培养的破骨细胞加入NF-κB信号通路阻断剂后其数量减少,活性降低,RANKL表达较对照组明显减弱[14]。体内的动物实验也同样证明,加入NF-κB信号通路阻断剂后,小鼠的牙齿萌出较对照组减慢,牙囊和颌骨周围的RANKL表达较对照组明显减弱[15]。验证了NF-κB信号通路可能是调控破骨细胞活化的重要通路,同时也证实破骨细胞抑制剂可能通过调节RANKL的表达、调控破骨细胞的分化,进一步说明NF-κB信号通路在调节成骨细胞和破骨细胞的动态平衡、促进牙齿萌出过程中具有重要作用。
新近有研究发现NF-κB抑制剂触发神经干细胞分化的机制可能和抑制细胞周期、激活自噬有关[5];另有研究发现自噬基因可以在牙齿发育过程中的不同部位表达,提示自噬可能参与了牙齿的发生、发育[16,17]。然而自噬在牙齿萌出过程中发挥怎样的作用,以及自噬与牙齿萌出过程中成骨细胞、NF-κB信号通路之间存在一个怎样的联系?目前研究较少。众所周知,自噬是广泛存在于真核细胞内的一种溶酶体依赖性降解途径,是细胞进行自我保护的一种重要机制,在维持细胞存活、更新、物质再利用和内环境稳定中起着重要作用[18]。自噬具有双重作用,当自噬适度激活时,可加速胞内蛋白质降解,产生氨基酸等小分子物质,抵抗能量不足,防止错误蛋白堆积,进而促进细胞存活;当自噬过度激活时,可导致细胞裂解,引起自噬性细胞死亡[19,20]。根据细胞内底物运送到溶酶体方式的不同,哺乳动物细胞自噬可分为三种主要方式:巨自噬、微自噬和分子伴侣介导的自噬,通常自噬指的是巨自噬。在巨自噬中,细胞浆中可溶性蛋白和变性坏死的细胞器被非溶酶体来源的双层膜结构所包裹,即自噬泡,并有自噬泡将其携带到溶酶体中降解[21,22]。自噬/大自噬在维持细胞的稳定性、发育、细胞生存、衰老、免疫、肿瘤和神经退行性变中发挥作用。但是直到目前,自噬参与这些作用的机制还不十分清楚。许多外界刺激(如饥饿、激素、手术)和细胞内刺激(如错误折叠蛋白的积聚,一些小细胞器的损伤)均可诱导自噬发生。
本研究在体外培养的成骨细胞内加入不同浓度的NF-κB信号通路阻断剂SN50,通过MDC荧光染色法和激光共聚焦显微镜下观察点状分布绿色荧光即自噬体的表达情况。本研究结果显示,未加SN50组成骨细胞胞质中未见明显点状分布的绿色荧光。随着SN50浓度的增加,成骨细胞中点状分布的绿色荧光体数和荧光强度均逐渐增加。在加入25 μg/mL的SN50组可以看到大量的点状绿色荧光颗粒分布于成骨细胞的胞质和细胞突起。提示SN50阻断成骨细胞NF-κB通路过程中自噬被大量的激活。这也进一步说明NF-κB信号通路和自噬在成骨细胞分化调节中发挥重要作用。
[1] Oosterkamp BC, Ockeloen CW, Carels CE, et al. Tooth eruption disturbances and syndromes[J]. Ned Tijdschr Tandheelkd, 2014,121(4):233-238.
[2] Zhou C, Liu W, He W, et al. Saikosaponin a inhibits RANKL-induced osteoclastogenesis by suppressing NF-κB and MAPK pathways [J]. Int Immunopharmacol, 2015,25(1):49- 54.
[3] Wu C, Wang W, Tian B, et al. Myricetin prevents titanium particle-induced osteolysis in vivo and inhibits RANKL-induced osteoclastogenesis in vitro[J]. Biochem Pharmacol,2015,93(1):59-71.
[4] Huh JE, Lee WI, Kang JW, et al. Formononetin attenuates osteoclastogenesis via suppressing the RANKL-induced activation of NF-κB, c-Fos, and nuclear factor of activated T-cells cytoplasmic 1 signaling pathway [J].J Nat Prod,2014,77 (11):2423-2431.
[5] Vucicevic L, Misirkic-Marjanovic M, Paunovic V, et al. Autophagy inhibition uncovers the neurotoxic action of the antipsychotic drug olanzapine [J]. Autophagy,2014,10(12):2362-2378.
[6] Dipti Shastri, Pradeep Tandon, Gyan P, et al. A newer simultaneous space creation, eruption, and adjacent root control spring for the management of impacted tooth [J]. Contemp Clin Dent,2014,5(4): 555-557.
[7] Heikinheimo K, Kurppa KJ, Laiho A, et al. Early dental epithelial transcription factors distinguish ameloblastoma from keratocystic odontogenic tumor [J]. J Dent Res,2015,94(1):101- 111.
[8] Lee KE,Seymen F,Ko J,et al. RUNX2 mutations in cleidocranial dysplasia[J]. Genet Mol Res,2013,12(4):4567-4574.
[9] 李阳飞,秦晗,徐宏志.颅骨锁骨发育不良患者特异性碱性磷酸酶和抗酒石酸酸性磷酸酶的水平:1例报告 [J].中国组织工程研究与临床康复,2011,15(41):7742-7744.
[10] Jimi E,Fukushima H. NF-κB signaling pathways and the future perspectives of bone disease therapy using selective inhibitors of NF-κB [J]. Clin Calcium,2016, 26(2): 298- 304.
[11] Efeyan A, Comb WC, Sabatini DM. Nutrient-sensing mechanisms and pathways [J]. Nature,2015,517(7534):302- 310.
[12] Zhan X, Zhang C, Dissanayaka WL, et al. Storage media enhance osteoclastogenic potential of human periodontal ligament cells via RANKL-independent signaling [J]. Dent Traumatol,2013,29(1):59- 65.
[13] Kim HN, Lee JH, Jin WJ, et al. α-Tocopheryl succinate inhibits osteoclast formation by suppressing receptor activator of nuclear factor-kappaB ligand (RANKL) expression and bone resorption[J].J Bone Metab,2012,19(2):111-120.
[14] Qin H, Cai J, Fang J, et al. Could MTA be a novel medicine on the recurrence therapy for GCTB [J]. Med Hypotheses,2010,74(2):368- 369.
[15] Qin H,Yang FS. Calcitonin may be a useful therapeutic agent for osteoclastogenesis syndromes involving premature eruption of the tooth [J].Med Hypotheses,2008,70(5):1048-1050
[16] Yang JW, Zhu LX, Yuan GH, et al. Autophagy appears during the development of the mouse lower first molar [J]. Histochem Cell Biol,2013,139(1):109- 118.
[17] Yang J, Wan C, Nie S, et al. Localization of Beclin1 in mouse developing tooth germs: possible implication of the interrelation between autophagy and apoptosis [J]. J Mol Histol,2013,44(6):619- 627.
[18] Wei T, Kang Q, Ma B, et al. Activation of autophagy and paraptosis in retinal ganglion cells after retinal ischemia and reperfusion injury in rats [J]. Exp Ther Med, 2015,9(2):476- 482.
[19] Akl MR, Ayoub NM, Ebrahim HY, et al. Araguspongine C induces autophagic death in breast cancer cells through suppression of c-Met and HER2 receptor tyrosine kinase signaling[J]. Mar Drugs,2015,13(1):288- 311.
[20] Shi M, Cheng L, Zhang Z, et al. Ferroferric oxide nanoparticles induce prosurvival autophagy in human blood cells by modulating the Beclin 1/Bcl-2/VPS34 complex[J]. Int J Nanomedicine,2014,24(10):207- 216.
[21] Lee JM, Wagner M, Xiao R, et al. Nutrient-sensing nuclear receptors coordinate autophagy[J]. Nature,2014,516(7529):112- 115.
[22] Mintern JD, Harris J.Autophagy and immunity[J].Immunol Cell Biol,2015,93(1):1-2.
国家自然科学基金资助项目(81500893)。
10.3969/j.issn.1002-266X.2017.19.013
R965
A
1002-266X(2017)19-0045-03
2016-10-10)
细胞库,MDC染色试剂盒购于美国Sigma公司,SN50购于美国Senta Cruz公司,胎牛血清和a-MEM培养基购于美国Invitrogen 公司。

