降水对日本菊花螺胚胎发育和幼体孵化的影响
王 伟, 丁孟文, 董云伟,
(1. 厦门大学 海洋与地球学院 近海海洋环境科学国家重点实验室, 福建 厦门 361102; 2. 厦门市海湾生态保护与修复重点实验室, 福建 厦门 361102)
日本菊花螺Siphonaria japonica(Donovan, 1824)隶属于软体动物门(Mollusca)、腹足纲(Gastropoda)、肺螺亚纲(Pulmonata), 是栖息于我国及日本沿岸岩相潮间带中高潮区的常见腹足类[1-4]。作为我国岩相潮间带重要的牧食者, 日本菊花螺对潮间带藻类的组成和丰度具有重要的调节作用, 进而通过食物链的上行效应对其他营养级产生重要影响[5]。除此以外,日本菊花螺也具有重要的应用价值, 从其体内分离得到的聚丙酸酯类化合物有清凉解毒的功效, 具有重要的药用价值[6]。
日本菊花螺幼体发育过程可分为胚胎发育和幼体发育阶段[7], 胚胎发育发生在卵带内, 而幼体发育发生在卵带外。日本菊花螺卵带由包裹胚胎的卵囊和卵囊外的凝胶状物质组成。胚胎发育阶段在潮间带岩石上完成, 分为多细胞期(卵裂期)、囊胚期、原肠胚期、担轮幼体和面盘幼体5个时期[8]。经过4~20 d胚胎发育之后, 幼体从卵带中释放出来, 进行浮游生活, 然后附着于潮间带成为稚贝[1]。这种繁殖方式具有以下优势: 其一, 可以兼顾种群在原栖息地的延续和种群的有效扩散[9]; 其二, 卵带内胚胎发育可保证发育早期的营养供给[9], 同时减少早期胚胎被摄食的几率和防止原生生物、细菌和病毒的侵入[10]。但是, 将卵带产在潮间带会面临着潮间带严酷的环境胁迫, 剧烈的温度、盐度和湿度的变化都会影响卵带内胚胎发育和幼体孵化, 进而在更高的组织水平上产生重要影响[10]。
海洋贝类幼体发育和稚贝生长均需要适宜的盐度环境[11-13]。降水会快速降低潮间带盐度, 因此影响潮间带腹足类胚胎和幼体发育。关于盐度对腹足类卵带胚胎发育和幼体孵化的影响, 国内外已有大量报道[10,14-18]。但大部分研究工作着重于通过分析卵带在不同梯度海水中时胚胎发育和幼体孵化的状况,探讨卵带在盐度变化时受到的胁迫。这些研究很少考虑到潮汐和降水的作用, 无法全面阐释降水对卵带胚胎发育和幼体孵化的影响。本研究通过实验室模拟和原位取样相结合的方式, 旨在研究降水对日本菊花螺卵带胚胎发育和幼体孵化产生的影响, 为阐明降水对潮间带腹足类的繁殖和种群动态的影响提供重要的基础数据。
1 材料与方法
1.1 实验材料
室内模拟降水实验使用的卵带来自实验室暂养的日本菊花螺成体, 成体于2015年3月17日采集自福建厦门(118°14′E, 24°42′N), 壳长 15.89 mm±1.66 mm,壳宽 11.37 mm±1.49 mm, 壳高 4.77 mm±0.56 mm,湿重 493.49 mg±158.49 mg(平均值±标准差, n=30)。日本菊花螺暂养条件: 水温与环境温度均为 24 °C;盐度为28; 光照条件为12 h: 12 h; 早晚各喷海水2 h,产出的卵带及时取出用于后续实验。
1.2 实验方法
1.2.1模拟降水对卵带内胚胎发育的影响
暂养的日本菊花螺成体在2015年3月22日产下 32枚卵带被用于该实验, 经过显微镜镜检, 确认卵带内胚胎均处于多细胞期(卵裂期)。随机将卵带分为2组, 对照组和模拟降水组(下文简称降水组)各16枚卵带, 随机置于自制的两套贝类培养装置, 分别使用海水(盐度28)和淡水(盐度0)喷淋1 h。经过喷淋之后, 每个卵带被单独放置在玻璃培养皿(直径 6 cm)中, 加入20 mL经过0.22 μL膜滤过的海水(盐度28),放置于人工气候箱中孵育(温度为24℃, 光照条件为12 h∶12 h, 每隔1 d换1次海水)。在孵育时间分别为12、36、72和96 h时(前期观察发现在这4个时间点时, 卵带内大部分胚胎会正常发育到囊胚期、原肠胚期、担轮幼体和面盘幼体), 在降水组和对照组中, 各随机选取 4枚卵带在倒置显微镜下观察胚胎发育状况。每枚卵带分别选取两边和中间共 5个部分进行观察, 每个部分随机观察20个胚胎。每枚卵带共计观察 100个胚胎的发育状况, 以统计卵带内胚胎发育的状况。卵带内各时期胚胎的判断方法参考Ocaña和Emson的研究[8]: 囊胚的内陷代表胚胎进入原肠胚期; 初生壳和纤毛的出现代表胚胎进入担轮幼体时期; 厴内脏器官的分化和 的形成表明胚胎发育为面盘幼体。
1.2.2模拟降水对卵带幼体孵化的影响
暂养的日本菊花螺成体在3月25日产下30枚卵带被用于该实验。随机将卵带分为降水组和对照组(各 15枚卵带), 分别使用海水(盐度 28)和淡水(盐度0)喷淋1 h。喷淋结束后, 每枚卵带经过简单吸干处理后称取重量, 单独放入玻璃培养皿并标记, 加入20 mL膜滤海水。孵化条件与1.2.1中所描述的相同, 每隔1 d换水1次, 在换水的同时, 检测水体中浮游幼体的数量。检测方法为: 使用1 mL的浮游动物计数框在倒置显微镜下检测浮游幼体的数量, 每个卵带孵育的水体(20 mL)检测3个1 mL子样品, 得到平均密度, 再乘以 20 mL的体积, 得到该检测周期内(2 d)该卵带所产出的浮游幼体数量。
1.2.3自然降水对卵带幼体孵化的影响
在2015年4月20日16: 00~23: 00, 厦门经历了7 h降水, 总降水量为10 mm, 达到中雨级别(降水量等级 GB/T 28592-2012, (5~14.9) mm/12 h 或 (10~24.9) mm/24 h), 降水期间潮高均低于350 cm (相对于黄海基准面, 日本菊花螺的分布主要在高程为 300~400 cm的中潮间带区域), 因此日本菊花螺卵带受到了整个降水过程的影响。此次降水之前一个星期内并无其他降水, 保证所采集的卵带仅经历了单次降水。4月21日早上从潮间带取回卵带超过70枚, 经过倒置显微镜镜检之后, 选取处于多细胞期、囊胚期、原肠胚期和担轮幼体的卵带各10枚, 作为降水组, 命名为A1、A2、A3、A4。每枚实验用卵带经过称重后, 放入单独的玻璃培养皿并标记, 加入20 mL膜滤海水。孵化条件与1.2.1中所描述的相同, 每隔1 d换水1次, 在换水的同时检测水体中幼体的数量(检查方法同1.2.2中描述)。
由于4月21日—4月28日内无降水, 因此在4月28日采集卵带70枚, 镜检之后选择与上述一致的4个时期的卵带作为对照组命名为B1、B2、B3、B4,平行数分别为10、9、9、3。对照组卵带的孵化条件和幼体数量检测方法与降水组相同。
1.3 数据处理
通过对卵带孵化过程的高斯模拟得到每个卵带单位时间幼体孵化最高值和最高值出现时间。高斯模拟模式图(图1)以B2组2号平行的数据作为作图数据。振幅值(Amplitude Value)和高峰值(Mean Value)的生物学意义分别为单位时间幼体孵化最高值和最高值出现时间。高斯模拟通过Graphpad Prism 6软件完成。

图1 卵带幼体孵化的高斯模拟模式图Fig. 1 The Gaussian simulation of larval hatching from egg ribbons of Siphonaria japonica
数据的统计分析通过SPSS 20.0完成。其中模拟降水实验中降水组和对照组之间胚胎发育状况的比较采用非参数检验-频数表统计方法中的双样本Kolmogorov-Smirnov 检验, P<0.05认为差异显著;室内模拟降水实验和原位自然降水实验中降水组和对照组之间幼体孵化的比较采用重复测量方差分析方法, P<0.05认为差异显著; 此外, 利用独立样本 t检验方法分析室内模拟降水实验和原位自然降水实验中降水组和对照组之间各检测时间点累积孵化数以及高斯模拟中振幅值、高峰值的差异, P<0.05认为差异显著。
2 结果
2.1 模拟降水对卵带内胚胎发育的影响
经历模拟降水之后, 日本菊花螺卵带胚胎发育受到显著影响(图2)。在12、36、72和96 h, 对照组卵带胚胎发育至囊胚期、原肠胚期、担轮幼体和面盘幼体的比例分别为 69.50%、54.00%、41.50%和61.00%, 降水组卵带胚胎发育至该 4个时期的比例仅为65.25%、30.75%、5.50%和21.25%。在孵育时间为96 h时, 降水组卵带中处于多细胞期、囊胚期、原肠胚期、担轮幼体的比例还分别达到 4.75%、35.00%、21.50%和17.50%。非参数检验分析结果显示, 除了在12 h时(P=0.863)以外, 在其他3个时间点, 降水组和对照组之间卵带内胚胎的发育情况存在极显著的差异(P<0.01), 说明降水组卵带胚胎发育存在明显的滞育现象。
2.2 模拟降水对卵带幼体孵化的影响
实验设计中降水组和对照组的平行数均为15个,但两组中的卵带均有一部分被原生动物污染, 因此降水组和对照组的生物平行最终分别为 9个和 13个。重复测量方差分析结果显示, 降水对卵带幼体孵化有显著影响(P=0.05)。经历模拟降水之后, 各检测时间点降水组累积幼体孵化数均小于对照组。独立样本t检验结果显示, 从降水刺激后的第20 d起到第32 d, 对照组和降水组的累积幼体孵化数均存在显著的差异(P值为0.038~0.043)。综合分析, 模拟降水会显著影响到幼体孵化。利用独立样本t检验方法分析发现, 对照组和降水组的振幅值、高峰值之间均不存在显著差异(P>0.05; 表 1和表 2), 表明室内模拟降水并不影响卵带单位时间幼体孵化最高值和最高值出现时间。
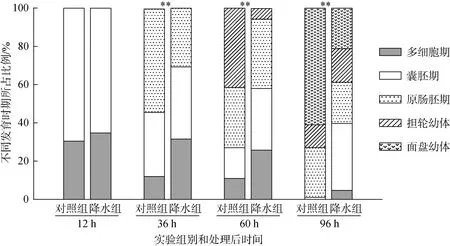
图2 模拟降水后降水组和对照组卵带内胚胎发育状况Fig. 2 Development of egg ribbons in the control and treatment groups with simulated rainfall图中**号表示组间存在极显著差异The double asterisk (**) represents significant differences between the control and treatment (P<0.01)
2.3 自然降水对卵带幼体孵化的影响
经历自然降水之后, A1、A2、A3、A4组卵带与相对应的对照组在最终幼体孵化数上均无显著差异(独立样本t检验, P>0.05; 图4)。重复测量方差分析结果也显示, 各个时期的对照组和降水组之间卵带的幼体孵化不存在显著差异(P>0.05)。利用独立样本t检验方法分析各个时期的对照组和降水组的振幅值、高峰值结果表明: 各时期的对照组和降水组振幅值之间均不存在显著差异(P>0.05), 说明自然降水并不影响卵带单位时间内幼体孵化的最高值(表1)。但是各时期对照组高峰值均显著大于对应的降水组(P<0.05), 差值为1 d左右(表2)。表明在经历自然降水之后, 虽然降水对卵带幼体孵化数并未受到影响,但幼体孵化的高峰期提前, 幼体孵化速率明显加快。
3 讨论
日本菊花螺卵带能为胚胎提供保护, 有效抵御淡水所造成的影响。自然降水实验表明, 卵带在经历自然降水后, 累积幼体孵化数和单位时间幼体孵化最高值并没有受到显著影响。以往研究表明[14,17-18],潮间带和河口区腹足类产出的卵带对低盐环境具有很强的耐受能力, 这种能力与胚胎外部的卵囊和凝胶状物质的保护有紧密关系。Eyster[19]阐述了卵囊结构与盐度变化的关系, 发现卵囊外壁可阻断大分子物质(包括盐离子)的传输, 使卵囊内盐度环境保持稳定。Woods和DeSilets的研究[20]指出, 凝胶状物质可减缓盐分流失。在面对短期盐度变化时, 卵囊和凝胶状物质对腹足类胚胎的保护能起到关键作用。

图3 模拟降水对日本菊花螺幼体孵化数的影响Fig. 3 The effect of simulated rainfall on the larval hatching of Siphonaria japonica

表1 卵带幼体孵化高斯模拟的振幅值统计和独立样本t检验结果Tab. 1 Summary of the Amplitude Values of the Gaussian simulation of larval hatching of Siphonaria japonica

表2 卵带幼体孵化高斯模拟的高峰值统计和独立样本t检验结果Tab. 2 Summary of the Mean Values of Gaussian simulation of larval hatching of Siphonaria japonica
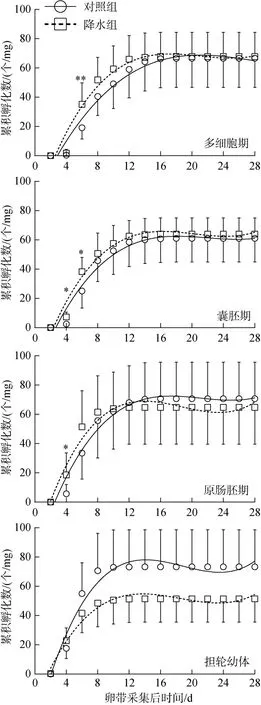
图4 自然降水对日本菊花螺不同时期卵带幼体孵化数的影响Fig. 4 The effects of natural rainfall on larval hatching at different stages of Siphonaria japonica
Woods和 DeSilets的研究[20]指出, 后鳃亚纲 Melanochlamys diomedea的卵带能短期暴露在盐度为5的海水甚至盐度为 0的淡水中。Pechenik等[17]的研究发现, 河口区肺螺亚纲Amphibola crenata能在盐度为5的环境中保持较低的死亡率和正常的孵化率。对新西兰常见菊花螺属 Siphonaria australis的研究[18]发现, 其卵带内胚胎能多次承受盐度为20的海水的刺激而保持正常的发育和孵化。因此, 日本菊花螺卵带在遭受到自然降水后, 卵囊和凝胶状物质可发挥关键的保护作用, 保障卵带内胚胎的正常发育和幼体孵化。
中雨级别的自然降水会加快幼体孵化的速率。在自然降水实验中, 各时期降水组卵带单位时间幼体孵化最高值出现的时间点均比相对应的对照组减少了1 d左右, 说明降水组幼体孵化的高峰期提前。这与以往的研究结果不同, 以往研究认为低盐环境会延长腹足类卵带内胚胎发育时间, 推迟幼体的孵化[17]。有研究就指出, 对于肺螺亚纲 Amphibola crenata、后鳃亚纲Elysia viridis和3种Doto属物种,低盐环境会显著延长2~3 d卵带内胚胎发育的时间,推迟幼体孵化时间[19,21-22]。Pechenik等[17]认为这是因为幼体孵化和卵带瓦解需要化学物质(有可能是酶)参与, 每一个卵囊内幼体孵化时需要邻近已孵化卵囊中的物质提供协助, 部分幼体滞育或者死亡都可能减缓整个卵带幼体孵化过程。但同时Pechenik等[17]也指出, 盐度变化影响卵带胚胎发育和孵化速率的机制并未完全厘清, 需要在机理方面进行更多研究。因此, 关于本研究中自然降水加快日本菊花螺卵带幼体孵化速率的机理还需要进一步深入研究。
实验室内模拟降水对日本菊花螺卵带胚胎发育和幼体孵化产生了显著影响。在遭受到模拟降水后,卵带内部分胚胎发生明显的滞育现象, 幼体孵化数显著减少。这表明, 虽然卵囊和凝胶状物质能在一定程度上保护胚胎, 但卵带在面对急剧变化的盐度环境时, 内外渗透压会失去平衡, 引起胚胎细胞抗氧化能力下降、脂质过氧化[23], 使得胚胎发生滞育甚至会造成畸形, 最终会降低幼体孵化数量[20,24]。降水组卵带内胚胎的滞育和幼体孵化数的减少并未影响到幼体孵化的速率, 对照组和降水组高斯模拟的高峰值之间不存在显著差异(P=0.837; 表2)。表明受到模拟降水的影响后, 卵囊和凝胶状物质仍能保障卵带内部分胚胎按照正常速率孵化。相似的情况也存在于部分肺螺亚纲生物胚胎发育过程中, A. crenata的胚胎在卵囊和凝胶状物质的保护下, 能够在盐度为10的海水中保持正常的孵化速率[17]。
实验室模拟降水与自然降水对日本菊花螺卵带幼体孵化的影响存在明显差异。实验室内模拟降水显著减少卵带幼体孵化数量, 但并未影响幼体孵化速率; 自然降水对卵带幼体孵化数量并没有显著影响, 但加快了卵带幼体孵化速率。产生这种差异的原因主要包括以下方面: 模拟降水实验中的卵带来自实验室暂养的成体, 暂养的成体与自然环境下的成体之间生理状态可能存在差异, 这可能会影响到卵带和胚胎的状态[10]; 模拟降水的雨量超过暴雨级别(大于 50 mm/h), 原位实验中的自然降水只有中雨级别,降水量的差异对卵带胚胎发育和孵化可能产生不同的影响。在以后的研究中, 我们会进一步探索不同降水量对日本菊花螺卵带胚胎发育和孵化产生的影响。
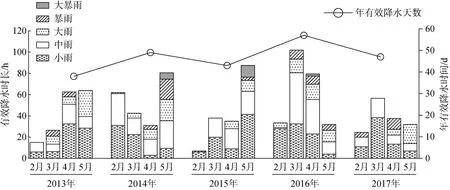
图5 2013年—2017年日本菊花螺繁殖季节有效降水数据统计Fig. 5 Effective precipitation in breeding season of Siphonaria japonica from 2013 to 2017
降水带来的盐度变化是影响日本菊花螺繁殖和种群动态的重要因素。对于厦门地区2013年—2017年日本菊花螺繁殖季节(2~5月)有效降水统计的结果显示(图5), 每年有效降水时长达150.5~274 h, 时间在38~57 d之间, 平均每2~4 d发生1次有效降水, 有效降水发生频率较高。其中对潮间带盐度变化影响较大的强降雨天气(中雨以上)较多出现在4月与5月,可能对日本菊花螺胚胎和幼体发育产生重要影响。此外, 对厦门百年来降水量变化特征分析结果显示,全年降水量呈现明显的上升趋势[25]。Walther等[26]指出, 我国东南沿海的年降水量在上个世纪后期的30年中增加了近10%。降水量增加可能会加重降水对潮间带贝类发育及种群动态的影响。
参考文献:
[1] Hirano Y. Siphonaria (pulmonate limpet) survey of Japan-II. Periodicity of spawning activity in Siphonaria japonica[J]. Publications of the Seto Marine Biological Laboratory, 1980, 25: 335-342.
[2] Wang J, Ling M T, Dong Y W. Causations of phylogeographic barrier of some rocky shore species along the Chinese coastline[J]. BMC Evolutionary Biology,2015, 15: 1-15.
[3] 佟文天, 李捷, 王海艳, 等. 海南三亚风景区潮间带软体动物的资源现状研究[J]. 海洋科学, 2013, 37(8):11-15.Tong Wentian, Li Jie, Wang Haiyan, et al. The current situation of intertidal shellfish resources in Sanya,Hainan[J]. Marine Sciences, 2013, 37(8): 11-15.
[4] 蔡林婷, 王一农, 李祥付, 等. 舟山东极岛潮间带贝类生态学初步研究[J]. 海洋科学, 2013, 37(8): 47-54.Cai Linting, Wang Yinong, Li Xiangfu, et al. Preliminary study on the shellfish ecology in intertidal zone of the Dongji Island[J]. Marine Sciences, 2013, 37(8): 47-54.
[5] Hodgson A N. The biology of siphonariid limpets(Gastropoda: Pulmonata)[J]. Oceanography and Marine Biology : an Annual Review, 1999, 37: 245-314.
[6] 曾陇梅, 杨东波, 符雄, 等. 日本菊花螺 Siphonaria japonica化学成分的研究(I)[J]. 高等学校化学学报,1992, 13: 1265-1267.Zeng Longmei, Yang Dongbo, Fu Xiong, et al. Studies on the chemical constituents of the marine mollusk,Siphonaria japonica (I) [J]. Chemical Journal of Chinese Universities, 1992, 13: 1265-1267.
[7] 王金庆, 成永旭, 吴旭干. 瘤背石磺的胚胎和幼虫发育[J]. 上海水产大学学报, 2005, 14(2): 108-115.Wang Jinqing, Cheng Yongxu, Wu Xugan. Embryonic and larval development of Onchidium struma[J]. Journal of Shanghai Fisheries University, 2005, 14(2): 108-115.
[8] Ocaña T M J, Emson R H. Maturation, spawning and development in Siphonaria pectinata Linnaeus (Gastropoda: Pulmonata) at Gibraltar[J]. Journal of Molluscan Studies, 1999, 65(2): 185-193.
[9] Mileikovsky S A. Types of larval development in marine bottom invertebrates, their distribution and ecological significance: a re-evaluation[J]. Marine Biology,1971, 10: 193-213.
[10] Przeslawski R. A review of the effects of environmental stress on embryonic development within intertidal gastropod egg masses[J]. Molluscan Research, 2004, 24:43-63.
[11] 张鹏飞, 徐小伟, 周龙, 等. 几种环境因子对波纹巴非蛤面盘幼虫发育的影响[J]. 海洋科学, 2016, 40(12):13-18.Zhang Pengfei, Xu Xiaowei, Zhou Long, et al. Effects of several environmental factors on the larval development of Paphia undulata[J]. Marine Sciences, 2016,40(12): 13-18.
[12] 孔宁, 连建武, 薛艳洁, 等. 水温和盐度对皱纹盘鲍“97”选群第6代变态及变态幼体生长存活的影响[J].海洋科学, 2016, 40(10): 49-54.Kong Ning, Lian Jianwu, Xue Yanjie, et al. Effects of water temperature and salinity on metamorphosis,post-larval survival, and growth of the sixth generation of “97” selective breeding population of Haliotis discus hannai Ino[J]. Marine Sciences, 2016, 40(10): 49-54.
[13] 陈志, 高如承, 胡青, 等. 温度、盐度和密度交互作用对波纹巴非蛤幼贝生长的影响[J]. 海洋科学, 2013,37(8): 55-60.Chen Zhi, Gao Rucheng, Hu Qing, et al. The effect of temperature, salinity and density on growth of Paphia undulata youth analyzed by response surface methodology[J]. Marine Sciences, 2013, 37(8): 55-60.
[14] 沈和定, 陈汉春, 陈贤龙, 等. 盐度对石磺胚胎发育的影响[J]. 上海水产大学学报, 2006, 15(3): 297-302.Shen Heding, Chen Hanchun, Chen Xianlong, et al. Influence of water salinity on embryonic development of sea-slug Onchidium sp.[J]. Journal of Shanghai Fisheries University, 2006, 15(3): 297-302.
[15] 郑怀平, 朱建新, 柯才焕, 等. 温盐度对波部东风螺胚胎发育的影响[J]. 台湾海峡, 2000, 19(1): 1-5.Zheng Haiping, Zhu Jianxin, Ke Caihuan, et al. Effects of temperature and salinity on embryonic development of Babylonia formosae habei (Gastropoda: Buccinidae)[J].Journal of Oceanography in Taiwan Strait, 2000, 19(1):1-5.
[16] 王军, 王志松, 董颖, 等. 盐度对脉红螺卵袋幼体的孵出及浮游幼体存活和生长的影响[J]. 水产科学,2003, 22(5): 9-11.Wang Jun, Wang Zhisong, Dong Ying, et al. Effect of salinity on incubation of fertilized Ropana venosa eggs and survival and growth of its larvae[J]. Fisheries Science, 2003, 22(5): 9-11.
[17] Pechenik J A, Marsden I D, Pechenik O. Effects of temperature, salinity, and air exposure on development of the estuarine pulmonate gastropod Amphibola crenata[J]. Journal of Experimental Marine Biology and Ecology, 2003, 292: 159-176.
[18] Fischer J. Effects of environmental stressors on the early development of intertidal and subtidal gastropod embryos[D]. Wellington: Victoria University of Wellington, 2012.
[19] Eyster L. The embryonic capsules of nudibranch molluscs: literature review and new studies on albumen and capsule wall ultrastructure[J]. American Malacological Bulletin, 1986, 4: 205-216.
[20] Woods H A, DeSilets R J. Egg-mass gel of Melanochlamys diomedea (Bergh) protects embryos from low salinity[J]. Biological Bulletin 1997, 193: 341-349.
[21] Hagerman L. The influence of low salinity on survival and spawning of Elysia viridis (Montagu) (Opisthobranchia, Sacoglossa)[J]. Sarsia, 1970, 42: 1-6.
[22] Kress A. Observations during embryonic development in the genus Doto (Gastropoda, Opisthobranchia)[J].Journal of the Marine Biological Association of the United Kingdom, 1975, 55: 691-701.
[23] Deschaseaux E S M, Taylor A M, Maher W A, et al.Cellular responses of encapsulated gastropod embryos to multiple stressors associated with climate change[J].Journal of Experimental Marine Biology and Ecology,2010, 383: 130-136.
[24] Pechenik J A. Ability of some gastropod egg capsules to protect against low-salinity stress[J]. Journal of Experimental Biology and Ecology, 1982, 63: 195-208.
[25] 温珍治. 厦门近 113a来降水量变化特征分析[J]. 台湾海峡, 2007, 26(1): 17-25.Wen Zhenzhi. Characters of precipitations in recent 113 years in Xiamen areas[J]. Journal of Oceanography in Taiwan Strait, 2007, 26(1): 17-25.
[26] Walther G R, Post E, Convey P, et al. Ecological responses to recent climate change[J]. Nature, 2002, 416:389-395.

