阿司匹林对人宫颈癌Hela细胞BCL-6mRNA表达的影响
张 洁 石小风 谌新兴 贾 静
1.吉首大学医学院,湖南 吉首 416000;2.湘西自治州人民医院,湖南 吉首 416000
阿司匹林对人宫颈癌Hela细胞BCL-6mRNA表达的影响
张 洁1石小风2谌新兴1贾 静1
1.吉首大学医学院,湖南 吉首 416000;2.湘西自治州人民医院,湖南 吉首 416000
目的:研究阿司匹林对人宫颈癌Hela细胞增殖及BCL-6 mRNA 表达量的影响。方法:不同剂量的阿司匹林干预人宫颈癌 Hela细胞24h后,用MTS法观察其对人宫颈癌 Hela细胞增殖状态的影响及采用逆转录-聚合酶链反应(qRT-PCR) 检测阿司匹林作用后 Hela 细胞 BCL-6 mRNA 量的变化。结果:阿司匹林能抑制Hela细胞增殖及促进细胞中 BCL-6 mRNA 的表达,且促进强度随阿司匹林的浓度的增加而增加。结论:阿司匹林能够抑制人宫颈癌Hela细胞的生长,并从 mRNA 水平促进 BCL-6 蛋白的表达。
阿司匹林;人宫颈癌 Hela 细胞;BCL-6
阿司匹林属于非甾体抗炎药的代表药,是临床上常用的解热镇痛药。研究发现长期低剂量服用阿司匹林具有预防肿瘤的作用[1],对肠癌细胞系、乳腺癌、胰岛瘤NIT-1细胞、宫颈癌Hela细胞等均有抑制作用[2-4]。宫颈癌是最常见的妇科恶性肿瘤之一,其全球发病率位居女性恶性肿瘤中第2位[5]。其发病是一个多因素、多步骤级连的过程[6],发病机制尚未完全阐明。BCL-6基因(B cell lymphoma 6,简称 BCL-6)是Ye等[7]在 1993年研究非霍奇金淋巴瘤免疫基因图谱时发现的一种原癌基因。在生理条件下,BCL-6 主要表达于生发中心 B 细胞和 CD4T 细胞,调节B细胞活化及分化相关基因如 blimp-1、CD4等[8]、细胞周期调控基因如p27kip1、cyclinD2、炎症有关的趋化因子基因如MIP-1a 和 IP-10[9]的表达。大量研究发现[10-12]发现BCL-6 在多种肿瘤中表达量增加,并且与肿瘤的增殖、侵袭和迁移密切相关。由于BCL-6与肿瘤密切相关,所以我们推测阿司匹林可能通过促进BCL-6的转录表达来抑制宫颈癌Hela细胞的增殖。本研究通过观察阿司匹林对人宫颈癌 Hela 细胞 BCL-6 mRNA 表达的影响来探究宫颈癌的发病机制。
1 仪器与材料
1.1 细胞 人宫颈癌 Hela 细胞株,购于武汉博士德生物工程有限公司。
1.2 试剂和药品 RPMI-1640培养基(Gibco公司);青霉素-链霉素混合溶液(100×双抗,Gibco公司);胎牛血清 (FBS,Gibco公司);二甲基亚砜 (DMSO,Sigma公司); 0.02% EDTA/0.25% 胰蛋白酶(Gibco公司);Trizol (Invitrogen公司);CellTiter 96 AQueous One Solution Cell Proliferation Assay(promega公司);GoTaq 2-Step RT-qPCR System (Promaga公司);其它试剂均为国产分析纯。
1.3 仪器 二氧化碳培养箱(美国thermo公司);BX51倒置显微镜(日本奥林巴斯公司); NanoDrop 2000超微量分光光度计(美国赛默飞世尔科技公司);T100 Thermal Cycler PCR仪(美国Bio-Rad公司);Eco荧光定量PCR系统(美国Illumina公司)。
1.4 药物 Aspirin(货号:A2093,SIGMA公司)。
2 方法
2.1 阿司匹林溶液的配制与人宫颈癌 Hela 细胞培养
2.1.1 阿司匹林溶液的配制 将40mL完全培养基放至 50mL的离心管中备用;再用电子天平准确称取72.064g的阿司匹林粉末(分子量为 180.16),溶于准备好的 40mL完全血清培养基中,用震荡混匀器充震荡使其完全溶解,再将pH值调至 7.1~7.2,即得 1mol/L 的阿司匹林母液,随后转移至超净台用 0.22μm 的微孔过滤器过滤除菌,分装至小离心管中,置于-20℃冰箱保存,使用时予完全培养基稀释至不同浓度的阿司匹林2.5、5.0、10.0、20.0mmol/L。
2.1.2 人宫颈癌 Hela 细胞培养 人宫颈癌 Hela细胞于37℃、饱和湿度、 5% CO2条件下贴壁培养,经0.25%的胰蛋白酶常规消化后按一定量接种至RPMI-1640培养基(含10% FBS,1%双抗)中吹散均匀,移入新细胞培养皿,于培养箱中继续培养,每3~4d传代1次,每日于倒置显微镜下观察细胞生长状况。
2.2 MTS法检测不同浓度阿司匹林对HeLa细胞的生长抑制率 取处于对数生长期的人宫颈癌 Hela细胞经0.25%的胰蛋白酶常规消化后按按1×104个/孔接种于96孔板内,每孔200μL,接种完毕后,将板置于37℃,含5% CO2的培养箱中贴壁过夜,24h 后,更换培养基为无血清培养基培养24h 后开始进行分组加药,空白组及对照组再分别加入200μL完全培养基,加药组分别加入不同浓度阿司匹林的完全培养基各200μL,每组设5个复孔,加药完毕继续于培养箱中培养;培养24h后,将板取出,每孔加入40μL MTS溶液,继续培养1~4h取出96孔板,用酶标仪测定490nm波长处的吸光度,实验重复3次。计算细胞的生长抑制率=(1-实验组OD值/对照组OD 值)×100%。
2.3 qRT-PCR 检测阿司匹林对HeLa 细胞中BCL-6 mRNA表达的影响 取处于对数生长期的细胞如前常规消化后按1×106个/孔接种于6孔板内,每孔2mL,接种完毕后,将板置于37℃,含 5%CO2的培养箱中贴壁过夜。次日,分别加药入不同浓度阿司匹林的完全培养基各2mL,对照组加入2mL完全培养基,加药完毕继续于培养箱中培养。取出细胞提取总RNA,NanoDrop 2000超微量分光光度计测定的RNA的浓度与纯度。按GoTaq 2-Step RT-qPCR System说明书进行逆转录(反应体系20μL,逆转录反应条件:25℃×10min,42℃×60min,70℃×15min,4℃×5min)以及qPCR(反应体系20μL,反应条件:扩增反应条件:95℃×2min,95℃×15sec,60℃×60sec,总共45个循环),实验重复3次。qPCR引物由北京市金瑞斯生物技术有限公司设计并合成,基因引物见表1。采用相对定量法(2-ΔΔCT法)计算目的mRNA相对表达量。

表1 RT- PCR 实验引物序列

3 结果
3.1 阿司匹林对HeLa细胞生长抑制率的影响 MTS结果显示,不同浓度的阿司匹林(2.5、5.0、10.0、20.0mmol/L)作用HeLa细胞24h后能抑制HeLa细胞的增殖,与对照组相比差异具有统计学意义(P<0.05),且呈剂量依赖性,即其抑制率随浓度的增大而逐渐增加。见图1、表2。

表2 阿司匹林对HeLa细胞作用24h生长的影响±s)
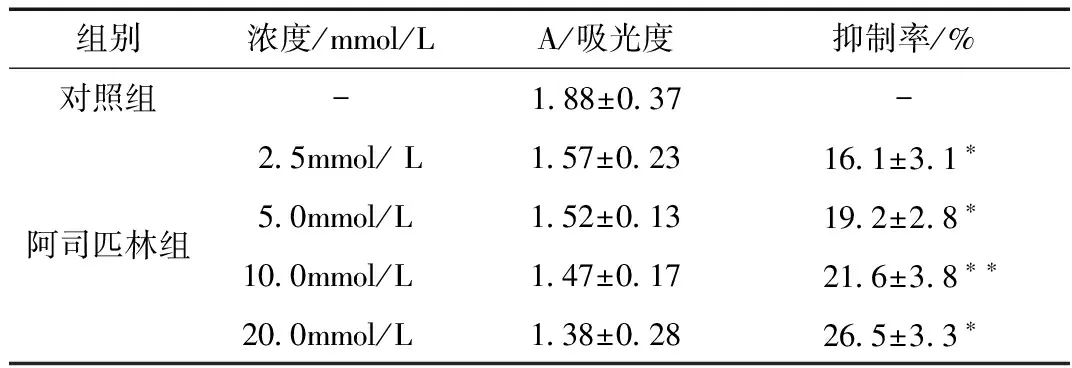
组别浓度/mmol/LA/吸光度抑制率/%对照组-1 88±0 37-阿司匹林组2 5mmol/L1 57±0 2316 1±3 1∗5 0mmol/L1 52±0 1319 2±2 8∗10 0mmol/L1 47±0 1721 6±3 8∗∗20 0mmol/L1 38±0 2826 5±3 3∗
注: 与对照组相比,*P<0.05,**P<0.01。
3.2 阿司匹林对HeLa细胞中BCL-6 mRNA表达的影响 qRT-PCR结果显示,不同浓度的阿司匹林(0、2.5、5.0、10.0、20.0mmol/L)作用HeLa细胞24h后能促进HeLa 细胞中BCL-6 mRNA表达,与对照组相比差异具有统计学意义(P<0.05),且呈剂量依赖性,即其促进程度随浓度的增大而逐渐增加。见图2。

4 讨论
原癌基因BCL-6属于抗细胞凋亡家族,编码核转录抑制蛋白,在生发中心B细胞和具有生发中心B细胞表型的淋巴瘤中高表达。BCL-6的主要功能是转录抑制作用,受BCL-6调控的靶基因主要与细胞活化、分化和增生相关。研究发现BCL-6在多种肿瘤中有高表达,且与肿瘤的增殖、侵袭等密切相关[10-12]。BCL-6在弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤、Burkitt淋巴瘤等淋巴瘤中显著高表达,且已成为弥漫大B细胞淋巴瘤的诊断标志物之一[13-14]。
宫颈癌是发生在全球妇女中仅次于乳腺癌的第二常见的恶性肿瘤。我国宫颈癌发病率已高居世界第二位,仅次于智利,且发病年轻化趋势明显,因此研究宫颈癌的发病机制、治疗、预防是一大热点。目前认为宫颈癌的发病主要与HPV感染引起机体内源性因素产生影响,如相关癌基因激活、抑癌基因失活、端粒酶活性高表达和机体免疫调节机制失衡等一系列病理改变,引起细胞增殖与凋亡调节异常,导致组织癌变。阿司匹林是非甾体抗炎药 (NSAIDs),可以通过抑制COX和NOS-2激活等途径来预防和抑制肿瘤的作用[15]。实验研究[16-18]也确实证明了阿司匹林能够抑制宫颈癌细胞的增殖与凋亡,但具体机制不详。
基于原癌基因BCL-6与宫颈癌发生发展的相关性,本项目组进行了此次实验,实验结果表明阿司匹林具有明确的抗宫颈癌的作用,并且该作用可能与其促进BCL-6的表达有关。其促进作用于阿司匹林的浓度呈正相关,但是阿司匹林是如何通过促进BCL-6表达来抑制宫颈癌的还需进一步的深入研究。
[1]Peter M Rothwell,F Gerald R Fowkes,Jill FF Belch,et al.Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials[J].The Lancet,2011(59):31.
[2]Goel A,Chang KD,Ricciardiello L,et al.A novel mechanism for aspirin-mediated growth inhibition of human colon cancer cells[J].Clinical Cancer Reaearch,2003(91):383.
[3]孙情,冯乔,熊毅,等.阿司匹林对胰岛瘤细胞株NIT-1细胞增殖及NF-κB表达的影响[J].中国糖尿病杂志,2012(11):862.
[4]李盛,严浩,黄志琨.阿司匹林诱导人宫颈癌HeLa细胞凋亡及机制[J].中国医院药学杂志,2012(9):675.
[5]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2) : 69.
[6]曾康康,莫祥兰,刘斐,等.宫颈癌及癌前病变阻滞中 microRNAs 的差异表达[J].肿瘤防治研究,2014,41(7) : 789.
[7]Ohtani M, Miyadai T.Functional analysis of fish BCL-6 and Blimp-1 in vitro: transcriptional repressorsfor B-cell terminal differentiation in fugu (Takifugu rubripes)[J].Mol Immunol, 2011, 48(7): 818.
[8]Shaffer AL, Yu X, He Y, et al.BCL-6 represses genes that function in lymphocyte differentiation, inflammation, and cell cycle control[J].Immunity, 2000, 13(2): 199-212.
[9]Salamon D, Adori M, He M, et al.Type I interferons directly down-regulate BCL-6 in primary and transformed germinal center B cells: differential regulation in B cell lines derived from endemic or sporadic Burkitt's lymphoma[J].Cytokine, 2012, 57(3): 360-371.
[10]冯慧琳,谭明子,朱连成,等.BCL6与Lewis y在卵巢浆液性肿瘤中的表达及其临床意义[J].现代肿瘤医学,2016(13):2127-2132.
[11]刘雪,吴正升,吴强.乳腺癌细胞中miR-339-5p对BCL-6表达的调节[J].临床与实验病理学,2013(3):244-246.
[12]朱琳,郑胡镛,刘潇,等.BCL6、KLF5、NCL基因在儿童急性淋巴细胞白血病中异常表达的特点[J].中国肿瘤生物治疗杂志,2011(4):362-367.
[13]Salamon D, Adori M, He M, et al.Type I interferons directly down-regulate BCL-6 in primary and transformed germinal center B cells: differential regulation in B cell lines derived from endemic or sporadic Burkitt’s lymphoma[J].Cytokine, 2012, 57(3): 360.
[14]Cerchietti L C, Hatzi K, Caldas-Lopes E, et al.BCL6 repression of EP300 in human diffuse large B cell lymphoma cells provides a basis for rational combinatorial therapy[J].J Clin Invest, 2010, 120(12):4569.
[15]Coyle C, Cafferty FH, Langley RE.Aspirin and Colorectal Cancer Prevention and Treatment: Is It for Everyone[J].Curr Colorectal ancer Rep,2016(12):27.
[16]王蓓,王晓,李建立,等.阿司匹林对宫颈癌Hela细胞的增殖抑制作用[J].中国老年学杂志,2013(9):2081.
[17]郑秀娟,李淞漪.阿司匹林对宫颈癌Hela细胞COX-2 mRNA表达的抑制作用[J].浙江临床医学,2007,11:1461.
[18]王蓓,邢邯英,李建立,等.阿司匹林对宫颈癌Hela细胞凋亡及增殖的影响[J].中国老年学杂志,2014(9):2459.
Effect of Aspirin on the Expression of mRNA BCL-6 in Human Cervical Cancer Hela Cells
ZHANG Jie1SHI Xiaofeng2CEN Xinxing1JIA Jing1
1.Medical College of Jishou University, Jishou 416000,China;2.People’s Hospital of Xiangxi Autonomous Prefecture, Jishou 416000,China
Objective To observe the inhibiting effect on aspirin on the proliferation of cervical cancer cells and on the transcription of BCL-6 in vitro.Methods Hela cells were cultured in vitro and interfered by different concentrations of aspirin for 24 hours, the proliferation of the cells were detected by MTS method and the quantity of BCL-6 mRNA were measured by using reverse-transcription polymerase chain reaction (RT -PCR).Results Apirin can inhibit the proliferation of Hela cells and enhance the transcription of BCL-6 mRNA and the effect was in concentration dependent with aspirin.Conclusion Aspirin can inhibit the cells proliferation in vitro and promotes BCL-6 protein expression in the transcription level.
Aspirin; Hela Cells; BCL-6
吉首大学校级科研项目(14JD024);吉首大学医学类专业大学生创新训练项目(JDYXCX201503)。
张洁(1988-),女,苗族,硕士研究生,助理实验师,研究方向为生物化学与分子生物学。E-mail:zhangjie19881003@163.com
R73-36+1
A
1007-8517(2017)05-0049-03
2016-12-23 编辑:程鹏飞)

