油梨品种和部位间抗氧化及乙酰胆碱酯酶抑制活性比较
郑晓燕,王甲水,马伏宁,盛占武,马蔚红,陈文学,谭 琳,*,艾斌凌,郑丽丽,余庆祥
(1.中国热带农业科学院海口实验站,海南省香蕉遗传育种重点实验室,海南 海口 570102;2.海南大学食品学院,海南 海口 571101;3.海南大学农学院,海南 海口 571101)
油梨品种和部位间抗氧化及乙酰胆碱酯酶抑制活性比较
郑晓燕1,王甲水1,马伏宁1,盛占武1,马蔚红1,陈文学2,谭 琳1,*,艾斌凌1,郑丽丽1,余庆祥3
(1.中国热带农业科学院海口实验站,海南省香蕉遗传育种重点实验室,海南 海口 570102;2.海南大学食品学院,海南 海口 571101;3.海南大学农学院,海南 海口 571101)
研究不同品种油梨之间的多酚含量及其抗氧化和乙酰胆碱酯酶抑制活性差异,以期为油梨高价值产品开发提供理论依据。测定热研1号、福尔特、哈斯、里德4 种油梨的果皮、果肉、果核3 个部位乙醇提取物的总酚含量、抗氧化及乙酰胆碱酯酶抑制活性。结果显示:4 种油梨3 个部位的总酚含量为9.6~27.8 mg GAE/g干物质。抗氧化及乙酰胆碱酯酶抑制活性均与样品质量浓度存在剂量关系。其中里德的果皮与果核对1,1-二苯基-2-三硝基苯肼自由基、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基清除活性以及乙酰胆碱酯酶抑制活性均较强,热研1号与福尔特的果皮、果核对·OH清除活性最强。同一品种内,果皮与果核的活性较强,果肉的活性较差。因此,在产品开发过程中应尽可能地提高果皮、果核这些不可食用部位的利用率,达到变废为宝、提高产品附加值的目的。
油梨;多酚;抗氧化;乙酰胆碱酯酶
油梨(Persea americanna Mill)又名酸梨、鳄梨、牛油果、樟梨等,属樟科(Lauraceae)鳄梨属(Persea)常绿植物,其果实呈梨状、果肉含油高、细腻无渣、滑似奶油、墨西哥等地将其誉为“穷人的奶油”。油梨果肉含有多种必需营养素(如不饱和脂肪酸、维生素、蛋白质)以及对人体健康有利的植物化学物质(钠、钾、镁、钙等矿质元素),是一种高能、低糖、易消化的果品[1-2]。
抗氧化剂的摄入能够降低人类心血管疾病、癌症以及神经退行性等慢性病的风险,但是目前用作食品添加剂的合成抗氧化剂对人类健康的影响已经日渐突出,尤其是合成类药物对于治疗阿尔兹海默症等神经退行性疾病的副作用对人体健康有很大影响[3-5]。有研究表明富含抗氧化活性的多酚类物质具有较强的胆碱酯酶抑制活性,对阿尔兹海默症有较好的疗效[6-7]。因此,天然、高效的抗氧化剂受到越来越多的关注。植物来源的酚类、多酚类物质及抗坏血酸等构成了主要的天然抗氧化剂[8-9]。鲜少被有效开发利用的油梨果皮和果核除含有多酚、类胡萝卜素、绿原酸、儿茶素、表儿茶素、没食子酸酯等具有抗氧化活性的成分[10-11],同时还含有抗病毒[12]、抗真菌[13]、抗细胞毒性[14]、保肝[15]和治疗阿尔兹海默症[16]等活性成分,很可能是一种天然抗氧化剂及功能性食品的有效来源。本实验将分别测定4 个不同品种(热研1号、福尔特、哈斯、里德)油梨3 个部位(果皮、果肉、果核)多酚粗提物的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonicacid) diammonium salt free radical,ABTS+·)、·OH清除能力以及乙酰胆碱酯酶抑制活性,比较不同品种不同部位间油梨多酚抗氧化活性、乙酰胆碱酯酶抑制活性的差异,为油梨中活性物质研究提供参考,同时为进一步高效利用油梨副产物,提高油梨附加值提供理论依据。
1 材料与方法
1.1 材料与试剂
成熟的油梨果实采摘自贵州兴义,4 个品种分别是1号:热研1号;2号:福尔特;3号:哈斯;4号:里德,栽培条件相同。
没食子酸 阿拉丁试剂上海有限公司;ABTS、DPPH 梯希爱(上海)化成工业发展有限公司;福林-酚试剂、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)、乙酰胆碱酯酶(acetyl cholinesterase,AChE)、碘化硫代乙酰胆碱(acetylthiocholine iodide,ATCI) 美国Sigma公司;石杉碱甲(色谱纯,纯度>98%) 中国食品药品检定研究院;磷酸氢二钠、磷酸二氢钠(分析纯)、VC等其他试剂(均为分析纯) 广州化学试剂厂。
实验在中国热带农业科学院海口实验站,于2014年9月至2015年8月进行。
1.2 仪器与设备
万能高速粉碎机-FLB-100型 上海菲力博公司;RV10数显型旋蒸仪 德国IKA公司;SPD1010真空离心浓缩仪、Multiskan FC全自动酶标仪 美国Thermo Fisher Scientific公司;UV-1800紫外-可见分光光度计日本岛津公司。
1.3 方法
1.3.1 多酚的提取
参照文献[17]的方法稍作改动。将4 种油梨整果分为4 组,分别洗净,削皮,取果肉、果核,将4 组油梨的果皮、果肉、果核分别置于40 ℃烘箱烘干,用粉碎机粉碎,过100 目筛。分别称取10 g粉末样品,加入体积分数95%的乙醇溶液400 mL,在40 ℃磁力搅拌器上萃取3 h,过滤,滤渣重复上述步骤3 次。合并3 次萃取的滤液,进行旋转蒸发和45 ℃真空浓缩挥去乙醇,得到4 种油梨果皮、果肉及果核浸膏作为实验样品。
1.3.2 总酚含量测定
按照文献[18]的方法,并作了适当改动,取0.2 mL用无水乙醇稀释的提取物,加入0.5 mL蒸馏水和125 μL的福林-酚试剂,室温反应6 min后依次加入4 mL 2%的碳酸钠溶液和1 mL蒸馏水,混匀,避光反应90 min后于760 nm波长处测定其吸光度。利用0~100 μg/mL质量浓度的没食子酸为标准品绘制标准曲线。各提取物总酚含量以没食子酸为标准进行定量,最终的总酚含量以每克干粉所含的没食子酸当量表示(mg GAE/g(以干质量计,下同))。
1.3.3 DPPH自由基清除率的测定
按照文献[19]的方法,并做了适当改动。将待测样品用100%的甲醇分别配制成0.25、0.50、1.00、2.00、4.00、6.00 mg/mL的样品液,分别取0.1 mL样品液添加到2 mL含0.1 mmol/L DPPH的甲醇中,混合,振荡,在室温条件下放置30 min,然后在517 nm波长处测定吸光度。空白为1.5 mL 95%乙醇加入1.5 mL蒸馏水调0。DPPH自由基清除率计算见式(1)。

式中:Ai为0.1 mL样品液加上2 mL DPPH溶液在517 nm波长处的吸光度;Ac为2 mL DPPH溶液加上0.1 mL蒸馏水在517 nm波长处的吸光度;Aj为0.1 mL样品液加上2 mL 95%乙醇在517 nm波长处的吸光度。以VC作为阳性对照,每组实验平行3 次,取其平均值。
1.3.4 ABTS+·清除能力的测定
参考李奕星等[20]的方法。将待测样品用超纯水配制成0.125、0.250、0.500、1.000、2.000、4.000 mg/mL的样品液,分别取不同质量浓度的样品0.2 mL,各加入1.9 mL ABTS工作液,准确反应6 min后于734 nm波长处测量吸光度Ai。按公式(2)计算ABTS+·清除率。
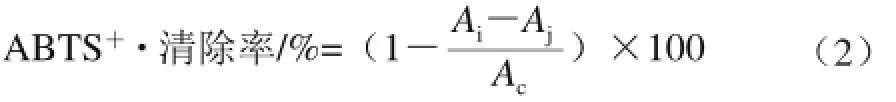
式中:Aj为各质量浓度的样品+超纯水的吸光度;Ac为超纯水+ABTS溶液的吸光度。同时以VC作为阳性对照,重复3 次,结果取平均值。
1.3.5 ·OH清除能力测定
参照文献[21],将待测样品用蒸馏水分别配制成0.125、0.250、0.500、1.000、2.000、4.000 mg/mL质量浓度的样品溶液。损伤吸光度A损:在试管中依次加入1 mL 0.75 mmol/L邻二氮菲溶液、1 mL pH 7.4,0.1 mol/L的磷酸盐缓冲液、1 mL 0.75 mmol/L硫酸亚铁、1 mL蒸馏水,再加入1 mL 0.01% H2O2,混匀后在37 ℃水浴反应60 min,于536 nm波长处测定吸光度。空白吸光度A空:将A损反应中的H2O2用蒸馏水代替后测定的吸光度;样品吸光度A样:将A损反应中的蒸馏水用样品代替后测定的吸光度。以VC作为阳性对照,每组实验平行3 次,取其平均值。·OH清除率计算见公式(3)。

1.3.6 乙酰胆碱酯酶抑制活性测定
参照文献[22-23]的方法并稍作修改。用pH 8.0、0.01 mol/L磷酸盐缓冲液将待测样品配制成80.0、40.0、20.0、10.0、5.0、2.5 mg/mL的样品溶液,在96 孔板中加入依次加入pH 8.0、0.01 mol/L磷酸盐缓冲液50 μL、样品25 μL、1.0 μg/mL AChE 25 μL,4 ℃静置20 min后每孔再加0.30 mg/mL ATCI 25 μL、 0.59 mg/mL DTNB 125 μL,反应显色(整个反应体系为250 μL),恒温37 ℃孵育20 min,酶标仪412 nm波长处检测样品的OD值,即OD样品。按照公式(4)计算ACHE抑制率:
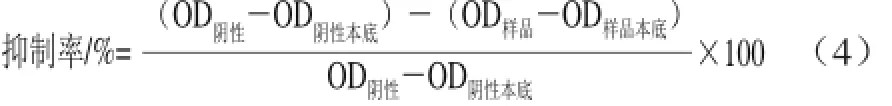
式中:OD阴性为磷酸盐缓冲液代替样品组中的样品液的OD值;OD阴性本底为用磷酸盐缓冲液代替阴性组中的酶溶液的OD值;OD样品本底为用磷酸盐缓冲液代替样品组中的酶溶液的OD值。以石杉碱甲为阳性对照,实验重复3 次取平均值。
数字通信中常用的调制方式有:MASK就是控制信号的幅度,MFSK就是控制信号的频率,MPSK就是控制信号的相位。
1.4 数据统计分析
采用SPSS 13.0统计分析软件计算IC50值,并利用软件中的ANOVA方法对实验数据进行差异显著性检验分析,以P<0.05为差异显著,结果以±s表示。
2 结果与分析
2.1 4 个品种油梨总酚含量比较
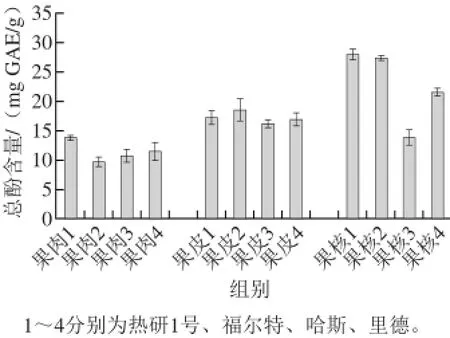
图 1 4 个品种油梨总酚含量比较Fig. 1 Comparison of total phenolic contents in different parts of avocado fruits from four different cultivars
采用福林-酚比色法,以没食子酸为对照品绘制标准曲线,标准曲线方程为y=0.000 7x+0.059,R2=0.999 2。测定的4 个品种油梨3 个部位的总酚含量如图1所示。从图1可以看出,油梨的3 个部位果皮、果肉、果核之间总酚含量是果核最高,果皮次之,果肉最少。4 个品种之间,果肉部位的总酚含量由高到低是热研1号>里德>哈斯>福尔特;果皮部位的总酚含量由高到低是福尔特>热研1号>里德>哈斯;果核部位的总酚含量由高到低是热研1号>福尔特>里德>哈斯。
2.2 4 个品种油梨对DPPH自由基清除效果
由图2可以看出,4 个品种油梨果皮的DPPH自由基清除率比较,均显著低于VC(P<0.05),且随着样品质量浓度的增加清除率不断增加。在样品质量浓度0.0~47.6 μg/mL之间,里德果皮的DPPH自由基清除率显著低于热研1号与福尔特(P<0.05),当样品质量浓度大于47.6 μg/mL后热研1号、福尔特、哈斯果皮的DPPH自由基清除率趋于平缓,里德果皮的则明显增强,样品质量浓度达238.1 μg/mL时,其清除率达到99.5%,与VC差异不显著。4 个品种中哈斯的清除效果最差,样品质量浓度为238.1 μg/mL时,DPPH自由基清除率仅54.6%。

图 2 4 个品种油梨果皮DPPH自由基清除效果比较Fig. 2 Comparison of DPPH radical scavenging activity of avocado peels from four different cultivars

图 3 4 个品种油梨果核对DPPH自由基的清除效果Fig. 3 Comparison of DPPH radical scavenging activity of avocado pits from four different cultivars
图3是4 个品种油梨果核的DPPH自由基清除率测定结果,可以看出4 个品种油梨果核都是随着质量浓度的提高,自由基清除率不断升高,在样品质量浓度为14.9~119.0 μg/mL时,福尔特、里德果核的DPPH自由基清除率急剧升高,尤其是里德,达到92.7%。当样品质量浓度达到476.2 μg/mL,4 个品种油梨果核的DPPH清除率虽然与VC差异显著(P<0.05),但是都达到89%以上。2.3 4 个品种油梨对ABTS+·清除效果
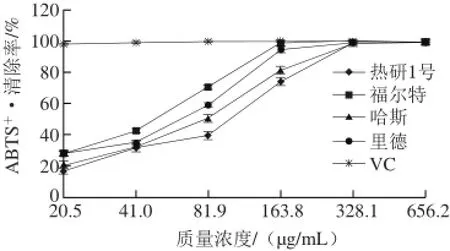
图 4 4 个品种油梨果皮对ABTS+·的清除效果Fig. 4 Comparison of ABTS radical scavenging capacity of avocado peels from four different cultivars

图 5 4 个品种油梨果肉对ABTS+·的清除效果Fig. 5 Comparison of ABTS radical scavenging activity of avocado pulps from four different cultivars
由图5分析,在样品质量浓度为0.16~1.31 mg/mL之间时,4 个品种油梨果肉对ABTS+·的清除能力极显著低于VC(P<0.01),但清除率随质量浓度的提高而升高,当质量浓度达到5.25 mg/mL时,里德、哈斯果肉的ABTS+·清除率分别达到100%、99.4%,与VC差异不显著(P>0.05)。

图 6 4 个品种油梨果核对ABTS+·清除效果Fig. 6 Comparison of ABTS radical scavenging activity of avocado pits from four different cultivars
从图6分析,4 种油梨果核对ABTS+·的清除效果基本是随着质量浓度的提高而增强,在样品质量浓度为20.5~163.8 μg/mL时,VC的清除率显著高于4 种油梨果核(P<0.05),当质量浓度大于163.8 μg/mL时,4 个品种的清除率继续升高,里德果核在质量浓度为328.1 μg/mL时,清除率达到100%,热研1号、哈斯也达到98%以上,与VC的差异不显著。当质量浓度为656.2 μg/mL时,哈斯、里德清除率均达到100%,热研1号为99.1%,福尔特最弱,清除率仅92.1%。
2.4 4 个品种油梨对·OH的清除效果

图 7 4 个品种油梨果皮对·OH的清除效果Fig. 7 Comparison of hydroxyl radical scavenging activity of avocado peels from four different cultivars
由图7可知,4 个品种的油梨果皮对·OH的清除率大体上是随着质量浓度的升高而升高,其中热研1号、福尔特果皮在样品质量浓度为113.5 μg/mL时,清除率已经达到99.5%以上,极显著高于VC(P<0.01),当质量浓度达到227.3 μg/mL时,热研1号、福尔特、哈斯果皮的清除率都达到100%,里德果皮在质量浓度为454.6 mg/mL时,才达到100%,但也显著高于VC(P<0.05)。
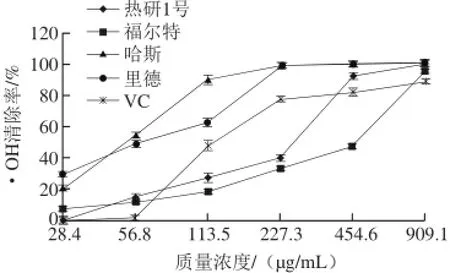
图 8 4 个品种油梨果肉对·OH的清除效果Fig. 8 Comparison of hydroxyl radical scavenging activity of avocado pulps from four different cultivars
由图8可看出,4 个品种的油梨果肉对·OH的清除率总体上是随着质量浓度的升高而升高。样品质量浓度在28.4~113.5 μg/mL之间时,哈斯、里德果肉的清除能力显著高于VC(P<0.05),虽然样品质量浓度在28.4 μg/mL时,热研1号清除率低于福尔特,但当质量浓度大于56.8 μg/mL后,热研1号果肉的·OH清除率上升比福尔特快得多,当样品质量浓度达到454.6 μg/mL时,热研1号果肉的清除率达到92.2%,显著高于VC(P<0.05),而福尔特仅为46.8%,极显著低于VC(P<0.01)。里德比哈斯稍强,当样品质量浓度为113.5 μg/mL时,里德果肉的清除率低于哈斯,但是随着质量浓度的提高,里德果肉的清除率迅速升高,在样品质量浓度为227.3 μg/mL时,里德果肉的清除率达到99.8%,哈斯果肉为98.6%,二者均极显著高于VC(P<0.01),当样品质量浓度为909.1 μg/mL时,热研1号、哈斯、里德果肉的·OH清除率均达到100%,福尔特最差,但也达到95.7%,均显著高于VC(P<0.05)。从图9可看出,4 个品种油梨果核对·OH清除率显著高于VC对照(P<0.05)。清除率随样品质量浓度升高而升高,当质量浓度大于227.3 μg/mL后,趋于平缓,此时,热研1号、福尔特果核清除率已达到100%,哈斯果核达

图 9 4 个品种油梨果核对·OH的清除效果Fig. 9 Comparison of hydroxyl radical scavenging activity of avocado pits from four different cultivars
99.3 %,里德果核为97.8%,随着质量浓度继续升高,哈斯、里德果核的清除率逐渐达到100%。
2.5 4 个品种油梨对乙酰胆碱酯酶的抑制活性

图 10 4 个品种油梨果皮对乙酰胆碱酯酶的抑制活性Fig. 10 Comparison of acetylcholine esterase inhibitory activity in avocado peels from four different cultivars
由图10分析可得,在样品质量浓度为0.25~1.00 mg/mL时,4 个品种油梨果皮对乙酰胆碱酯酶的抑制活性随着质量浓度的升高而提高;在样品质量浓度为0.50 mg/mL时,热研1号果皮的抑制率已经达到65.3%,最低的是哈斯,抑制率为18%,与石杉碱甲相比差异极显著(P<0.01)。
由图11可看出,在低质量浓度时,4 个品种油梨果核对乙酰胆碱酯酶的抑制活性极显著低于石杉碱甲(P<0.01)。在样品质量浓度为0.25~1.00 mg/mL之间时,4 个品种油梨果核对乙酰胆碱酯酶的抑制活性均随样品质量浓度升高而升高,在样品质量浓度为1 mg/mL时,里德果核的抑制活性达到92%,最低的是热研1号,达到36.7%,可以看出,油梨果核的乙酰胆碱酯酶抑制活性随品种变化较大,里德果核的抑制活性最好。

图 11 4 个品种油梨果核对乙酰胆碱酯酶的抑制活性Fig. 11 Comparison of acetylcholine esterase inhibitory activity in avocado pits from four different cultivars
3 讨论与结论
目前国内黄思思等[24]对油梨不同部位(果皮、果肉、果核、叶子)50%甲醇提取物的总酚含量、抗氧化及抗菌活性进行测定,发现油梨果皮的总酚含量最高,果核和叶子次之,果肉的最低。Rodríguez-Carpena等[9]对哈斯与福尔特两个品种油梨的酚类提取物的总酚含量、抗氧化活性、成分进行比较,结果表明不同的提取溶剂对提取物的抗氧化活性以及抗氧化成分有重要影响,丙酮的提取效果最好,提取物的总酚含量最高。不同的油梨品种间以及油梨不同部位间的总酚含量、抗氧化成分、抗氧化活性均不同。Rodríguez-Carpena等[9]还测得油梨的果皮与果核中的抗氧化成分主要为儿茶素、原花青素、黄酮类和羟基肉桂酸;而果肉中主要是羟基苯甲酸、羟基肉桂酸与原花青素,并且羟基苯甲酸的含量比果皮、果核中的高的多。
本研究用乙醇对4 个品种油梨不同部位间多酚进行提取,提取物的总酚含量、DPPH自由基、ABTS+·、·OH清除率等抗氧化活性以及乙酰胆碱酯酶抑制活性测定结果表明,4 个品种之间,果肉部位的总酚含量为9.6~13.7 mg GAE/g,果皮部位的总酚含量为16.1~18.4 mg GAE/g,果核部位的总酚含量为13.7~27.8 mg GAE/g。4 个品种油梨不同部位间多酚提取物的DPPH自由基清除率比较发现,果核的清除效果最好,果皮次之,果肉最差,4 个品种之间差异显著(P<0.05),其中里德的果皮与果核对DPPH自由基的清除效果最好,热研1号最差。ABTS+·清除率实验结果表明,果核的清除效果最好,果皮次之,果肉最差;4 个品种果肉间差异较大,里德效果最好,果皮与果核的清除率在样品质量浓度为328.1 μg/mL时,清除率均达到90%以上。·OH清除率实验结果表明果核比果皮的清除效果好,果肉的稍差;4 个品种果皮与果核的清除率在样品质量浓度为227.3 μg/mL时,清除率基本达到99%左右,而果肉仅哈斯、里德达到。总体来看,油梨果皮与果核都具有较好的抗氧化活性,其中以果核为最佳,果肉最差,这与前人的研究结果相符,但又有出入,原因可能在于一方面本实验用的提取溶剂为乙醇,提取溶剂不同,所得到提取物中成分将有很大差异,并且油梨品种不同,其中的抗氧化成分也不尽相同,从而造成抗氧化活性的差异[25],具体本实验中油梨乙醇提取物含有哪些抗氧化活性物质还需要进一步测定才能确定,这也是本课题组的下一步实验内容。
阿尔兹海默症是一种多病因疾病,胆碱能假说是目前接受率最高的病理理论[26-27]。目前市面上销售的用于治疗阿尔兹海默症药物包括利斯的明[28]、多奈哌齐[29-30]等,对身体具有不同程度的伤害。因此寻找高效、副作用小的天然乙酰胆碱酯酶抑制活性产物对阿尔兹海默症患者具有重要意义。石杉碱甲是从中草药蛇足石杉中分离到的一种强乙酰胆碱酯酶抑制剂[31],本研究以石杉碱甲为阳性对照对油梨果实多酚进行乙酰胆碱酯酶抑制活性研究,结果表明,油梨果皮及果核都具有抑制活性,其中以里德果核提取物效果最佳,在样品质量浓度为1 mg/mL时,抑制活性达到92%,本研究为油梨副产物用于开发抗氧化、增强记忆力等功能食品提供了重要的理论依据,但是具体是哪个组分起到抑制作用,还有待进一步研究。
[1] 钱学射, 张卫明, 黄晶晶, 等. 鳄梨油在化妆品中的应用及配方[J]. 中国野生植物资源, 2012, 31(5): 72-74. DOI:10.3969/ j.issn.1006-9690.2012.05.0019.
[2] CALDERÓN-OLIVER M, ESCALONA-BUENDÍA H B, MEDINACAMPOS O N, et al. Optimization of the antioxidant and antimicrobial response of the combined effect of nisin and avocado byproducts[J]. Food Science and Technology, 2016, 65: 46-52. DOI:10.1016 /j.lwt. 2015.07.048.
[3] 唐明增, 洪志哲, 李向阳, 等.白黎芦醇对小鼠免疫系统调节作用的研究[J]. 现代中西医结合杂志, 2005, 14(18): 2381-2382.
[4] 区俊文. 抗氧化剂在肿瘤防治过程中的作用[J]. 肿瘤代谢与营养电子杂志, 2014, 1(1): 60-64. DOI:10.16689/j.cnki.cn11-9349/ r.2014.01.021.
[5] KIM D K, JEONG S C, GORINSTEIN S, et al. Total polyphenols, antioxidant and antiproliferative activities of different extracts in mungbean seeds and sprouts[J]. Plant Foods for Human Nutrition, 2012, 67(1): 71-75. DOI:10.1007/s11130-011-0273-x.
[6] CHOI B W, LEE H S, SHIN H C, et al. Multifunctional activity of polyphenolic compounds associated with a potential for Alzheimer’s disease therapy from Ecklonia cava[J]. Phytotherapy Research, 2015, 29(4): 549-53. DOI:10.1002/ptr.5282.
[7] UDDIN M N, AFRIN R, UDDIN M J, et al. Vanda roxburghii chloroform extract as a potential source of polyphenols with antioxidant and cholinesterase inhibitory activities: identif i cation of a strong phenolic antioxidant[J]. BMC Complementary and Alternative Medicine, 2015, 15: 195-204. DOI:10.1186/s12906-015-0728.y.
[8] RODRÍGUEZ-SÁNCHEZ D, SILVA-PLATAS C, ROJO R P, et al. Activity-guided identification of acetogenins as novel lipophilic antioxidants present in avocado pulp (Persea americana)[J]. Journal of Chromatography B, 2013, 942/943: 37-45. DOI:10.1016/j.jchromb. 2013.10.013.
[9] ALIYU A B, IBRAHIM M A, MUSA A M, et al. Free radical scavenging and total antioxidant capacity of root extracts of Anchomanes difformis Engl.(Araceae)[J]. Acta Poloniae Pharmaceutica-Drug Research, 2013, 70(1): 115-121. DOI:10.2298/JSC100818063L.
[10] RODRÍGUEZ-CARPENA J G, MORCUENDE D, ANDRADE M J, et al. Avocado (Persea americana Mill.) phenolics, in vitro antioxidant and antimicrobial activities, and inhibition of lipid and protein oxidation in porcine patties[J]. Journal of Agricultural and Food Chemistry, 2011, 59(10): 5625-5635. DOI:10.1021/jf1048832.
[11] GÓMEZ F S, SÁNCHEZ S P, IRADI M G, et al. Avocado seeds: extraction optimization and possible use as antioxidant in food[J]. Antioxidants (Basel), 2014, 3(2): 439-454. DOI:10.3390/ antiox3020439.
[12] MIRANDA M M, ALMEIDA A P, COSTA S S, et al. In vitro activity of extracts of Persea americana leaves on acyclovir-resistant and phosphonoacetic resistant Herpes simplex virus[J]. Phytomedicine, 1997, 4(4): 347-352. DOI:10.1016/S0944-7113(97)80045-1.
[13] DOMERGUE F, HELMS G L, PRUSKY D, et al. Antifungal compounds from idioblast cells isolated from avocado fruits[J]. Phytochemistry, 2000, 54(2): 183-189. DOI:10.1016/S0031-9422 (00)00055-8.
[14] OBERLIES N H, ROGERS L L, MARTIN J M, et al. Cytotoxic and insecticidal constituents of the unripe fruit of Persea americana[J]. Journal of Natural Products, 1998, 61(6): 781-785. DOI:10.1021/ np9800304.
[15] KAWAGISHI H, FUKUMOTO Y, HATAKEYAMA M, et al. Liver injury suppressing compounds from avocado (Persea americana)[J]. Journal of Agricultural and Food Chemistry, 2001, 49(5): 2215-2221. DOI:10.1021/jf0015120.
[16] OBOH G, ODUBANJO V O, BELLO F, et al. Aqueous extracts of avocado pear (Persea americana Mill.) leaves and seeds exhibit anticholinesterases and antioxidant activities in vitro[J]. Journal of Basic and Clinical Physiology and Pharmacology, 2016, 27(2): 131-140. DOI:10.1515/jbcpp- 2015-0049.
[17] SINGLETON V L, ROSSI J A. Colorimetry of total phenolics with phosphomolybdic phosphotungstic acid reagents[J]. American Journal of Enology and Viticulture, 1965, 16(3): 144-158.
[18] SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTOS R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteau reagent[J]. Methods of Enzymology, 1999, 299(1): 152-178. DOI:10.1016/S0076-6879(99)99017-1.
[19] 杜丽娟, 李拖平, 王娜, 等. 山楂果胶分解物抗氧化作用[J]. 食品研究与开发, 2009, 30(6): 18-20.
[20] 李奕星, 袁德保, 郑晓燕, 等. 诺丽果汁的抗氧化研究[J]. 热带作物学报, 2013, 34(8): 1531-1534. DOI:10.3969/j.issn.1000-2561.2013.08.022.
[21] 陈健, 欧阳玥, 闫静. 磷酸盐缓冲溶液对邻二氮菲-Fe2+氧化法测定羟基自由基的影响[J]. 分子科学学报, 2012, 28(4): 350-352.
[22] 殷帅文, 刘丽萍, 王安萍, 等. 17 种植物不同溶剂萃取物乙酰胆碱酯酶抑制活性研究[J]. 江苏农业科学, 2012, 40(10): 293-296. DOI:10.15889/j.issn.1002-1302.2012.10.038.
[23] 刘海元, 王明兹, 吴水. 乙酰胆碱酯酶活性筛选模型对蛇足石杉内生真菌的筛选研究[J]. 海峡药学, 2012, 24(3): 238-241. DOI:10.3969/j.issn.1006-3765.2012.03.139.
[24] 黄思思, 宁德生, 夏梦雯, 等. 油梨不同部位总酚含量、抗氧化及抗菌活性研究[J]. 广西科学院学报, 2016, 32(2): 1-4. DOI:10.13657/ j.cnki.gxkxyxb.20160512.008.
[25] KOSIŃSKA A, KARAMAĆ M, ESTRELLA I, et al. Phenolic compound prof i les and antioxidant capacity of Persea americana Mill. peels and seeds of two varieties[J]. Journal of Agricultural and Food Chemistry, 2012, 60(18): 4613-4619. DOI:10.1021/jf300090p.
[26] MA X Q, TAN C H, ZHU D Y, et al. A survey of potential huperzine, a natural resources in China: the huperziaceae[J]. Journal of Ethnopharmacology, 2006, 104(1/2): 54-67. DOI:10.1016/ j.jep.2005.08.042.
[27] PARAOANU L E, STEINERT G, KLACZINSKI J, et al. On functions of cholinesterases during embryonic development[J]. Journal of Molecular Neuroscience, 2006, 30(1/2): 201-204. DOI:10.1385/ JMN/30:1-2:201.
[28] LEUNG J G. Donepezil-induced mania[J]. Consult Pharm, 2014, 29(3): 191-195. DOI:10.4140/TCP.n.2014.191.
[29] KRÖGER E, BERKERS M, CARMICHAEL P H. Use of rivastigmine or galantamine and risk of adverse cardiac events: a database study from the Netherlands[J]. American Journal of Geriatric Pharmacotherapy, 2012, 10(6): 373-380. DOI:10.1016/ j.amjopharm.2012.11.002.
[30] 潘晓坤, 胡永桃, 曾萍, 等.多奈哌齐治疗阿尔兹海默症患者的临床剂量使用探讨[J]. 现代生物医学进展, 2016, 16(17): 3359-3362. DOI:10.13241/j.cnki.pmb.2016.17.039.
[31] 邹磊, 全明海. 乙酰胆碱酯酶抑制剂的研究进展[J]. 食品科学, 2005, 26(增刊1): 105-108. DOI:10.3321/j.issn:1002-6630.2005.z1.028.
Comparison of Antioxidant and Acetyl Cholinesterase Inhibitory Activities of Ethanol Extracts from Different Cultivars and Different Parts of Avocado Fruits
ZHENG Xiaoyan1, WANG Jiashui1, MA Funing1, SHENG Zhanwu1, MA Weihong1, CHEN Wenxue2, TAN Lin1,*, AI Binling1, ZHENG Lili1, YU Qingxiang3
(1. Hainan Key Laboratory of Banana Genetic Improvement, Haikou Experimental Station, Chinese Academy of Tropical Agricultural Sciences, Haikou 570102, China; 2. College of Food Science and Technology, Hainan University, Haikou 571101, China; 3. College of Agronomy, Hainan University, Haikou 571101, China)
The antioxidant and acetyl cholinesterase inhibitory activities and polyphenol contents of ethanol extracts from the peel, pulp and pit of avocado fruits of four different cultivars were assayed and compared in this work. The results showed that the contents of total polyphenolics in three parts of avocado fruits ranged from 9.6 to 27.8 mg gallic acid equivalents (GAE) per gram dry weight. The antioxidant and acetyl cholinestera inhibitory activities of all samples were in a concentration-dependent manner. Among four avocado cultivars, the peel and kern of the Reed cultivar exhibited the greatest activity in scavenging 1,1-diphenyl-2-picrylhydrazyl radical (DPPH) and 2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt radical (ABTS+·), as well as inhibiting acetyl cholinesterase, whereas the peel and pit of the Reyan 1 and Fuerte cultivars displayed the highest hydroxyl free radical scavenging activity. For the same variety, the activity of extracts from the peel and pit was much stronger than that of the pulp. Therefore, we should improve the utilization of inedible parts (peel and pit) of avocado fruits as much as possible during processing in order to turn the wastes into treasure and achieve high value-added utilization.
avocado; polyphenol; antioxidant; acetylcholine esterase
10.7506/spkx1002-6630-201705035
TS201.2
A
1002-6630(2017)05-0213-07
郑晓燕, 王甲水, 马伏宁, 等. 油梨品种和部位间抗氧化及乙酰胆碱酯酶抑制活性比较[J]. 食品科学, 2017, 38(5): 213-219. DOI:10.7506/spkx1002-6630-201705035. http://www.spkx.net.cn
ZHENG Xiaoyan, WANG Jiashui, MA Funing, et al. Comparison of antioxidant and acetyl cholinesterase inhibitory activities of ethanol extracts from different cultivars and different parts of avocado fruits[J]. Food Science, 2017, 38(5): 213-219. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705035. http://www.spkx.net.cn
2016-05-16
中国热带农业科学院海口实验站科研启动项目(HKZKY140204)
郑晓燕(1985—),女,助理研究员,硕士,主要从事果品营养与加工研究。E-mail:zhxyhn@126.com
*通信作者:谭琳(1972—),女,副研究员,博士,主要从事食品分子营养学研究。E-mail:tanlin7402@126.com

