新疆北疆地区寄生蜱无形体和疏螺旋体分子流行病学调查
李红雨,赵姗姗,张璘,张科,陈创夫,王远志*
(1石河子大学医学院,新疆 石河子832000;2济南市中心医院输血科,山东 济南250013;3平顶山学院,河南 平顶山467000;4石河子大学动物科技学院,新疆 石河子832000)
新疆北疆地区寄生蜱无形体和疏螺旋体分子流行病学调查
李红雨1,赵姗姗1,张璘2,张科3,陈创夫4,王远志1*
(1石河子大学医学院,新疆 石河子832000;2济南市中心医院输血科,山东 济南250013;3平顶山学院,河南 平顶山467000;4石河子大学动物科技学院,新疆 石河子832000)
为了解新疆北疆地区的家畜主要寄生蜱种的无形体和螺旋体的流行情况。采用聚合酶链反应(PCR)对采自家畜体表的546只成蜱(包括210只亚洲璃眼蜱,209只刻点血蜱,61只草原革蜱,40只边缘革蜱,和26只图兰扇头蜱)进行了无形体和螺旋体的核酸筛检。结果显示,无形体的总阳性率为53.48%(292/546),螺旋体的总阳性率为17.77%(97/546)。此外有15只蜱复合感染了两种病原的核酸。通过测序发现了嗜吞噬细胞无形体,绵羊无形体,伯氏疏螺旋体,伽氏疏螺旋体四种病原核酸,BLAST序列比对分析发现这四种病原核酸存在序列多样性。由此可知,无形体在新疆家畜寄生蜱中呈高流行态势,疏螺旋体呈散在分布,首次从边缘革蜱中检测到绵羊无形体核酸。在新疆等偏远的农村地区控制家畜体表寄生蜱数量以及蜱传病原散播具有紧迫性。
无形体;疏螺旋体;寄生蜱;新疆北疆地区
无形体病(anaplasmosis)是由无形体属(Anaplasma)细菌引起的蜱传人兽共患病。无形体病的病原体包括嗜吞噬细胞无形体、边缘无形体、中央无形体、绵羊无形体、牛无形体和血小板无形体。其中嗜吞噬细胞无形体感染引起人粒细胞无形体病,而绵羊无形体可引起绵羊无浆体病。莱姆病(lyme disease)是由广义的伯氏疏螺旋体(Borrelia burgdorferisensu lato)感染可引起人的游走性红斑为典型特点的莱姆病,感染动物则可表现为系统性症状(如发热、疲乏、慢性进行性消瘦和精神沉郁等)的动物莱姆病。
蜱作为一种体表寄生虫及一些重要人兽共患病的传播媒介和贮存宿主,能给人类的身体健康和畜牧业发展带来严重的危害。比如全沟硬蜱,太平洋硬蜱[1]能够传播导致莱姆病的伯氏疏螺旋体。而肩突硬蜱和太平洋硬蜱[2]能够传播引起人粒细胞无形体病的嗜吞噬细胞无形体。然而在“边、穷、少”的农村地区,系统报道家畜这两种蜱传病原的文献很少。新疆占中国国土面积的六分之一,其经济和卫生条件发展相对滞后,蜱种虐生和蜱传疾病的爆发屡见不鲜[3]。文献报道新疆至少有42个蜱种和10种蜱传疾病[4]。然而关于家畜寄生蜱感染无形体和疏螺旋体系统的流行病调查研究尚未见诸报道。本课题组以往关于西北主要蜱种的调查显示亚洲璃眼蜱、刻点血蜱、草原革蜱、边缘革蜱和图兰扇头蜱是家畜体表的主要蜱种[5]。为了系统评估家畜体表寄生蜱的病原携带情况,我们对北疆13个县、市农村地区的优势蜱种进行无形体和疏螺旋体的流行病学调查。
1 材料与方法
1.1 标本采集
2012-2014年期间(每年4月初至5月中旬),从北疆家畜体表共收集到4711只成蜱。依据参考文献[6]经体视解剖显微镜(LEICA M165C)进行形态学鉴定后,筛选出5个主要蜱种亚洲璃眼蜱210只,刻点血蜱209只,草原革蜱61只,边缘革蜱40只,图兰扇头蜱26只做进一步的调查研究。这546只蜱采自北疆的13个县市(察布查尔、福海、阜康、吉木萨尔、克拉玛依、米泉、木垒、青河、奇台、沙湾、石河子、伊宁和裕民)。
1.2 DNA提取、PCR扩增、测序
按DNA提取试剂盒[天根生化科技(北京)有限公司]说明书,提取蜱的基因组DNA,置于-20℃保存备用。依据参考文献引物[7],进行蜱线粒体 16S rDNA和cox1基因扩增进行进一步的分子学鉴定。依据参考文献[8]采用PCR检测疏螺旋体和无形体核酸。PCR产物送上海生工生物工程技术服务有限公司进行DNA序列测定,测序结果通过在GenBank中进行BLAST分析后,将差异序列登录至GenBank。
2 结果与分析
无形体的分子流行率53.48%,疏螺旋体的流行率为17.77%(表1)。有15只蜱复合感染了无形体和疏螺旋体。复合感染见于亚洲璃眼蜱,刻点血蜱和边缘革蜱。病原核酸测序分析显示:共检出4种病原,即嗜吞噬细胞无形体、绵羊无形体、伯氏疏螺旋体和伽氏疏螺旋体。BLAST序列比对结果显示,新疆北疆地区的这4种病原核酸具有序列多样性(表2),其中嗜吞噬细胞无形体有三种16S rDNA序列类型,分别与中国湖北(GenBank登录号:HQ171975和GQ900613),意大利福贾市(KF293668),美国加利福尼亚(KP276588)最相似。而绵阳无形体有两种16S rDNA序列类型,分别与中国新疆(KJ410246)和土耳其埃拉泽(KF034788)最为接近,伯氏疏螺旋体有两种5S-23S基因间隔区序列类型,分别与美国乔治亚州(KM269458)和中国新疆(KP400556)接近。伽氏疏螺旋体也有两种5S-23S序列类型,分别与俄罗斯莫斯科(AB178363)和捷克布杰约维采(AF497990)最接近。
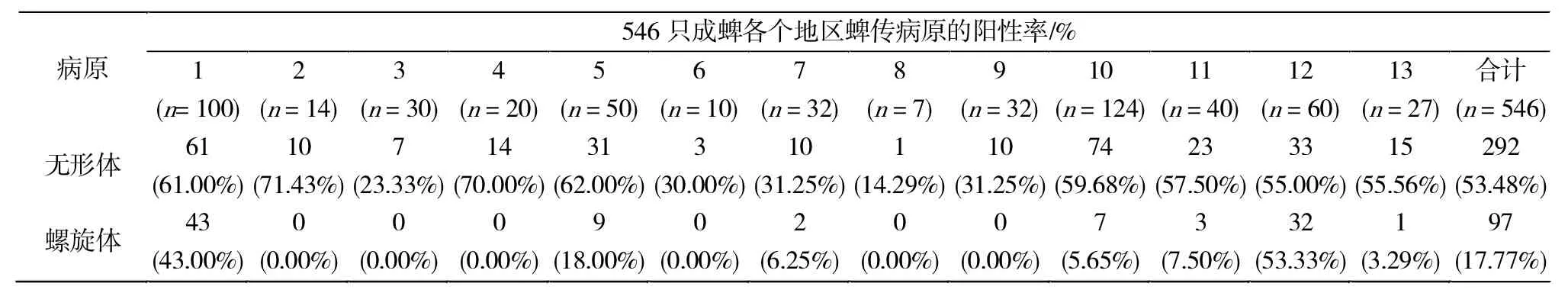
表1 546只成蜱各个地区病原的阳性率%Tab.1 546 adult ticks and prevalence of pathogens in each sampling site
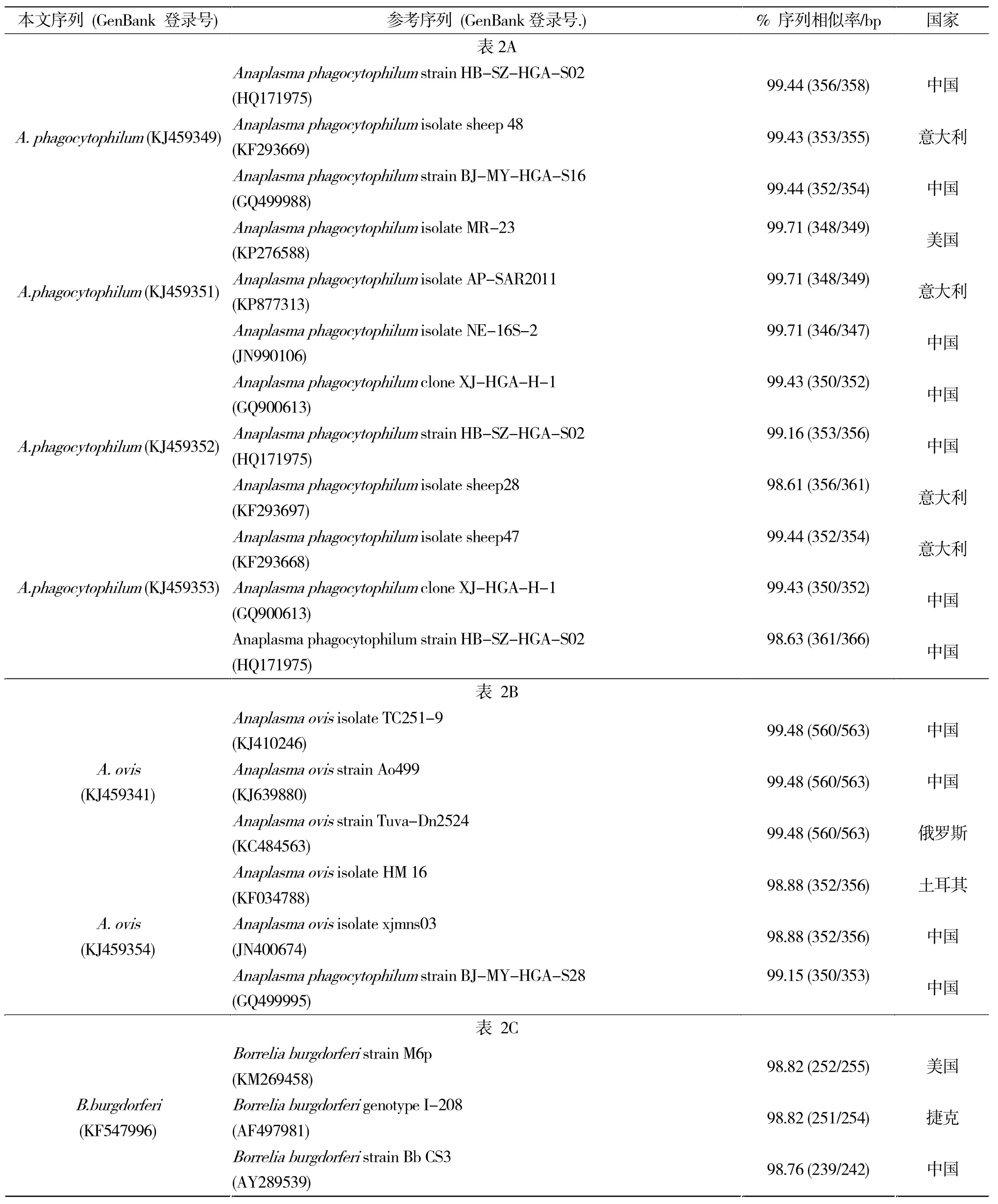
表2 新疆北疆地区主要蜱种中嗜吞噬细胞无形体16S rDNA基因部分序列 (表 2A),绵羊无形体(A.ovis)(表2B),伯氏疏螺旋体5S-23S基因间隔区序列(表2C),伽氏疏螺旋体5S-23S基因间隔区序列(表2D)Tab.2 Closest relative sequences to the partial 16S gene sequences of theAnaplasma phagocytophilum (Table 2A),A.ovis(Table 2B),5S-23S gene sequences ofBorrelia burgdorferi(Table 2C),andB.garinii(Table 2D) detected in the questing ticks,northwest of China

续表1
3 讨论
(1)本研究首次对新疆北疆地区13个县、市农村地区家畜体表寄生的5种优势蜱,进行了无形体和疏螺旋体的核酸检测调查。结果显示无形体和疏螺旋体在本地区家畜寄生蜱中呈高流行态势,携带率分别为53.48%(292/546)和17.77%(97/546)。此外,有15只蜱复合感染了两种病原核酸。这些结果与中国的其他地方[9]相比,新疆家畜体表蜱携带无形体和疏螺旋体具有阳性率高、分布范围广和病原类型丰富的特点,其可能的原因如下:首先,可能是由于新疆的畜牧业规模较大,且是传统养殖,在每年5月之前对家畜很少进行药浴和使用杀虫剂,这种状况与Lorusso[10]等在非洲尼日利亚的调查相似,这就增加了散养家畜之间水平传播蜱传病原的可能性;其次,硬蜱携带无形体是越冬生存的生理需要,Neelakanta[11]等报道寒冷地区无形体高流行可能是因为:无形体能够诱导硬蜱高表达抗冻糖蛋白,从而使多宿主蜱、蜱卵能够成功越冬。
(2)通过PCR和测序本研究发现了4种病原,即:嗜吞噬细胞无形体、伯氏疏螺旋体、伽氏疏螺旋体和绵羊无形体。许多研究显示:在中国,不同蜱种能够特异性的携带不同的无形体种。绵羊无形体曾在伊朗的血红扇头蜱中被检测出来[12]。在本研究中,我们首次在边缘革蜱检出绵羊无形体核酸。边缘革蜱在新疆广泛分布,在山西,陕西,内蒙古,吉林亦有零星分布。笔者认为:今后应加强其他省份边缘革蜱中绵羊无形体核酸的检测;边缘革蜱能否作为绵羊无形体的传播媒介还有待进一步研究。
(3)本调查显示家畜体表寄生蜱携带的无形体和疏螺旋体存在种间多样性,这很可能因为新疆为连接亚欧的古丝绸之路的要道,家畜的国际贸易较为频繁,蜱虫随家畜的贸易运输而播散,由此可能导致其携带的病原具有序列多样性。另外可能由于新疆是世界候鸟迁徙的重要驿站,候鸟的携蜱迁徙,将蜱虫带至世界各地,也为病原的核酸序列多样性提供了一种支持的可能。
(4)Wang[5]等人曾在家畜体表的亚洲璃眼蜱,刻点血蜱,边缘革蜱和图兰扇头蜱中分离出伯氏疏螺旋体。此次病原学调查中检测到了伯氏疏螺旋体和伽氏疏螺旋体核酸,拓宽了以往莱姆病病原在新疆的分布。
(5)硬蜱复合感染多种病原的状况引起人们的关注。欧洲学者报道了篦子硬蜱[13]复合感染伯氏疏螺旋体、嗜吞噬细胞无形体、微小巴贝西虫和分歧巴贝西虫。Milhano[14]等人报道23.3%边缘革蜱中复合感染斯洛伐克立克次体和卢西塔尼疏螺旋体。Chen等[15]在河南的研究显示:27只寄生蜱中有3只长角血蜱复合感染了微小巴贝西虫和未知种立克次体,另外2只蜱分别复合感染了吕氏泰勒虫和未知种埃立克体以及吕氏泰勒虫和嗜吞噬细胞无形体。本研究中蜱复合感染率虽低于以上地区,但检出的蜱传病原(如嗜吞噬细胞无形体、伯氏疏螺旋体)对人、畜健康危害严重,合并感染引起的并发症须引起当地医疗、动物疫控等单位的关注。
综上所述,本研究显示:
1)无形体在新疆北疆地区家畜寄生蜱中呈现高流行和广泛分布,本研究检测到嗜吞噬细胞无形体和绵羊无形体两种病原。
2)蜱中莱姆病病原体在北疆呈散在分布,其病原体为伯氏疏螺旋体和伽氏疏螺旋体,以伯氏疏螺旋体为主,这与以往报道不一致。
3)蜱传病原核酸序列分析显示这4种蜱传病原在北疆存在核酸序列多样性。
4)首次在边缘革蜱中检到了绵羊无形体的核酸。这些研究结果提示:在新疆等偏远的农村地区控制家畜体表寄生蜱以及蜱传病原具有紧迫性。
[1]Padgett K,Bonilla D,Kjemtrup A,et al.Large scale spatial risk and comparative prevalence of borrelia miyamotoi and borrelia burgdorferi sensu Lato in ixodes pacificus[J].Plos One,2014,9(9):110853.
[2]Des Vignes F,Fish D.Transmission of the agent of human granulocytic ehrlichiosis by host-seeking ixodes scapularis (Acari:Ixodidae)in southern New York state[J].J Med Entomol,1997,34(4):379-382.
[3]王光雷,哈列力.蜱害引起家畜大批死亡的调查报告[J].中国动物传染病学报,1997(4):43-43. Wang G L,Li S Q,Nu E,et al.A survey of large livestock deaths from the ticks [J].Chin J Animal Infect Dis,1997 (4):43-43.
[4]Wu X B,Na R H,Wei S S,et al.Distribution of tickborne diseases in China[J].Parasit Vectors,2013,6(1):119.
[5]Wang Y Z,Mu L M,Zhang K,et al.A broad-range survey of ticks from livestock in Northern Xinjiang:changes in tick distribution and the isolation of Borrelia burgdorferi sensu stricto[J].Parasit Vectors,2015,8(1):1-9.
[6]Horak I G,Heyne H,Donkin E F.Parasites of domestic and wild animals in South Africa.XLVIII.Ticks(Acari:Ixodidae) infesting domestic cats and wild felids in southern Africa [J].Onderstepoort J Vet Res,2010,77(1):13-19.
[7]Medina M,Walsh P J.Molecular systematics of the order anaspidea based on mitochondrial DNA sequence(12S,16S,and COI)[J].Mol Phylogenet Evol,2000,15(1):41-58.
[8]Wen B H,Jian R,Zhang Y Z,et al.Simultaneous detection of anaplasma marginale and a new ehrlichia species closely related to ehrlichia chaffeensis by sequence analyses of 16S ribosomal DNA in Boophilus microplus ticks from Tibet[J].J Clin Microbiol,2002,40(9):3286-3290.
[9]李雁,康逢义,杨吉飞,等.甘肃、湖南和广东三省蜱体内嗜吞噬细胞无形体与伯氏疏螺旋体共感染研究[J].中国人兽共患病学报,2013,29(2):117-121. Li Y,Kang F Y,Yang J F,et al.Prevalence and coexistence of anaplasma phagocytophilum and borrelia burgdorferi sensu lato in ticks in Gansu,Hunan and Guangdong provinces,China[J].Chinese J Zoonoses,2013,29(2):117-121.
[10]Lorusso V,Picozzi K,de Bronsvoort B M,et al.Ixodid ticks of traditionally managed cattle in central Nigeria:where Rhipicephalus(Boophilus)microplus does not dare(yet)[J].Parasits Vectors,2013,6(1):1-10.
[11]Neelakanta G,Sultana H,Fish D,et al.Anaplasma phagocytophilum induces Ixodes scapularis ticks to express an antifreeze glycoprotein gene that enhances their survival in the cold[J].J Clin Invest,2010,120(9):3179-3190.
[12]Hosseini Vasoukolaei N,Oshaghi M A,Shayan P,et al.Anaplasma infection in ticks,livestock and human in ghaemshahr,mazandaran province,Iran[J].J Arthropod Borne Dis,2014,8(2):204-211.
[13]Tomanovic S,Chochlakis D,Radulovic Z,et al.Analysis of pathogen co-occurrence in host-seeking adult hard ticks from Serbia[J].Exp Appl Acarol,2013,59(3):367-376.
[14]Milhano N,de Carvalho I L,Alves A S,et al.Coinfections of Rickettsia slovaca and Rickettsia helvetica with Borrelia lusitaniae in ticks collected in a Safari Park,Portugal[J]. Ticks Tick Borne Dis,2010,1(4):172-177.
[15]Chen Z,Liu Q,Liu J Q,et al.Tick-borne pathogens and associated co-infections in ticks collected from domestic animals in central China[J].Parasit Vectors,2014,7(1):1-8.
Molecular investigation on the genera ofAnaplasmaandBorrelia in north region of Xinjiang
Li Hongyu1,Zhao Shanshan1,Zhang Lin2,Zhang Ke3,Chen Chuangfu4,Wang Yuanzhi1
(1 School of Medicine,Shihezi University,Shihezi 832002,China;2 Department of Blood Transfusion,Ji'nan Center hospital, Ji'nan,Shandong 250013,China;3 Department of Basic Medicine,Pingdingshan University,Pingdingshan,Henan 467000,China; 4 Department of Veternary Medicine,College of Animal Science and Technology,Shihezi University,Shihezi,Xinjiang 832000, China)
The aim of this study was to determine the prevalence ofAnaplasmaandBorreliain dominant ticks infecting domestic animals in north region of Xinjiang Uygur Autonomous Region(XUAR).Five hundreds and forty-six represented adult ticks from livestocks (including 210Hyalomma asiaticum,209Haemaphysalis punctata,61Dermacentor nuttalli,40D.marginatusand 26 Rhipicephalus turanicus)were tested by Polymerase Chain Reaction (PCR)for the nucleic acid presence ofAnaplasmaand Borrelia.Overall infectious prevalences were 53.48% (292/546)for Anaplasma spp.and 17.77% (97/546)for Borrelia spp.In addition,15 ticks (2.75%)were co-infected with Anaplasma and Borrelia.Four pathogens,namedA.phagocytophilum,A.ovis, B.burgdorferisensu stricto andB.garinii,were detected by PCR.The sequences of four tick-borne pathogens,in this study, showed genetic diversity by BLAST analysis.In northern region of XUAR,Anaplasmawas highly prevalent in questing ticks from livestocks while theBorreliain questing ticks was scattered.DNA ofA.ovis,for the first time,was found inD.marginatus. It is vital to control tick abundance and tick-borne pathogens from livestocks especially in resource-poor rural communities,such as in XUAR.
Anaplasma;Borrelia;ectoparasitic ticks;Northern region of XUAR
R381
A
10.13880/j.cnki.65-1174/n.2017.01.018
1007-7383(2017)01-0108-05
2016-10-26
国家自然科学基金项目(U1503283,81560338)
李红雨(1988-),男,硕士研究生,专业方向为感染免疫学。
*通信作者:王远志(1977-),男,教授,从事感染免疫学研究,e-mail:wangyuanzhi621@126.com。
——军旅写生作品展

