脱氢表雄酮对卵巢储备功能低下行体外受精-胚胎移植患者治疗结局的影响
林秀峰 吴日然 杜静 全松
随着国家计划生育政策的改革,越来越多高龄患者接受辅助生殖技术助孕治疗,因此,在接受助孕的患者中卵巢储备功能低下(diminished ovarian reserve,DOR)患者的比率也随之升高。如何改善卵巢功能以获得优质卵泡,提高体外受精-胚胎移植(in vitro fertilization - embryo transfer,IVF-ET)妊娠率成为研究的热点。目前临床改善卵巢功能的治疗疗效仍待探讨。一些研究指出,补充脱氢表雄酮(Dehidroepiandroszteron,DHEA)有助于改善DOR患者的卵巢功能,促进其排卵,提高妊娠率,减少染色体非整倍性,降低流产率[1]。本研究在探讨补充DHEA能否改善DOR患者的卵巢储备功能及IVF-ET的临床结局。
对象与方法
1.对象:选取2015年1月—2015年9月在中山市博爱医院生殖中心接受体外受精/卵胞浆内单精子注射(IVF/ICSI)治疗的DOR患者169例,DOR入选标准:(1)有卵巢储备功能降低高危因素,如年龄≥40岁或单卵巢、卵巢手术史、卵巢低反应史(获卵数<5个);(2)卵巢储备功能指标异常,如双侧窦卵泡数(FAC)<5个或基础卵泡刺激素(FSH)>10 U/L,AMH<1.0 U/L;(3)排除其他内分泌疾病、子宫畸形患者[2]。分为应用DHEA预治疗的DHEA治疗组(n=89)及未使用DHEA治疗的对照组(n=80)。DHEA治疗组平均年龄(35.7±5.7)岁,平均不育年限(5.0±4.1)年,原发不孕30例(33.7%),继发不孕59例(66.3%)。对照组平均年龄(36.9±5.0)岁,平均不育年限(5.2±4.5)年,原发不孕31例(38.8%),继发不孕49例(61.2%)。两组年龄、不育年限、BMI和不孕原因比较,差异均无统计学意义。
2.研究设计及超促排卵:DHEA治疗前、后周期行自身对照研究,并与同期未接受DHEA治疗的对照组比较。DHEA治疗组有1次IVF-ET失败经历,再次行IVF-ET治疗前接受DHEA(美国GNC公司,25毫克/片)25 mg,口服,3次/天,疗程为3个月。各组行IVF-ET治疗前均于月经第3日晨起空腹检测外周血卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成激素(luteinizing hormone,LH)、雌二醇(estradiol,E2)、睾酮(total testosterone,T),抗苗勒管素(anti-mullerain hormone,AMH)。血清性激素测定使用化学发光免疫测定法(Elecsys2010,德国Luo公司),血清AMH测定使用酶联免疫法(康润,中国),并经阴道B超(Aloka Medical,日本)计数双侧卵巢内的窦卵泡数。所有患者以拮抗剂方案促排卵。患者均使用重组促卵泡素(rFSH,果纳芬,瑞士默克雪兰诺)或尿促卵泡素(Urofollitropin,uFSH,丽申宝)或尿促性素(Menotropins,HMG,乐宝得,中国丽珠)进行促排卵,在促排药物使用第5天时开始加用GnRH拮抗剂(西曲瑞克,瑞士默克雪兰诺)0.25 mg/d,直至人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)注射日。经阴道B超定期监测卵泡生长情况,并依据卵泡生长情况调整Gn的用量。当双侧卵巢内至少有≥2个直径大于18 mm的卵泡时,给予hCG 10 000 U。在注射hCG后36 h左右取卵。根据男方精液情况,采用IVF或ICSI授精。在取卵后3天进行胚胎移植,移植后给予黄体支持。
3.检测指标:(1)一般情况及卵巢储备功能参数,包括年龄,不孕年限,身体质量指数(BMI),基础FSH、LH、E2、T、AMH,AFC。(2)周期治疗参数及结局,Gn总剂量及使用天数,hCG日E2水平,获卵数、优胚数、受精率、卵裂率、优质胚胎率、临床妊娠率及周期取消率。
4.妊娠判断标准:移植后14天,检测血β-hCG>25 U/L诊为生化妊娠。超声见到妊娠囊、卵黄囊为临床妊娠。
5.相关定义:IVF受精率=(受精卵数/获卵数)×100%;ICSI受精率=(受精卵数/MII卵母细胞数)×100%;卵裂率=(受精卵裂胚胎数/受精卵数)×100%;优质胚胎率=(优质胚胎数/正常受精卵裂胚胎数)×100%;周期取消率(取消周期总数/总周期数)×100%;临床妊娠率(妊娠周期数/所有移植周期数)×100%;流产率=(流产的周期数/所有临床妊娠妊娠周期数)×100%;多胎率(妊娠双胎或三胎的周期数/所有临床妊娠妊娠周期数)×100%;活产率=(活胎分娩周期数/移植周期数)×100%。
6.统计学处理:采用SPSS 17.0统计软件包处理。计数资料采用χ2检验;计量资料以均数±标准差表示,组间比较采用两个独立样本的t检验,组内治疗前、后比较采用配对t检验。P<0.05为差异有统计学意义。
结果
1.两组卵巢储备功能参数的比较:DHEA治疗组治疗前、后BMI、基础LH、基础E2、基础T比较,DHEA治疗组治疗前、后的BMI、基础LH、基础E2、基础T与对照组比较,差异均无统计学意义;DHEA治疗组治疗前、后AFC、AMH比较,DHEA治疗组治疗后基础FSH、AMH与对照组比较,差异均有统计学意义。见表1。

表1 DHEA治疗前、后及对照组卵巢储备功能指标比较
注:与治疗前比较,#P<0.05;与对照组比较,*P<0.05
2.两组周期治疗参数及结局比较:DHEA治疗组治疗前、后和对照组Gn总剂量、Gn使用天数、hCG日E2之间比较,差异均无统计学意义;DHEA治疗组治疗后获卵数较治疗前升高,差异有统计学意义;DHEA治疗组治疗前、后优质胚胎数比较,以及分别与对照组比较,差异均有统计学意义,见表2。
DHEA治疗组治疗前、后和对照组受精率、优质胚胎率、周期取消率之间比较,差异均无统计学意义;DHEA治疗组治疗后卵裂率、临床妊娠率较治疗升高,差异有统计学意义;DHEA治疗组治疗后流产率、多胎妊娠率、活产率与对照组比较,差异均无统计学意义;见表3。
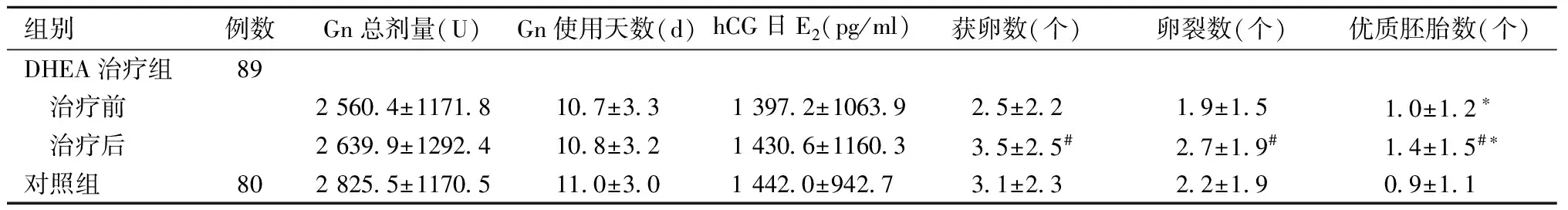
表2 DHEA治疗前、后及对照组周期治疗参数比较
注:与治疗前比较,#P<0.05;与对照组比较,*P<0.05

表3 DHEA治疗前、后及对照组治疗结局比较[例(%)]
注:与治疗前比较,#P<0.05
讨论
随着当今社会及就业压力的加大,女性生育年龄不断推后,以及国家二胎政策的放开,越来越多高龄DOR妇女寻求辅助生殖技术。DOR患者在进行IVF-ET助孕时,其临床妊娠率不高也是目前一大难题。如何改善这部分患者的助孕结局成为研究的热点。有研究提出,DHEA能改善DOR患者的IVF结局[3]。
众所周知DHEA是合成雄激素并进一步转化为雌激素的前体物质,DHEA及其硫酸盐广泛分布于组织器官及循环系统中。研究提示,雄激素可诱导颗粒细胞FSH受体生成,促进DOR患者卵泡对FSH的敏感性促使卵泡募集,增加募集卵泡数目[4],此外,Hassa等[5]还提出DHEA通过降低卵泡闭锁率,增加卵泡池的数量。本研究提示,DHEA治疗后组基础FSH较对照组下降,治疗后AFC、获卵数较DHEA治疗前增加,考虑与此相关。
国外学者研究提示,在窦前和早期窦状卵泡阶段,DHEA能增加卵泡颗粒细胞的增殖标志物(KI-67)和卵泡AMH表达的表达[6]。本研究也提示,DHEA治疗后组AMH较治疗前组及对照组上升。
尽管较多研究提示DHEA能改善DOR患者的获卵数及临床结局[7],但也有研究提示DHEA并不能改善DOR的IVF-ET结局[8-9]。本研究提示,治疗后比治疗前AFC、获卵数增加,但与对照组比较,差异无统计学意义。但值得注意的是优质胚胎数DHEA治疗后最高,差异有统计学意义。有研究[10]根据DHEA降低了胚胎非整倍体概率,降低流产率的表现,认为受损的卵泡不大可能被恢复,DHEA的作用更可能是通过复活卵泡周围老化的环境,从而为卵泡提供更好的发育、成熟场所而发挥作用。
在本研究中,虽然DHEA治疗后与对照组在优质胚胎率、周期取消率差异无统计学意义,但有优质胚胎率上升的趋势,周期取消率有下降趋势,而临床妊娠率差异有统计学意义,这需要增加样本量进一步研究。
综上所述,认为DHEA可以改善重复周期的DOR患者卵巢储备功能,提高卵巢反应性,提高优质胚胎的数量,改善妊娠结局。因此,DHEA预处理可成为重复周期的DOR患者干预治疗中更好的选择。但是由于本研究的例数较少,目前尚无法根据服用DHEA的剂量、时间等分组讨论DHEA的效果。因此,适于国人应用的DHEA剂量和时间等尚有待于大样本进一步研究。
1 Yeung TW,Chai J,Li RH et al.A randomized,controlled,pilot trial on the effect of dehydroepiandrosterone on ovarian response markers,ovarian response,and in vitro fertilization outcomes in poor responders.Fertil Steril,2014;102:108-115.
2 Ferraretti AP,La Marca A,Fauser BC,et al.ESHRE consensus on the definition of ’poor response’ to ovarian stimulation for in vitro fertilization:the Bologna criteria.Hum Reprod,2011,26:1616-1624.
3 Li J,Yuan H,Chen Y,et al.A meta-analysis of dehydroepiandrosterone supplementation among women with diminished ovarian reserve undergoing in vitro fertilization or intracytoplasmic sperm injection.Int J Gynaecol Obstet,2015,131:240-245.
4 Sen A,Prizant H,Light A.Androgens regulate ovarian follicular development by increasing follicle stimulating hormone receptor and microRNA-125b expression.Proc Nati Acad Sci U S A,2014,111:3008-3013.
5 Hassa H,Aydinb Y,Ozatik O,et al.Effects of dehydroepiandrosterone (DHEA) on follicular dynamics in a diminished ovarian reserve in vivo model.Syst Biol Reprod Med,2015,61:117-121.
6 Narkwichean A,Jayaprakasan K,Maalouf WE,et al.Effects of dehydroepiandrosterone on in vivo ovine follicular development.Hum Reprod,2014,29:146-154.
7 李建娟,任春娥,张安清,等.补充DHEA对卵巢储备功能降低患者IVF-ET的影响.辽宁医学院学报,2014,35:51-53.
8 Kara M,Aydin T,Aran T,et al.Does dehydroepiandrosterone supplementation really affect IVF-ICSI outcome in women with poor ovarian reserve? Eur J Obstet Gynecol Reprod Biol,2014,173:63-65.
9 Yeung TW,Chai J,Li RH,et al.A randomized,controlled,pilot trial on the effect of dehydroepiandrosterone on ovarian response markers,ovarian response,and in vitro fertilization outcomes in poor responders.Fertil Steril,2014,102:108-115.
10 Norbert G,Andrea W,David H.Dehydroepiandrosterone (DHEA) reduces embryo aneuploidy:direct evidence from preimplantation genetic screening (PGS).Reprod Biol Endocrinol,2010,8:140.

