银杏性别决定相关基因的筛选*
唐海霞 杜淑辉,2 邢世岩 桑亚林 李际红 刘晓静 孙立民
(1. 山东省森林培育重点实验室 山东农业大学林学院 泰安 271000; 2. 山西农业大学林学院 太谷 030800)
银杏性别决定相关基因的筛选*
唐海霞1杜淑辉1,2邢世岩1桑亚林1李际红1刘晓静1孙立民1
(1. 山东省森林培育重点实验室 山东农业大学林学院 泰安 271000; 2. 山西农业大学林学院 太谷 030800)
【目的】 银杏为典型的雌雄异株裸子植物,成熟雌、雄个体在形态特征和生长习性等方面存在显著差异,这些差异的产生与性别决定机制相关。本文拟通过对银杏性别决定相关基因的筛选为进一步探讨银杏的性别决定机制奠定基础。【方法】 利用RNA-Seq技术对来源于同一家系的25年生银杏雌、雄花芽(CY,XY)及大、小孢子叶球(CH,XH)进行转录组测序及生物信息学分析,以期发现可能参与银杏性别决定过程的相关基因。利用实时荧光定量PCR方法对随机挑选的26个差异表达基因的表达量进行验证。【结果】 通过对8个cDNA文库的测序共得到大约60 Gb的高质量序列,利用高质量序列进行denovo组装共得到108 307条unigene。unigene的平均长度为796 bp。26个随机挑选差异表达基因的实时荧光定量PCR结果与RNA-Seq结果的相关性较高。在所有的unigene中有51 953条(47.97%)unigene在核苷酸或蛋白质公共数据库中得到功能注释。差异表达分析结果表明分别有4 709和9 802个基因在XY/CY和XH/CH中差异表达。11个在XY/CY和XH/CH中共同差异表达参与植物激素信号转导的基因与转录因子(如PYL、SNRK2和EIN3等)以及编码甲基转移酶的基因(如MET1和COMT1等)可能参与了银杏的性别决定过程。【结论】 参与多种调控途径的功能基因可能在银杏的性别决定中发挥作用,性别决定相关基因的筛选可为全面理解银杏的性别决定机制奠定基础。
银杏; 性别决定; 基因; 转录组测序
银杏(Ginkgobiloba)是我国特有的珍稀树种,有“活化石”、植物中的“熊猫”之称,在我国种植范围广泛。作为裸子植物中独特的一类,银杏现仅存一科一属一种(邢世岩等, 2013)。银杏是集材用、果用、药用、观赏于一体的高效多功能经济林树种,具有较高的经济价值、生态效益和研究价值。随着国内外市场对银杏食用、材用、保健、药用等领域的不断拓展,银杏资源已供不应求(Zhangetal., 2015)。银杏为典型的雌雄异株植物,雌雄株在生长习性、形态特征与生产应用等方面存在显著差异。雄株生长速度快、树形美观、抗性强、根系发达,常用作绿化观赏或用材树使用; 银杏种子含有银杏酸等生理药理活性物质,具有重要的食用、药用价值,因此雌株主要以生产种子为主(黄茜等, 2013)。性别决定机制是雌雄性别差异产生的根本原因,而性别决定基因是性别决定的直接执行者(Charlesworth, 2013),但是目前国内外关于银杏性别决定基因的研究还未见报道。对银杏性别决定基因的研究不仅可为破解银杏性别决定机制打下坚实基础,同时也能够加深对植物性别决定机制的理解。
早期的性别决定基因研究大多以一些与性别有关的发育性突变体为材料,研究性别决定基因的作用机制。随着分子生物学技术,特别是分离目的基因的方法的发展,mRNA差异显示PCR、消减杂交法、基因芯片技术、基因表达的系统分析等方法已广泛应用到大规模基因分离与表达分析研究中,但是以上方法普遍存在需要已知目的基因序列、灵敏度低、难以检测低丰度的目标、无法捕捉到目的基因表达水平的微小变化等缺点(Wangetal., 2009)。随着新一代测序技术(next-generation sequencing,NGS)的迅猛发展,RNA-Seq(RNA-sequencing)技术的应用弥补了上述研究方法存在的各种不足。Wu等(2010)利用RNA-Seq技术对黄瓜(Cucumissativus)雌雄花芽的转录组进行了测序与分析,发现了大量在雌雄花芽中差异表达或特异表达的转录因子和基因,为进一步深入探明黄瓜的性别决定机制奠定了坚实基础。Liu等(2013)利用RNA-Seq技术对簸箕柳(Salixsuchowensis)雌雄花芽差异表达基因进行了分析,发现了在雌雄花芽中差异表达的806个基因,其中有33个可能定位于性染色体上,有12个基因可能直接参与了簸箕柳的性别决定,为最终发现杨柳科(Salicaceae)性别决定基因和未来的功能基因组学研究奠定了基础。本研究利用高通量测序技术平台Illumina Solexa对银杏雌雄花芽和大、小孢子叶球进行转录组测序、拼接组装,再利用生物信息学方法对得到的unigene进行功能注释与功能分类,以期为理解银杏性别决定机制奠定基础。
1 材料与方法
1.1 试验材料
根据相关文献(史继孔等, 1998; 张万萍等, 2001; 韩晨静, 2011) 报道,在山东农业大学银杏种质资源圃内挑选来源于同一家系的25年生银杏雌雄株各5株,分别于2015年3月4日和4月10日采集花芽和大、小孢子叶球样本各10个(每株树采集2个样本,共采集40个样本),每5个样本为一组(每组样品设置2个生物学重复)用于构建cDNA文库。所采样本用液氮速冻后存于-80 ℃冰箱备用。
1.2 RNA提取
使用改良的CTAB-LiCl法(Changetal., 1993)提取总RNA,然后使用RNeasy Plant Mini Kit(QIAGEN)对RNA样品进一步纯化。利用Agilent的Nano 6000 Assay Kit和琼脂糖凝胶电泳检测RNA的完整性和质量,保证RNA样品浓度大于400 ng·μL-1,28S/18S大于1.8。
1.3 cDNA文库构建与测序
利用NEB Next®UltraTMRNA Library Prep Kit for Illumina®(NEB, USA)构建cDNA文库,分别为雄花芽(XY)、雌花芽(CY)、小孢子叶球(XH)和大孢子叶球(CH),然后利用Illumina Hiseq 2500平台对构建的cDNA文库进行DNA双末端测序,得到2×125 bp的原始数据。
1.4 数据拼接和功能注释
去掉原始数据中的低质量序列和接头序列后,将所有高质量序列混合后利用软件Trinity(Grabherretal., 2011)进行组装得到unigene。利用BLAST系列软件将银杏的unigene序列与Nr(NCBI非冗余蛋白数据库)、Nt(NCBI核苷酸数据库)、Swiss-Prot蛋白质数据库、Pfam蛋白质数据库、COG/KOG、GO、KEGG数据库进行比对,获得unigene的注释信息。
1.5 qRT-PCR验证
随机挑选26个差异表达基因,利用软件Primer 5进行引物设计。根据SYBR Green Dye(Takara, Dalian, China)试剂盒进行荧光定量PCR反应,每个反应重复3次。用GAPDH(Zhangetal., 2015)作为内参基因,采用2-ΔΔCt方法(Livaketal., 2001)计算每个基因表达量的变化。
1.6 差异表达基因的识别与富集分析
利用Trapnell等(2010)的方法计算每个unigene的FPKM(每百万片段中比对到某一基因每千碱基长度的片段数目,fragments per transcript kilobase per million fragments mapped)值,作为衡量unigene表达量的标准。利用DESeq R软件包(Anders, 2010)分析XY/CY和XH/CH中unigene表达量的差异,显著性检验采用校正后的P值(Storeyetal., 2003)。当检验结果的P值小于0.05时,就认为这个unigene是差异表达基因。利用软件GOseq(Youngetal., 2010)和KOBAS(Maoetal., 2005)对差异基因进行功能富集分析。
2 结果与分析
2.1 测序结果及数据拼接
利用Illumina Hiseq 2500平台对8个cDNA文库进行了高通量测序,去掉接头序列及低质量序列后,分别得到了119 494 172(雄花芽,XY)、115 958 434(雌花芽,CY)、121 730 470(小孢子叶球,XH)、116 504 860(大孢子叶球,CH)条高质量序列。所有原始测序数据均已上传到NCBI Sequence Read Archive (SRA)数据库,登录号分别为SRR2147720(XH),SRR2147715(CH),SRR2147717(CY),SRR2147721(XY)。将所有高质量序列混合后采用软件Trinity进行数据拼接,最终共获得108 307条unigene。unigene的平均长度为796 bp,N50为1 648 bp,其中长度大于1 000 bp的unigene有23 624条,占全部unigene的21.81%。
2.2 qRT-PCR验证
利用qRT-PCR对随机挑选的26个差异表达基因在XY,CY,XH和CH中的表达量进行验证,从图1可以看出,RNA-Seq结果与qRT-PCR结果具有很高的相关性(R2> 0.9),表明RNA-Seq方法准确反映了基因在不同器官中表达水平的变化。
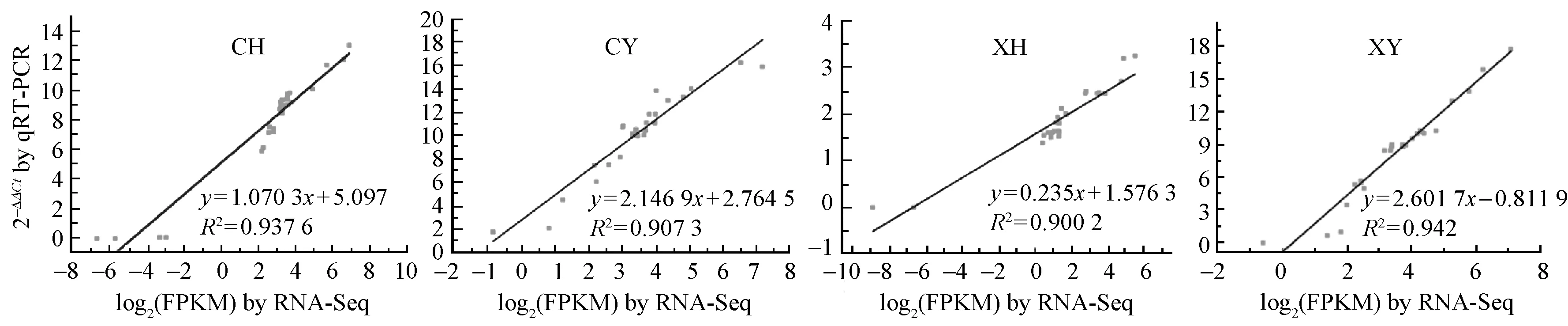
图1 26个差异表达基因RNA-Seq与qRT-PCR表达量结果的相关性Fig.1 Correlation of expression levels of 26 differentially expressed genes measured by RNA-Seq and qRT-PCRCH: 大孢子叶球; CY: 雌花芽; XH: 小孢子叶球; XY: 雄花芽; FPKM: 每百万片段中比对到某一基因每千碱基长度的片段数目。CH: Ovulate strobilus; CY: Female bud; XH: Staminate strobilus; XY: Male bud; FPKM: Fragments per transcript kilobase per million fragments mapped.
2.3 功能注释
使用BLAST系列软件将unigene序列与Nr,Nt,Swiss-Prot,Pfam,COG/KOG,GO,KEGG数据库进行比对,获得unigene的注释信息。从表1可以看出,6 347条unigene(5.86%)在所有数据库中都获得了注释信息,有51 953条(47.97%)在至少1个数据库中获得了注释信息,在Nr和SwissProt数据库中得到注释信息的unigene数量最多,而在KEGG和COG/KOG数据库中得到注释信息的unigene数量相对偏少。unigene在GO和KEGG数据库中注释结果见图2和图3。
2.4 差异表达基因分析
为了能够确定参与银杏性别决定过程的基因,利用软件DESeq对XY/CY和XH/CH中unigene的表达量进行了比较。结果表明,有4 709条unigene在XY/CY中差异表达,其中2 235条unigene在XY中上调表达而有2 474条unigene下调表达; 有9 802条unigene在XH/CH中差异表达,其中5 849条unigene在XH中上调表达而3 953条unigene下调表达。
对差异表达的unigene进行GO富集分析,结果表明XY/CY中的4 709条差异表达基因可以划分为36个类别,其中代谢过程(GO: 0008152,2 154个unigenes)和细胞代谢过程(GO: 0044237,1 678个unigenes)所占比例最大; XH/CH中的9 802条差异表达基因可以划分为18个类别,其中细胞组分合成(GO: 0044085,427个unigenes)和核糖核蛋白复合体合成(GO: 0022613,272个unigenes)所占比例最大。差异表达基因的KEGG代谢通路富集分析结果表明在XH/CH中,核糖体(143个unigenes)、淀粉和蔗糖代谢(97个unigenes)、植物激素信号转导(76个unigenes)所占比例最大; 在XY/CY中,核糖体(190个unigenes)和苯丙素生物合成(33条unigenes)所占比例最大。在76个参与植物激素信号转导的差异表达基因中,有11个基因在XY/CY和XH/CH中共同差异表达(表2)。这些基因可能在银杏性别决定中发挥着重要的作用。

表1 unigene的功能注释结果Tab. 1 Summary of functional annotation of the unigene

图2 unigene的GO功能注释Fig.2 GO functional classification of the unigene生物过程 A: 生物附着; B: 生物调控; C: 细胞死亡; D: 细胞成分和生物合成; E: 细胞过程; F: 发育过程; G: 生长; H: 免疫系统过程; I: 定位; J: 移动; K: 新陈代谢过程; L: 多细胞生物过程; M: 多机体过程; N: 负调控生物过程; O: 正调控生物过程; P: 生物过程调节; Q: 再生; R: 再生过程; S: 应激反应; T: 信号传导; U: 单机体过程。细胞组成 A: 细胞; B: 细胞部分; C: 细胞外基质; D: 细胞外基质分化; E: 细胞外区域; F: 细胞外区域分化; G: 大分子复合物; H: 膜; I: 膜封闭腔; J: 膜分化; K: 细胞器; L: 细胞器分化; M: 病毒体; N: 病毒体分化。分子功能 A: 抗氧化活性; B: 结合; C: 催化活性; D: 引导调控活性; E: 酶调控活性; F: 分子转导活性; G: 核酸结合的转录因子活性; H: 蛋白质结合的转录因子活性; I: 受体活性; J: 结构分子活性; K: 转运活性。
Biological process A: Biological adhesion; B: Biological regulation; C: Cell killing; D: Cellular component organization or biogenesis; E: Cellular process; F: Developmental process; G: Growth; H: Immune system process; I: Localization; J: Locomotion; K: Metabolic process; L: Multicellular organismal process; M: Multi-organism process; N: Negative regulation of biological process; O: Positive regulation of biological process; P: Regulation of biological process; Q: Reproduction; R: Reproductive process; S: Response to stimulus; T: Signaling; U: Single-organism process. Cellular component A: Cell; B: Cell part; C: Extracellular matrix; D: Extracellular matrix part; E: Extracellular region; F: Extracellular region part; G: Macromolecular complex; H: Membrane; I: Membrane-enclosed lumen; J: Membrane part; K: Organelle; L:Organelle part; M: Virion; N: Virion part. Molecular function A: Antioxidant activity; B: Binding; C: Catalytic activity; D: Channel regulator activity; E: Enzyme regulator activity; F: Molecular transducer activity; G: Nucleic acid binding transcription factor activity; H: Protein binding transcription factor activity; I: Receptor activity; J: Structural molecular activity; K: Transporter activity.
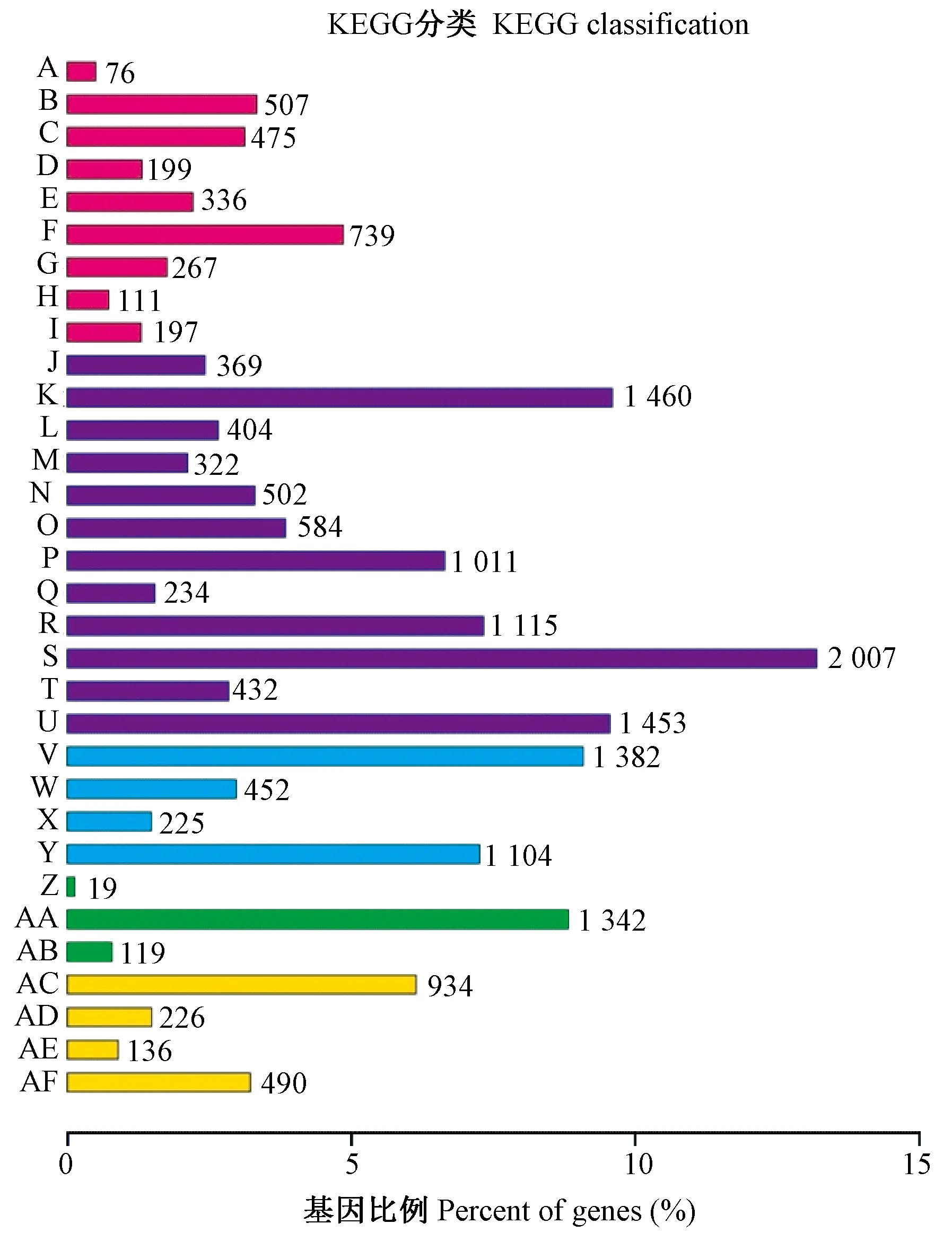
图3 unigene的KEGG功能注释结果Fig.3 KEGG pathway prediction of the unigene图中数字表示基因数目。A: 感觉系统; B: 神经系统; C: 免疫系统; D: 排泄系统; E: 环境适应; F: 内分泌系统; G: 消化系统; H: 发育; I: 循环系统; J: 生物降解与合成; K: 概观; L: 核苷酸代谢; M: 萜类和聚酮化合物代谢; N: 其他种类氨基酸代谢; O: 辅酶因子和维生素合成; P: 类脂物代谢; Q: 聚糖代谢合成; R: 能量代谢; S: 碳水化合物代谢; T: 其他次生代谢物质代谢; U: 氨基酸代谢; V: 翻译; W: 转录; X: 复制和修复; Y: 折叠、排序、降解; Z: 信号分子互作; AA: 信号转导; AB: 膜运输; AC: 运输分解; AD: 细胞共同体; AE: 细胞运动; AF: 细胞生长与死亡。
Numbers indicate the number of genes.A: Sensory system; B: Nervous system; C: Immune system; D: Excretory system; E: Environmental adaption; F: Endocrine system; G: Digestive system; H: Development; I: Circulatory system; J: Xenobiotics biodegradation and metabolism; K: Overview; L: Nucleotide metabolism; M: Metabolism of terpenoids and polyketides; N: Metabolism of other amino acid; O: Metabolism of cofactors and vitamins; P: Lipid metabolism; Q: Glycan biosynthesis and metabolism; R: Energy metabolism; S: Carbohydrate metabolism; T: Biosynthesis of other secondary metabolites; U: Amino acid metabolism; V: Translation; W: Transcription; X: Replication and repair; Y: Folding, sorting and degradation; Z: Signaling molecules interaction; AA: Signal transduction; AB: Membrane transport; AC: Transport and catabolism; AD: Cellular community; AE: Cell motility; AF: Cell growth and death.
3 讨论
植物的性别决定涉及到复杂的调控网络以及在不同发育阶段差异或特异表达的功能基因(Aryaletal., 2014)。有研究表明参与花发育的功能基因(如ABC类基因)并不是性别决定基因(Ainsworthetal., 1995; Hardenacketal., 1994),而参与植物激素合成与信号转导的基因在植物性别决定中发挥着重要的作用(Aryaletal., 2014; Guoetal., 2010)。从表2中可以看到,2个负调控ABA信号转导的基因PP2C(proteinphosphatase2C)和PYL(abscisicacidreceptor2)在雄芽(XY)和小孢子叶球(XH)中下调表达,而正调控ABA信号转导的基因SNRK2(SNF1-relatedproteinkinasesubfamily2)在XY和XH中上调表达。在大麦(Hordeumvulgare)中,反义表达SNRK2基因会导致花粉败育,从而引起雄性不育(Zhangetal., 2001)。由此可以推测,参与ABA信号转导的基因可能在银杏雄性性别决定中发挥作用(Fujiietal., 2009; Parketal., 2009)。生长素诱导基因SAUR(smallauxinupRNA)和生长素应答基因GH3(GretchenHagen3)在XY和XH中分别下调和上调表达,说明参与生长素信号转导的基因在银杏性别决定中发挥的作用有一定的差异,这与Kong等(2013)对拟南芥(Arabidopsisthaliana)的研究结果一致。在XY和XH中,参与茉莉酸信号转导的基因COI1(coronatineinsensitive1)上调表达。拟南芥COI1突变体呈现出不同程度的雄性不育(Ellisetal., 2002; Turneretal., 2002),这说明茉莉酸在银杏雄性性别决定和育性发育方面也有重要作用。参与水杨酸信号转导的基因NPR1(nonexpressorofPR)在XY和XH中上调表达,但是这个基因的上调表达可能只与银杏雄株的抗性相关,而与性别决定的关系不大(Mouetal., 2003)。参与赤霉素信号转导的转录因子DELLA蛋白和参与乙烯信号转导的转录因子EIN3(ethylene-insensitiveprotein3)在XY和XH中上调表达。有研究表明DELLA蛋白D8在玉米(Zeamays)的性别决定中发挥重要的作用(Pengetal., 1999); 黄瓜中参与乙烯生物合成与信号转导,以及乙烯诱导表达的大量基因都在性别决定中发挥重要的作用(Boualem, 2009; Wuetal., 2010); 拟南芥EIN3突变体中乙烯信号转导受阻并且雄性不育(Solanoetal., 1998)。因此可以推测乙烯在银杏性别决定中同样发挥一定的作用。
银杏的性染色体为ZW型,雄性性染色体为ZZ而雌性为ZW(Lanetal., 2008)。杨树的性染色体组成同样为ZW型,第19号染色体可能是杨树的性染色体(Yinetal., 2008),Song等(2013)研究发现2个参与DNA甲基化的基因定位到毛白杨性染色体上的性别决定区域。DNA甲基化对植物的性别决定起到重要的调控作用(Hultquistetal., 2008;
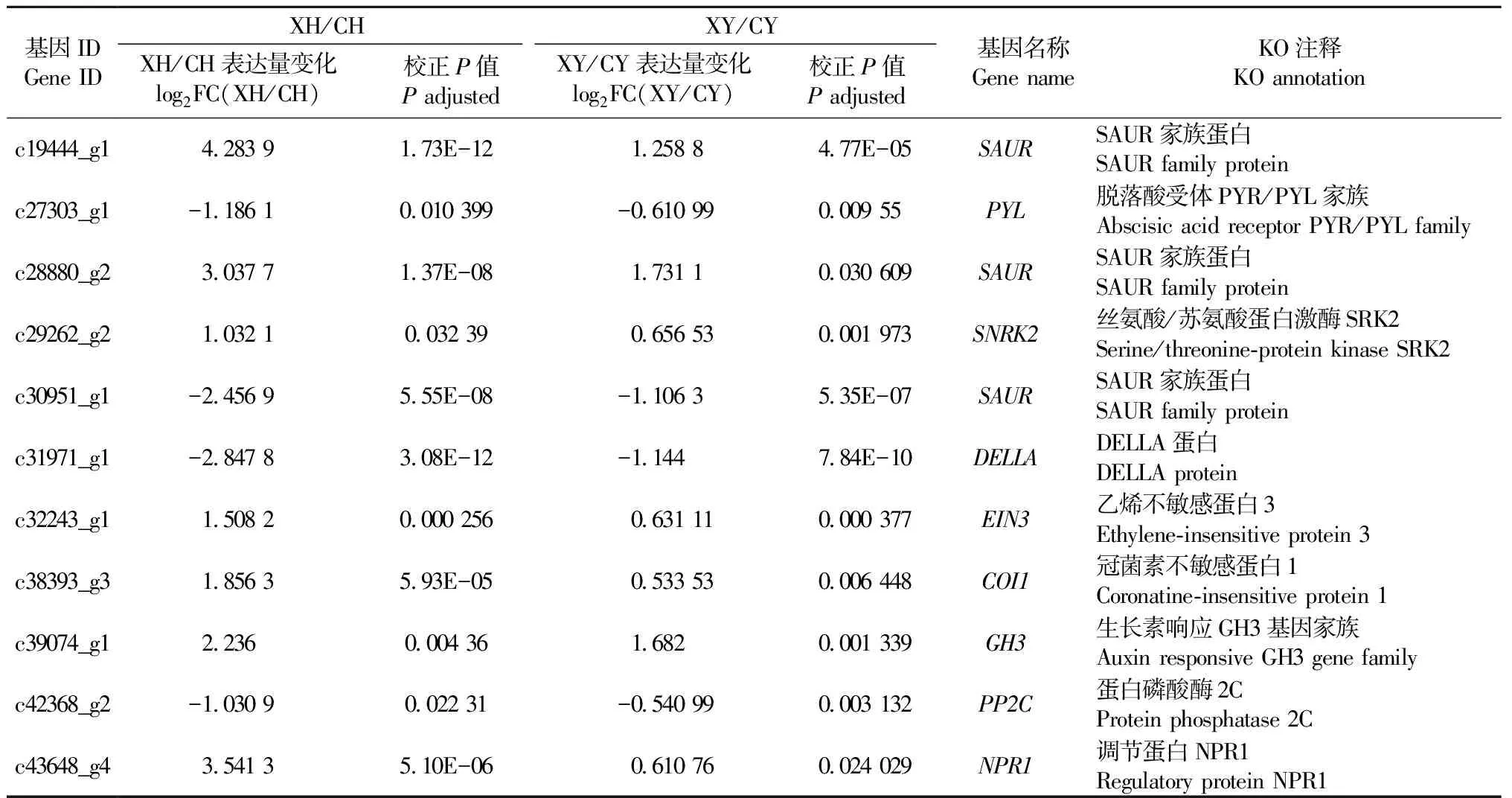
表2 在雄花芽(XY)/雌花芽(CY)和小孢子叶球(XH)/大孢子叶球(CH)中共同差异表达的11个基因①Tab. 2 The 11 commonly differentially expressed genes in the male bud(XY) vs. female bud(CY) and staminate strobilus(XH) vs. ovulate strobilus(CH) comparisons
①log2FC: log2(foldchange).
Janoušeketal., 1996; Martinetal., 2009; Parkinsonetal., 2007)。本次研究中在雌芽(CY)和大孢子叶球(CH)中发现了参与DNA甲基化的特异表达基因,其中包括已经报道的参与植物性别决定的基因,如MET1和COMT1(Doetal., 2007; Schmidtetal., 2013)。另外,差异基因的GO富集分析表明,编码DNA甲基化转移酶的基因在CY和CH中均上调表达。这一结果与杨树中研究结果(Songetal., 2012)类似,CY和CH中DNA甲基化水平的上升可能有助于银杏雌性的分化与发育。
4 结论
本研究通过使用RNA-Seq技术对银杏雌、雄花芽和大、小孢子叶球进行转录组测序与生物信息学分析,发现11个参与植物激素信号转导的基因在雄芽/雌芽和小孢子叶球/大孢子叶球中共同差异表达,参与DNA甲基化的基因在雌芽和大孢子叶球中显著上调表达,这些基因的差异表达可能促进了银杏雌性或雄性的分化,从而在银杏的性别决定中发挥一定的作用。本研究表明银杏的性别决定涉及多种调控途径和功能基因,性别决定相关基因的筛选为全面理解银杏的性别决定机制奠定了基础。
韩晨静. 2011. 银杏与叶籽银杏胚珠发育的组织化学比较研究. 泰安: 山东农业大学硕士学位论文.
(Han C J. 2011. Comparative studies on histochemistry of the developmental ovule inGinkgobilobaL. andGinkgobilobavar.epiphyllaMak. Tai’an: MS thesis of Shandong Agricultural University. [in Chinese])
黄 茜, 刘霁瑶, 曹 敏, 等. 2013. 银杏性别特征表现与鉴别研究进展. 果树学报, 30(6): 1065-1071.
(Huang Q, Liu Q Y, Cao M,etal. 2013. Advance of gender characteristics expression and identification ofGinkgobiloba. Journal of Fruit Science, 30(6): 1065-1071. [in Chinese])
史继孔, 樊卫国, 文晓鹏. 1998. 银杏雌花芽形态分化的研究. 园艺学报, 25(1): 33-36.
(Shi J K, Fan W G, Wen X P. 1998. Female flower bud differentiation ofGinkgobiloba. Acta Horticulture Sinica, 25(1): 33-36. [in Chinese])
邢世岩, 张 倩, 付兆军, 等. 2013. 银杏垂乳个体发生及系统学意义. 林业科学, 49(8): 108-116.
(Xing S Y, Zhang Q, Fu Z J,etal. 2013. Ontogenesis and systematics implications ofGinkgobilobachichi. Scientia Silvae Sinicae, 49(8): 108-116. [in Chinese])
张万萍, 史继孔, 樊卫国, 等. 2001. 银杏雄花芽的形态分化. 园艺学报, 28(3): 255-258.
(Zhang W P, Shi J K, Fan W G,etal. 2001. Morphological differentiation of male flower ofGinkgobiloba. Acta Horticulture Sinica, 28(3): 255-258. [in Chinese])
Ainsworth C, Crossley S, Buchanan-Wollaston V,etal. 1995. Male and female flowers of the dioecious plant sorrel show different patterns of MADS Box gene expression. Plant Cell, 7(10): 1583-1598.
Anders S. 2010. Differential expression analysis for sequence count data. Genome Biology, 11(10): 79-82.
Aryal R, Ming R. 2014. Sex determination in flowering plants: papaya as a model system. Plant Science, 217: 56-62.
Boualem A. 2009. A conserved ethylene biosynthesis enzyme leads to andromonoecy in twoCucumisspecies. PloS One, 4(7): e6144.
Chang S J, Puryear J, Caimey J. 1993. A simple and efficient method for isolation RNA from pine trees. Plant Molecular Biology Reporter, 11(2): 113-116.
Charlesworth D. 2013. Plant sex chromosome evolution. Journal of Experimental Botany, 64(2): 405-420.
Do C T, Pollet B, Thévenin J,etal. 2007. Both caffeoyl coenzyme A 3-O-methyltransferase 1 and caffeic acid O-methyltransferase 1 are involved in redundant functions for lignin, flavonoids and sinapoyl malate biosynthesis inArabidopsis. Planta, 226(5): 1117-1129.
Ellis C, Turner J G. 2002. A conditionally fertileCOI1 allele indicates cross-talk between plant hormone signalling pathways inArabidopsisthalianaseeds and young seedlings. Planta, 215(4): 549-556.
Fujii H, Zhu J K. 2009.Arabidopsismutant deficient in 3 abscisic acid-activated protein kinases reveals critical roles in growth, reproduction, and stress. Proceedings of the National Academy of Sciences, 106(20): 8380-8385.
Grabherr M G, Haas B J, Yassour M,etal. 2011. Full-length transcriptome assembly from RNA-Seq data without a reference genome. Nature Biotechnology, 29(7): 644-652.
Guo S, Zheng Y, Joung J G,etal. 2010. Transcriptome sequencing and comparative analysis of cucumber flowers with different sex types. BMC Genomics, 11(1): 384-395.
Hardenack S, Ye D, Saedler H,etal. 1994. Comparison of MADS box gene expression in developing male and female flowers of the dioecious plant white campion. Plant Cell, 6(12): 1775-1787.
Hultquist J, Dorweiler J. 2008. Feminized tassels of maizemop1 andts1 mutants exhibit altered levels of miR156 and specific SBP-box genes. Planta, 229(1): 99-113.
Kong Y, Zhu Y, Gao C,etal. 2013. Tissue-specific expression ofSMALLAUXINUPRNA41 differentially regulates cell expansion and root meristem patterning inArabidopsis. Plant & Cell Physiology, 54(4): 609-621.
Lan T, Chen R, Li X,etal. 2008. Microdissection and painting of the W chromosome inGinkgobilobashowed different labelling patterns. Bot Studies, 49: 33-37.
Liu J, Yin T, Ye N,etal. 2013. Transcriptome analysis of the differentially expressed genes in the male and female shrub willows (Salixsuchowensis). PloS One, 8(4): e60181.
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod. Methods, 25(4): 402-408.
Mao X, Tao C, Wei L. 2005. Automated genome annotation and pathway identification using the KEGG Orthology (KO) as a controlled vocabulary. Bioinformatics, 21(19): 3787-3793.
Martin A, Troadec C, Boualem A,etal. 2009. A transposon-induced epigenetic change leads to sex determination in melon. Nature, 461(7267): 1135-1138.
Mou Z, Fan W, Dong X. 2003. Inducers of plant systemic acquired resistance regulate NPR1 function through redox changes. Cell, 113(7): 935-944.
Park S Y, Fung P, Nishimura N,etal. 2009. Abscisic acid inhibits type 2C protein phosphatases via the PYR/PYL family of START proteins. Science, 324(5930): 1068-1071.
Parkinson S E, Gross S M, Hollick J B. 2007. Maize sex determination and abaxial leaf fates are canalized by a factor that maintains repressed epigenetic states. Developmental Biology, 308(2): 462-473.
Peng J, Richards D E, Hartley N M,etal. 1999. ‘Green revolution’ genes encode mutant gibberellin response modulators. Nature, 400(6741): 256-261.
Schmidt A, Wohrmann H J P, Raissig M T,etal. 2013. The polycomb group protein MEDEA and the DNA methyltransferase MET1 interact to repress autonomous endosperm development inArabidopsis. Plant Journal, 73(5): 776-787.
Solano R, Stepanova A, Chao Q,etal. 1998. Nuclear events in ethylene signaling: a transcriptional cascade mediated byETHYLENE-INSENSITIVE3 andETHYLENE-RESPONSE-FACTOR1. Genes & Development, 12(23): 3703-3714.
Song Y, Ma K, Bo W,etal. 2012. Sex-specific DNA methylation and gene expression in andromonoecious poplar. Plant Cell Reports, 31(8): 1393-1405.
Song Y, Ma K, Ci D,etal. 2013. Sexual dimorphic floral development in dioecious plants revealed by transcriptome, phytohormone, and DNA methylation analysis inPopulustomentosa. Plant Molecular Biology, 83(6): 559-576.
Storey J D, Tibshirani R. 2003. Statistical significance for genomewide studies. Proceedings of the National Academy of Sciences, 100(16): 9440-9445.
Trapnell C, Williams B A, Pertea G,etal. 2010. Transcript assembly and quantification by RNA-Seq reveals unannotated transcripts and isoform switching during cell differentiation. Nature Biotechnology, 28(5): 511-515.
Turner J G, Ellis C, Devoto A. 2002. The jasmonate signal pathway. Plant Cell, 14(1): 153-164.
Wang Z, Gerstein M, Snyder M. 2009. RNA-Seq: a revolutionary tool for transcriptomics. Nature Reviews Genetics, 10(1): 57-63.
Wu T, Qin Z, Zhou X,etal. 2010. Transcriptome profile analysis of floral sex determination in cucumber. Journal of Plant Physiology, 167(11): 905-913.
Yin T, DiFazio S P, Gunter L E,etal. 2008. Genome structure and emerging evidence of an incipient sex chromosome inPopulus. Genome Research, 18(3): 422-430.
Young M D, Wakefield M J, Smyth G K,etal. 2010. Gene ontology analysis for RNA-seq: accounting for selection bias. Genome Biology, 11(2): R14.
Zhang Q, Li J, Sang Y,etal. 2015. Identification and characterization of microRNAs inGinkgobilobavar.epiphyllaMak. PloS One, 10(5): e0127184.
Zhang Y, Shewry P R, Jones H,etal. 2001. Expression of antisense SnRK1 protein kinase sequence causes abnormal pollen development and male sterility in transgenic barley. Plant Journal, 28(4): 431-441.
(责任编辑 徐 红)
Screening of Sex Determination Related Genes inGinkgobiloba
Tang Haixia1Du Shuhui1, 2Xing Shiyan1Sang Yalin1Li Jihong1Liu Xiaojing1Sun Limin1
(1.KeyLaboratoryofSilvicultureofShandongProvinceCollegeofForestry,ShandongAgriculturalUniversityTai’an271000; 2.CollegeofForestry,ShanxiAgriculturalUniversityTaigu030800)
【Objective】 In plants, sex determination is a comprehensive process of correlated events, which involves genes that are differentially or specially expressed in distinct developmental phases.Ginkgobilobais a typical dioecious gymnosperm species with high ecological and economical values. The morphological traits and growth habits are significantly different between mature female and male individuals. These differences are likely related to sex determination inG.biloba. In the present study, the screening of sex determination genes ofG.bilobawill lay a solid foundation for further exploring the mechanism of sex determination in this species. 【Method】We conducted RNA-sequencing of female and male buds (CY and XY) as well as ovulate strobilus and staminate strobilus (CH and XH) ofG.bilobafrom the same family to gain insights into the genes potentially related to sex determination in this species. The expression level of 26 randomly selected differentially expressed genes (DEGs) was tested using quantitative real-time PCR. 【Result】 Approximately 60 Gb of clean reads were obtained from eight cDNA libraries.Denovoassembly of the clean reads generated 108 307 unigenes with an average length of 796 bp. A high level of correlation was found between the RNA-Seq and qRT-PCR for the 26 randomly selected DEGs. Among these unigenes, 51 953 (47.97%) had at least one significant match with a gene sequence in one of the public protein and nucleotide databases. A total of 4 709 and 9 802 DEGs were identified in XYvs.CY and XHvs.CH, respectively. 11 commonly DEGs and transcription factors associated with plant hormone signal and transduction (such asPYL,SNRK2,EIN3 etc.) as well as genes encoding methyltransferase (e.g.MET1 andCOMT1) were assumed to involve in sex determination inG.biloba.【Conclusion】 The transcriptome resources generated allowed us to identify diverse functional genes that may be associated with sex determination inG.biloba. Our results laid a solid foundation for fully exploring the mechanism of sex determination inG.biloba.
Ginkgobiloba; sex determination; genes; RNA-Seq
10.11707/j.1001-7488.20170209
2016-01-29;
2016-04-12。
中国博士后科学基金面上项目(2015M582124)。
S718.46
A
1001-7488(2017)02-0076-07
* 邢世岩为通讯作者。

