两种流式单平台计数法测定移植术后患者外周血T淋巴细胞亚群的应用评价
翁泽兵,王玉飞,郝钦芳,马雪平,王莉
(武警总医院检验科,北京 100039)
两种流式单平台计数法测定移植术后患者外周血T淋巴细胞亚群的应用评价
翁泽兵,王玉飞,郝钦芳,马雪平,王莉
(武警总医院检验科,北京 100039)
目的 评价基于流量传感器的单平台计数法(简称体积法)与基于Trucount管的单平台计数法(简称Trucount法)对移植术后患者外周血T淋巴细胞计数的应用价值。方法 分别用Trucount法和体积法检测107例肝/肾移植术后患者外周血CD4+、CD8+、CD3+淋巴细胞绝对数和百分比,并对两种方法的检测结果进行配对t检验和线性回归分析。选取5例CD3+低值样本,考察体积法检测CD4+、CD8+、CD3+淋巴细胞绝对数的精密度。结果 Trucount法和体积法对移植术后患者外周血CD4+、CD4+/CD3+、CD8+、CD8+/CD3+、CD4+/CD8+检测结果之间差异无统计学意义(P均>0.05);线性回归系数均在0.9~1.1之间。CD3+T细胞≥40个/μL时,体积法检测结果的变异系数均<5.5%;当CD3+T细胞为20个/μL时,CD3+、CD4+和CD8+淋巴细胞的变异系数分别是5.19%、10.28%和6.48%。结论 基于流量传感器的单平台计数法对外周血T淋巴细胞计数具有较好的准确性和重复性,可用于对肝/肾移植患者移植术后机体免疫状态的监测。
T淋巴细胞;流式细胞术;移植;免疫排斥
通过检测移植术后患者T淋巴细胞亚群数量,可以客观、准确地反映患者的免疫水平,对预测和防止移植排斥反应的发生以及免疫抑制剂的合理使用都有很好的指导意义[1-3]。外周血T淋巴细胞亚群计数主要采用流式细胞检测方法。目前临床上常用的检测方法有2种。一种为采用血液分析仪和流式细胞仪双平台进行计数,这种方法在样本T淋巴细胞数量低的时候变异系数较大,因此不能满足移植患者术后监测的需要。另一种为单平台计数法,分为基于Trucount管的单平台计数法(简称Trucount法)和基于流量传感器的单平台计数法(简称体积法),前者用已知数量的荧光微粒做内参,计算样本T淋巴细胞亚群的百分比和绝对数,但是成本昂贵;后者通过对生物细胞或颗粒的多种特性进行分类、计数,同时根据样本体积计算得到淋巴细胞亚群的绝对数[4]。本研究对两种流式单平台计数法检测移植患者术后T淋巴细胞亚群的结果进行比较分析,并评价基于体积法对外周血T淋巴细胞计数的准确性和重复性。
1 材料与方法
1.1 标本来源 2016年4月至5月在武警总医院进行肝或肾移植术后常规随访的患者107例,其中男性92例,女性15例,年龄(47±13)岁。空腹采集EDTA-K2抗凝静脉血3 mL。
1.2 仪器和试剂 BriCyte E6流式细胞仪(深圳迈瑞公司)、FACS Calibur流式细胞仪(美国BD公司)。CD4-FITC/CD8-PE/CD3-PerCP抗体、Flow-Count标准荧光微粒、FACS溶血素(X10)和含有已知数量标准荧光微粒的绝对计数管(Trucount 管)均为美国BD公司产品。
1.3 流式细胞分析
1.3.1 质控和校准 Trucount法采用BD公司配套质控品,严格按照FACSComp软件进行仪器质控;体积法采用迈瑞公司提供的专用多色质控微球,通过MRFlow软件自动完成对仪器的质量控制。
1.3.2 标本处理 分别标记好BriCyte E6流式细胞仪配套流式检测管(或Trucount管),各检测管内分别加入CD4-FITC/CD8-PE/CD3-PerCP抗体20 μL和静脉血50 μL,轻微震荡混匀,室温避光放置15 min;各检测管加入10倍稀释后的溶血素450 μL,轻微震荡混匀,室温避光放置15 min,待红细胞充分裂解后,涡旋混匀,分别上机检测。
1.3.3 计数方法 Trucount法:应用MultiSET软件自动分析,必要时辅以手动设门,分别获得CD4+、CD8+、CD3+淋巴细胞的绝对数和百分比。公式如下:T细胞绝对计数(个/μL)=(T细胞获取数/微粒获取数)×(Trucount管的微粒总量/50 μL全血)。体积法:应用MRFlow软件自动分析,必要时辅以手动设门,分别获得CD4+、CD8+、CD3+淋巴细胞的绝对数和百分比。公式如下:T细胞绝对计数(个/μL)=[T细胞获取数/样本获取体积(μL)]×(520 μL样本制备总量/50 μL全血)。

2 结果
2.1 两种流式方法检验外周血T淋巴细胞亚群绝对数和比值的比较 对Trucount法和体积法检测107例移植术后患者的CD4+、CD4+/CD3+、CD8+、CD8+/CD3+、CD4+/CD8+结果进行配对t检验,结果显示各项结果之间差异无统计学意义。见表1。
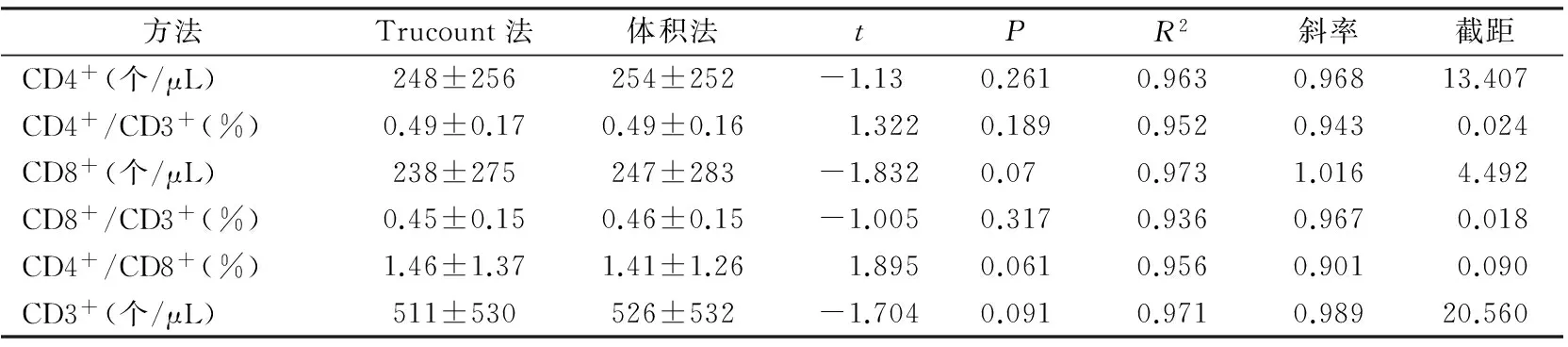
表1 Trucount法和体积法检测107例患者淋巴细胞亚群绝对数及比值结果
2.2 两种流式方法的线性回归分析 Trucount法和体积法检测107例外周血CD4+、CD4+/CD3+、CD8+、CD8+/CD3+、CD4+/CD8+、CD3+所得结果的线性回归分析见表1。结果显示两种流式方法的决定系数R2分别为0.963、0.952、0.973、0.936、0.956、0.971,斜率均在0.9~1.1之间。
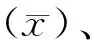

表2 体积法检测Trucount 法CD3+低值样本T淋巴细胞亚群绝对计数的变异系数(%)
3 讨论
T淋巴细胞介导的排斥反应是器官移植术后最主要的免疫排斥反应,T淋巴细胞亚群检测是评估肝/肾移植患者机体免疫状态的常用方法[5]。临床医生通过监测移植患者外周血CD4+、CD8+T淋巴细胞数量及百分比来寻找免疫抑制的平衡点,避免免疫抑制过度或者免疫抑制不足,从而维持移植患者最合适的免疫状态[6]。流式细胞计数具有快速、定量以及同时检测CD4+、CD8+T淋巴细胞等特点,现已被广泛应用于临床的外周血T淋巴细胞计数。
本研究分别用Trucount法和体积法对107例肝/肾移植术后常规随访患者的外周血T淋巴细胞亚群绝对计数及百分比进行了检测,结果显示两种流式计数方法的检测结果均有很好的相关性,决定系数R2除CD8+/CD3+(R2=0.936)均大于0.95,与王维维等[7]对迈瑞BriCyte E6流式细胞仪和Beckman Coulter FC500流式细胞仪之间比较时CD8+T淋巴细胞百分比发生明显偏倚的结果相符。鉴于在多种流式细胞仪间发现CD8+T淋巴细胞百分比偏倚稍大,由此我们推测导致这种情况的原因可能是由抗体种类、抗体制备等检测前的某种或某些因素引起。
对于肝/肾移植术后长期大量服用免疫抑制剂的部分患者,其T淋巴细胞的绝对计数较低,准确检测T淋巴细胞数量对于观察其免疫状态非常重要。同时,对于一种新型流式细胞检测方法来说,能够使检测下限更低且准确性好、精密度高,更能体现该检测方法的优越性。基于以上两点,本研究用体积法对5例Trucount法CD3+T淋巴细胞低值标本进行重复检测,结果显示Trucount法CD3+T淋巴细胞为20个/μL时,CD3+、CD4+和CD8+淋巴细胞的变异系数(分别为5.19%、10.28%和6.48%)均较CD3+T淋巴细胞≥40个/μL时的变异系数升高明显。这是由于随着细胞浓度的降低,而总体进样量没有增加,总收集数量减少所致。如果希望CD3+T淋巴细胞在20个/μL检测水平有更好稳定性,可通过增加进样量进行改善。
总之,我们的研究结果表明,基于流量传感器的单平台计数法对外周血T淋巴细胞计数具有较好的准确性和重复性,可用于监测肝/肾移植患者移植术后机体的免疫状态。
[1]顾凤娟, 刘新华, 热衣汗·西里普, 等.肾移植患者急性排斥反应中T淋巴细胞亚群的作用研究[J]. 中华临床医师杂志,2015,9(21):3880-3882.
[2]Fernández-RuizM, López-MedranoF, AllendeLM,etal. Kinetics of peripheral blood lymphocyte subpopulations predicts the occurrence of opportunistic infection after kidney transplantation[J]. Transpl Int, 2014, 27(7):674-685.
[3]高钰,肖漓,何秀云,等. 肾移植术后淋巴细胞亚群的变化与移植肾功能恢复状况分析[J].解放军医药杂志,2015,27(7):6-9.
[4]Sack U, Tárnok A, Rothe G,etal. Cellular diagnostics: basic principles, methods and clinical applications of flow cytometry[M]. Basel: Karger, 2009.
[5]Macedo C, Walters JT, Orkis EA,etal. Long-term effects of alemtuzumab on regulatory and memory T-cell subsets in kidney transplantation[J].Transplantation, 2012, 93(8):813-821.
[6]孙煦勇,秦科,农江,等.肝肾联合移植术后T细胞亚群变化及其共刺激分子的表达[J].中华实验外科杂志,2012,29(10):1934-1937.
[7]王维维, 奚迪, 袁向亮,等. 不同流式细胞分析仪检测淋巴细胞亚群的比较研究[J]. 中华检验医学杂志,2016, 39(5): 361-365.
(本文编辑:刘群)
Application evaluation of the determination of T-lymphocyte subsets in peripheral blood of patients after transplantation by two kinds of single-platform flow cytometric methods
WENGZe-bing,WANGYu-fei,HAOQin-fang,MAXue-ping,WANGLi
(DepartmentofLaboratoryMedicine,GeneralHospitalofChinesePeople'sArmedPoliceForces,Beijing100039,China)
Objective To evaluate the application values of two kinds of single-platform flow cytometric methods, the Volumetric method based on flow sensor and the Trucount method based on Trucount beads, in the counts of T-lymphocyte subsets in peripheral blood of patients after transplantation. Methods The absolute number and percentage of CD4+, CD8+, and CD3+T cells in peripheral blood samples from 107 patients after liver or renal transplantation were determined by the Trucount method and the Volumetric method, respectively, and their results were compared using paired t-test and linear regression analysis. Five samples with low CD3+counts were selected and the precisions of the absolute number of CD4+, CD8+and CD3+T cells detected by the Volumetric method were evaluated. Results There was no significant difference in the levels of CD4+, CD4+/CD3+, CD8+, CD8+/CD3+, and CD4+/CD8+in peripheral blood between the Trucount method and the Volumetric method (P>0.05), and the linear regression coefficients between them were from 0.9 to 1.1. When the concentration of CD3+was equal or more than 40/μL, the coefficients of variation (CVs) were below 5.5% for the Volumetric method. When the concentration of CD3+was 20/μL, theCVs of CD3+, CD4+, and CD8+were 5.19%, 10.28% and 6.48%, respectively. Conclusion The single-platform method based on flow sensor is accurate and reproducible for counting T-lymphocyte subsets in peripheral blood, which may be used to monitor the immune state of the patients after liver or renal transplantation.
T-lymphocyte; flow cytometry; transplantation; immunologic rejection
10.13602/j.cnki.jcls.2017.01.10
翁泽兵,1982年生,男,主管技师,大学本科,主要从事免疫及分子生物学研究。
王莉,副主任技师,大学本科,E-mail:wanglilsl@163.com。
R446.6
A
2016-11-23)

