贵州主栽蓝莓品种活性成分及其抗氧化活性评价
谢国芳,王新华,王瑞,金传绪,周笑犁,刘志刚,郑雄
(贵阳学院 食品与制药工程学院,贵州省果品加工工程技术研究中心,贵州 贵阳,550005)
贵州主栽蓝莓品种活性成分及其抗氧化活性评价
谢国芳*,王新华,王瑞,金传绪,周笑犁,刘志刚,郑雄
(贵阳学院 食品与制药工程学院,贵州省果品加工工程技术研究中心,贵州 贵阳,550005)
为了解贵州主栽蓝莓品种果实中活性成分含量及其综合抗氧化活性,以贵州规模化种植的粉蓝、圆蓝、巴尔德温和灿烂为试材,测定其9种酚类组分含量、多酚、总黄酮、花色苷,并用FRAP法、总还原力(TRAP)、DPPH法和ABTS法开展体外抗氧化活性评价,采用皮尔森相关性分析对4个品种各项指标进行分析。结果显示:没食子酸、表儿茶素、芦丁、p-香豆酸、槲皮素、儿茶素、鞣花酸、绿原酸、阿魏酸是供试蓝莓果实中的酚类成分较高,4个品种蓝莓果实中活性成分含量差异显著(P<0.05),粉蓝中没食子酸、阿魏酸和总黄酮含量最高,圆蓝中绿原酸、鞣花酸和芦丁含量最高,巴尔德温中槲皮素和花色苷含量最高,灿烂果实中儿茶素、表儿茶素、p-香豆酸和总酚含量最高;4个品种蓝莓果实的抗氧化活性差异显著(P<0.05),灿烂的抗氧化活性指数最高;蓝莓果实中不同活性成分对抗氧化活性差异显著(P<0.05),绿原酸含量对FRAP值具有较强贡献,阿魏酸、多酚和总黄酮含量对TRAP值的贡献极强,没食子酸含量对DPPH值的贡献极强,花色苷含量对ABTS值的贡献较强,抗氧化活性指数(ACI)与表儿茶素和p-香豆酸含量呈现极其显著的正相关(P<0.01)。
蓝莓;活性成分;抗氧化活性;相关性分析
蓝莓又名越橘,富含花色苷、黄酮类化合物,低糖、低脂肪,具有改善视力、提高免疫力和抗氧化等功效[1-3]。 2000年贵州省黔东南州共引入蓝莓4大类30多个品种,现已筛出‘圆蓝’、‘顶峰’、‘芭尔德温’、‘梯夫蓝’、‘灿烂’、‘粉蓝’、‘杰兔’、‘S13’等8个蓝莓品种进行规模化种植[4]。前期研究及文献显示,蓝莓果实中酚类物质含量显著高于花色苷含量,其不同品种和产地对总酚含量影响较大[5-10],目前,国内外对蓝莓的花色苷的提取、纯化、稳定性、功效及其开发应用等方面报道较为全面[11~15],而酚类物质的研究仍以总酚、粗提取及其抗氧化活性研究为主,仅DASTMALCHI等、PERTUZATTI等及刘翼翔等对蓝莓果实中酚类组分及其抗氧化活性进行分析[16~18],发现不同区域和品种果实中酚类组分差异明显,尚无贵州引种蓝莓果实酚类组分的相关报道。本文以贵州省黔东南州规模化种植的粉蓝、圆蓝、巴尔德温和灿烂4个蓝莓品种为试验材料,对总酚、总黄酮及其9种酚类组成成分进行分析,使用DPPH法、ABTS法、FRAP法和总还原力开展体外抗氧化活性评价。
1 材料与方法
1.1 材料与试剂
以种植10年树龄蓝莓为实验树,种植均按照黔东南州《蓝莓栽培与管理技术》实施,2015年7月14日在麻江县龙奔蓝莓种植基地采摘粉蓝、圆蓝、巴尔德温和灿烂4个品种蓝莓果实,采摘完全成熟(果实呈现深蓝色)、大小均匀的果实;具体按照GB/T 8855—2008 《新鲜水果和蔬菜 取样方法》,采摘后以125 g/盒分装于PE保鲜盒中,贮藏于4 ℃采样箱中,运回贵州省果品加工工程技术研究中心实验室,保留于-70 ℃超低温冰箱。
没食子酸(99%)、表儿茶素(≥98.0%)、p-香豆酸(≥99.0%)、槲皮素(≥98.5%)、儿茶素(≥95.0%)、鞣花酸(≥96.0%)、绿原酸(≥98.0%)、阿魏酸(≥99.5%)、甲醇(色谱纯)、三氟乙酸(≥99.5%,色谱纯),上海阿拉丁生化科技股份有限公司(中国上海);DPPH、TPTZ、ABTS、Gallic Acid、Rutin(99.0%)、Trolox(99.0%),美国Sigma公司;其他分析剂均为国产分析纯。
1.2 仪器与设备
LC-20A高效液相色谱仪,日本岛津公司;UV-2550型紫外分光光度计,日本岛津公司;超声清洗器( KQ5200DE),昆山市超声仪器有限公司;IKA A11研磨机,IKA公司(德国);C18色谱柱(250mm x 4.6mm,5 μm),Waters公司(中国上海)。
1.3 实验方法
1.3.1 酚类成分提取
参考白鸽等[19]的方法并作适当修改。称取10 g冻果研磨成浆,取2 g果浆装入10 mL离心管中,加入4.0 mL体积分数为70% 甲醇溶液,50 ℃超声波辅助提取30 min,冷却后10 000 r/min离心15 min,将上清液过滤到10 mL的容量瓶中,加入3 mL体积分数为70%甲醇溶液于残渣中再提取30 min,在4 ℃、12 000 r/min离心10 min,合并上清液,用体积分数为70%甲醇溶液定容,用0.45 μm的滤膜过滤后待测,取1.0 mL转移至进样瓶中等待进样,每个样品3次重复。
1.3.2 花色苷、总酚和总黄酮含量测定
花色苷含量测定:采用pH示差法测定,以100 g鲜样中所含矢车菊素-3-葡萄糖苷量(mg)表示[20];多酚含量:采用福林-酚比色法测定[21],以1 g鲜样所含没食子酸当量(mg)表示,即mg GAE/g;总黄酮采用比色法,以1 g鲜样中所含芦丁当量(mg)表示,即mg RE/g[22]。
1.3.3 色谱条件
准确称取 9种酚类物质标准品各10.00 mg,用甲醇溶解并定容至10.00 mL,配制成1.00 mg/mL的酚类物质标准品贮备液,保存于-20 ℃备用。
C18色谱柱(250 mm×4.6 mm,5 μm),溶液A(甲醇)和溶液B(0.3% 三氟乙酸),利用溶液B进行线性梯度洗脱:0~5 min,88%B;5~10 min,88%~75%B;10~15 min,75%B;15~20 min,75%~70%B;20~25 min,70%B;25~35 min,70%~65%B;35~40 min,65%B;40~50 min,50%B;50~60 min,88%B。柱温:30 ℃;流动相速率:0.8 mL/min;进样量10 μL;检测器:紫外检测器;波长:258 nm和280 nm。
1.3.4 抗氧化活性测定
抗氧化能力(FRAP)参照TODOROVIC等的方法,以100 g鲜样中所含当量Trolox(mmol)的清除能力表示,即mmol TE/g[23];DPPH自由基清除能力参照TAUCHEN等的方法,以100 g鲜样中所含当量Trolox的清除能力(mmol)表示,即mmol TE/g[24];总还原力参照OLIVEIRA等的方法,以100 g鲜样中所含当量Trolox的清除能力(mmol)表示即mmol TE/g[25];ABTS自由基清除能力参照SCHAICH等的方法,以100 g鲜样中所含当量Trolox的清除能力(mmol)表示,即mmol TE/g[23]。
1.4 数据处理
用 IBM SPSS19.0 软件统计分析数据和作图,测定结果用(平均值±标准误差)来表示。实验数据进行单因素差异分析(one-way analysis of variance,ANOVA),皮尔森相关性分析(pearson′s correlation analysis)。
2 结果与分析
2.1 不同品种蓝莓果实中活性成分分析
4个蓝莓中活性成分含量见表1。由表1结果可知,4个品种蓝莓果实中活性成分及其含量差异显著(P<0.05),粉蓝中没食子酸[(750.37±52.03) μg/g FW]、阿魏酸[(128.95±4.73) μg/g FW]和总黄酮[(3.08±0.01) mg/g]含量最高,粉蓝中没食子酸含量显著高于其他3品种,粉蓝中没食子酸含量是圆蓝[(51.13±1.11) μg/g FW]的14倍,与PERTUZATTI等(2012)的研究结果基本一致[17],绿原酸[(0.93±0.02) μg/g FW]、香豆酸[(2.78±0.05) μg/g FW]、槲皮素[(2.77±0.02) μg/g FW]含量最低;圆蓝中绿原酸含量[(56.62±2.16) μg/g FW]、鞣花酸[(79.01±3.51) μg/g FW]和芦丁[(30.41±1.88) μg/g FW]含量最高,绿原酸含量接近是巴尔德温[(0.59±0.02) μg/g FW]的100倍,鞣花酸含量是灿烂中的9倍,香豆酸、阿魏酸、总酚和花色苷含量最低;巴尔德温中槲皮素[(14.58±0.67) μg/g FW]、花色苷[(140.55±2.01) mg/100g FW]含量最高,显著高于其他3个品种,其中槲皮素是灿烂果实的5倍,鞣花酸[(74.35±2.65) μg/g FW]和芦丁[(0.59±0.02) μg/g FW]含量与圆蓝果实的无明显差异(P>0.05),绿原酸[(0.59±0.02) μg/g FW]、儿茶素[(2.60±0.19) μg/g FW]和表儿茶素[(1.09±0.38) μg/g FW]和总黄酮[(2.07±0.00) mg/g FW]含量最低;灿烂果实中儿茶素含量[(6.10±0.12) μg/g FW]、表儿茶素[(66.49±2.4) μg/g FW]、香豆酸[(7.57±0.43) μg/g FW]和总酚[(26.32±0.38) μg/g FW]显著(P≤0.001)高于其他3个品种,总酚含量是圆蓝[(12.79±0.57) mg/g FW]的2倍,表儿茶素含量是巴尔德温[(1.09±0.38) μg/g FW]的60倍,鞣花酸[(8.52±0.38) mg/g FW]、槲皮素[(2.54±0.06) mg/g FW]含量最低;粉蓝与灿烂中花色苷含量差异不显著(P>0.05)。
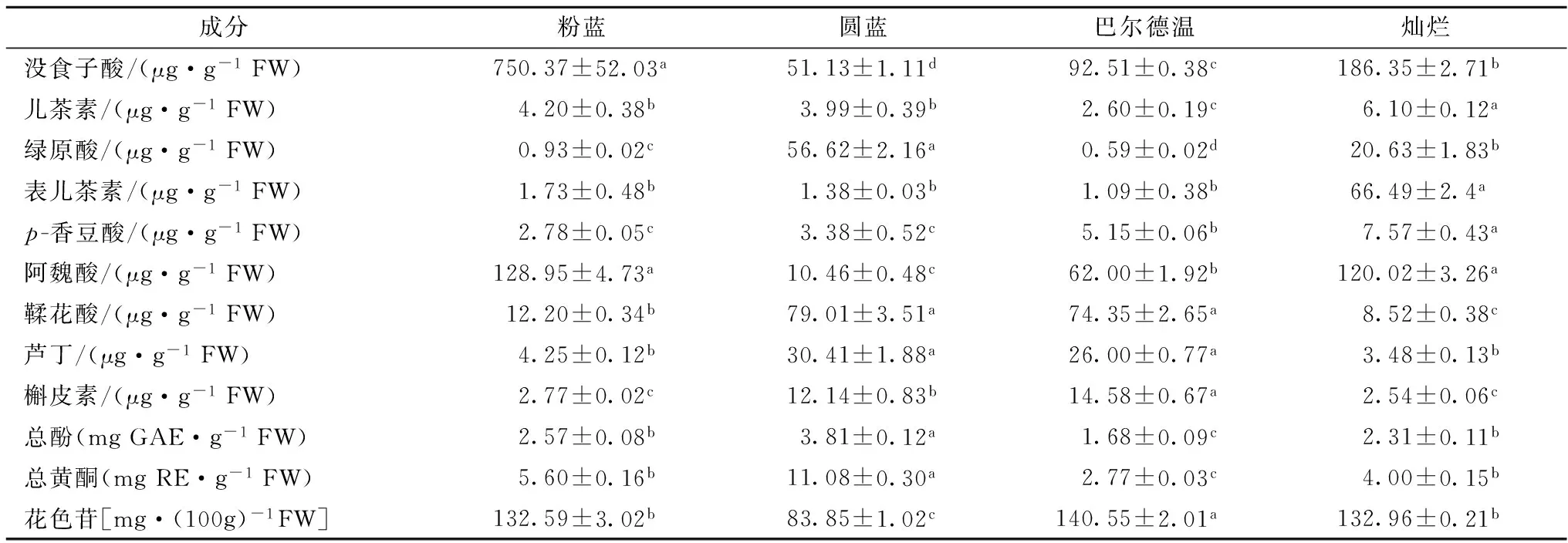
表1 不同品种蓝莓果实中活性成分分析
注:同一列不同字母表示差异显著(P<0.05)。
2.2 不同品种蓝莓果实抗氧化活性分析
不同蓝莓果实中抗氧化活性结果如图1所示。
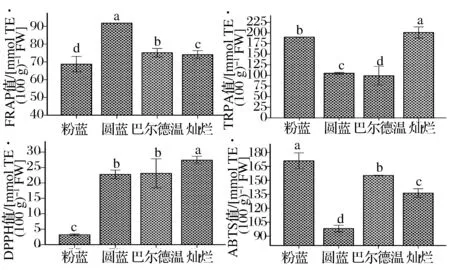
图1 不同品种蓝莓果实抗氧化活性分析Fig.1 Antioxidant activity analysis in blueberry of different cultivars
通过单因素方差分析,圆蓝的FRAP值[(91.78±0.00) mmol TE /g FW]显著高于其他3个品种(P<0.05);灿烂的TRPA[(200.04±8.12) mmol TE/100g FW]显著高于其他品种果实(P<0.05),圆蓝和巴尔德温的TRPA差异不显著(P>0.05),巴尔德温的TRPA[(99.09±5.17) mmol TE/100g FW]最低,仅为灿烂的1/2;灿烂的DPPH[(27.37±1.10) mmol TE/100g FW]显著高于其他3个品种(P<0.05),圆蓝和巴尔德温的DPPH值差异不显著(P>0.05),粉蓝的DPPH值[(3.21±0.68) mmol TE/100g FW]极其显著低于其他3个品种(P<0.001),仅为灿烂的1/8;粉蓝的ABTS值[(170.98±3.77) mmol TE/g FW]显著高于其他3个品种(P<0.05),圆蓝的ABTS值[(98.20±5.67) mmol TE/g FW]著低于其他3个品种(P<0.001)。
2.3 酚类物质及抗氧化活性的相关性分析
利用IBM SPSS Statistics 19软件对4个品种蓝莓果实的各项指标进行相关性分析结果如表2所示。由表2可知,多酚含量与阿魏酸含量呈极显著正相关,与表儿茶素含量呈显著正相关,与鞣花酸和芦丁含量呈极显著负相关,与槲皮素含量呈显著负相关;总黄酮含量与没食子酸、阿魏酸含量呈极显著正相关,与鞣花酸、芦丁和槲皮素呈极显著负相关;FRAP值与绿原酸呈极显著正相关,与鞣花酸和芦丁含量呈显著正相关,与阿魏酸和花色苷含量呈极显著负相关,与多酚和总黄酮呈显著负相关;TRPA值与阿魏酸、多酚和总黄酮呈极显著正相关,与儿茶素呈显著正相关,与鞣花酸和槲皮素呈极显著负相关,与芦丁呈显著负相关;DPPH值与没食子酸和总黄酮含量呈显著负相关;ABTS值与花色苷含量呈极其显著正相关,ABTS值与阿魏酸和花色苷含量呈显著正相关,与绿原酸和总黄酮呈极显著负相关;抗氧化活性指数与表儿茶素和p-香豆酸呈极显著正相关,与多酚呈显著正相关。
3 结论
不同品种间蓝莓果实的酚类物质成分及其含量差异显著,主要以没食子酸、绿原酸、阿魏酸和芦丁为主,粉蓝果实中含有丰富的没食子酸、阿魏酸和总黄酮,圆蓝果实中含有丰富的绿原酸、鞣花酸和芦丁,巴尔德温中含有丰富的槲皮素,灿烂果实中含有丰富的表儿茶素、p-香豆酸和多酚;蓝莓果实中酚类单体成分对不同抗氧化活性存在极其显著的差异,其中,绿原酸含量对FRAP值具有较强贡献,阿魏酸、多酚和总黄酮含量对TRAP值的极强贡献,而芦丁和槲皮素却呈极强的负相关;没食子酸含量对DPPH值的贡献最强;花色苷含量对ABTS值的贡献最强;表儿茶素和p-香豆酸对抗氧化活性指数具有极强的贡献。研究发现不同蓝莓品种果实的活性成分对其体外抗氧化活性的贡献并不相同,且对不同抗氧化活性评价指标的抗氧化效果也不相同,这与蓝莓果实中活性成分含量差异、粗提液中其他抗氧化成分的存在及其各种抗氧化评价方法的原理差异有着密切联系。

表2 各项指标的相关性分析
注:*表示显著(P<0.05);**表示极显著相关(P<0.01)。
因此,在后续研究中将对粗提物进行分离、纯化后结合体内外抗氧化活性评价和动物实验,综合各种抗氧化活性效果,进而合理评价各种因素对果蔬的抗氧化活性的影响。
[1] 贺强,吴立仁. 蓝莓果实中营养成分的生物学功能[J]. 北方园艺, 2011 (24): 222-224.
[2] WANG S Y, CAMP M J, EHLENFELDT M K. Antioxidant capacity and α-glucosidase inhibitory activity in peel and flesh of blueberry (Vacciniumspp.) cultivars[J]. Food Chemistry, 2012, 132(4):1 759-1 768.
[3] FLOIRENDO P F, RAKESH K S,WILLIAM L K, et al. In vitro release properties of encapsulated blueberry (Vacciniumashei) extracts[J]. Food Chemistry, 2015,168:225-232.
[4] 聂飞,房小晶,周红英,等. 我国蓝莓栽培现状及在贵州的产业化发展前景[J].贵州农业科学,2010,38(10):69-71.
[5] 谢国芳,谭彦,王瑞,等. 贵州主栽蓝莓晚熟品种及产地加工特性评价[J]. 食品与发酵工业,2016,42(1):128-133.
[6] 谢国芳,王瑞,刘晓燕.采前二氧化氯喷施处理对蓝莓保鲜效果的影响.现代食品科技,2014,30(6),207-213.
[7] 王瑞,岑顺友,谢国芳,等. 不同晚熟蓝莓贮藏期间的品质变化研究[J].现代食品科技, 2014,30(3):43-48.
[8] 朱颖,孙晓红,姜文洁,等. 四种北高丛蓝莓提取物抗氧化作用的研究[J]. 食品工业科技,2014,35(22):119-123.
[9] 李斌,雷月,孟宪军,等. 蓝莓营养保健功能及其活性成分提取技术研究进展[J]. 食品与机械,2015(06):251-254.
[10] HUANG W, ZHANG H, LIU W, et al. Survey of antioxidant capacity and phenolic composition of blueberry, blackberry, and strawberry in Nanjing[J]. Journal of Zhejiang University Science B, 2012, 13(2): 94-102.
[11] RODRIGUEZ-MATEOS A, CIFUENTES-GOMEZ T, TABATABAEE S, et al. Procyanidin, anthocyanin, and chlorogenic acid contents of highbush and lowbush blueberries[J]. Journal of Agricultural and Food Chemistry, 2012, 60(23): 5 772-5 778.
[12] 张杨,谢笔钧,孙智达. 蓝莓酒渣、果、酒中花色苷成分鉴定及酒渣与果中花色苷抗氧化活性比较[J]. 食品科学,2016,37(2): 165-171.
[13] 谢国芳,王瑞,周笑犁,等. 蓝莓花色苷稳定性研究进展[J]. 北方园艺, 2016(7): 190-194.
[14] 程佑声,王鸿飞,许凤,等. 蓝莓皮渣花色苷提取及抗氧化活性的研究[J]. 果树学报,2015,32(4):696-704.
[15] 曹雪丹, 方修贵, 赵凯, 等. 蓝莓花色苷研究进展[J]. 中国农学通报, 2012, 28(15): 221-226.
[16] 刘翼翔,吴永沛,刘光明,等. 野生蓝莓酚酸成分鉴定及其清除细胞内自由基活性研究[J]. 中国食品学报,2015,12:173-179.
[17] PERTUZATTI B P, T BARCIA M, C JACQUES A, et al. Quantification of several bioactive compounds and antioxidant activities of six cultivars of Brazilian blueberry[J]. The Natural Products Journal, 2012, 2(3): 188-195.
[18] DASTMALCHI K, FLORES G, PETROVA V,et al. Edible neotropical blueberries: antioxidant and compositional fingerprint analysis[J]. Journal of Agricultural and food chemistry, 2011, 59(7): 3 020-3 026.
[19] BUCKOW R, KASTELL A, TEREFE N, et al. Pressure and temperature effects on degradation kinetics and storage stability of total anthocyanins in blueberry juice[J]. Journal of Agricultural and Food Chemistry, 2010, 58(58): 10 076-10 084.
[20] 白鸽,郭玉蓉,陈磊,等. 苹果着色与冷藏期间多酚及相关酶活性的关系[J].食品科学,2015,36(6):246-250.
[23] TODOROVIC V, REDOVNIKOVIC I R, TODOROVIC Z, et al. Polyphenols, methylxanthines, and antioxidant capacity of chocolates produced in Serbia[J]. Journal of Food Composition and Analysis, 2015,41: 137-143.
[24] TAUCHEN J, MARSIK P, KVASNICOVA M, et al. In vitro antioxidant activity and phenolic composition of Georgian, Central and West European wines[J]. Journal of Food Composition and Analysis, 2015,41:113-121.
[25] OLIVEIRA I, BAPTISTA P, MALHEIRO R, et al. Influence of strawberry tree (ArbutusunedoL.) fruit ripening stage on chemical composition and antioxidant activity[J]. Food Research International, 2011, 44(5): 1 401-1 407.
[26] SCHAICH K M, TIAN X, XIE J. Hurdles and pitfalls in measuring antioxidant efficacy: A critical evaluation of ABTS, DPPH, and ORAC assays[J]. Journal of Functional Foods, 2015, 14: 111-125.
Evaluation of bioactive compounds and antioxidant activity of major blueberry cultivars in Guizhou province
XIE Guo-fang*, WANG Xin-hua, WANG Rui, JIN Chuan-xu,ZHOU Xiao-li, LIU Zhi-gang, ZHENG Xiong
(Food and Pharmaceutical Engineering Institute, Guizhou Engineering Research Center for Fruit Processing,Guiyang University, Guiyang 550005, China)
To investigate the phenolics compounds and antioxidant activity of major blueberry cultivars in Guizhou province, the phenolics compounds, polyphenols, total flavonoids, anthocyanin, and in vitro antioxidant activity of four cultivars in Guizhou province were analyzed using Pearson's correlation analysis. The results indicated that the major phenolic compounds, including gallic acid, epcatechin, rutin,p-coumaric acid, quercetin, catechin, ellagic acid, chlorogenic acid and ferulic acid in the tested blueberry fruits were the highest. The contents of phenolic compounds were significantly different in the 4 cultivars (P<0.05), the gallic acid, ferulic acid and total flavonoids of Powderblue was the highest, the chlorogenic acid, ellagic acid and rutin of Gardenblue was the highest, the quercetin and anthocyanin of Baldwin were the highest, the catechin, epcatechin,p-coumaric acid and polyphenols of Bright Well was the highest. Antioxidant activities of four cultivars were significantly different (P<0.05), and the highest antioxidant activity of Bright Well was the highest. The difference of phenolic compounds on the antioxidant activity was significant (P<0.05). Chlorogenic acid has a strong contribution to FRAP value. The ferulic acid, total polyphenols and total flavonoids has a strong contribution to TRAP value; the gallic acid has a strong contribution to DPPH value, the anthocyanin has a strong contribution to ABTS value. The antioxidant potential composite index (ACI) showed a significant positive correlation with the content of epcatechin andp-coumaric acid (P<0.01).
blueberry; bioactive composition; antioxidant activity; correlation analysis
10.13995/j.cnki.11-1802/ts.201702030
硕士,副教授(本文通讯作者,E-mail:xieguofang616@sina.com)。
贵州省教育厅自然科学研究重点项目(黔教合KY字[2014]276);国家级大学生创新创业训练计划项目(201510976029);贵州省科技厅—贵阳市科技局—贵阳学院联合基金(黔科合LH字[2014]7179号)
2016-06-09,改回日期:2016-07-04

